miR-126在自发性高血压大鼠的表达及其与血管重构的关系
2020-11-04李先芳
李先芳 林 璋
福建省老年医院心血管内科,福建福州 350000
血管重构是高血压最主要的病理生理改变,也是高血压损害靶器官的结构基础[1-2]。文献表明原发性高血压患者的颈动脉发生明显病理改变,主要表现为血管直径和内膜中层厚度明显增加,这种病理改变即为颈动脉血管重构[3-5]。Ⅰ型胶原蛋白(collagenⅠ,ColⅠ)和Ⅲ型胶原蛋白(collagenⅢ,ColⅢ)是细胞外基质的主要成分,两者的表达水平一定程度上可以反映血管壁重构的程度[6]。研究表明,基因突变、内皮功能损伤和炎症反应均可能导致血管重构的发生[7],但是其具体机制尚未清楚。微小RNA(microRNA,miRNA)是单链非编码的高度保守型小分子RNA,对基因起着负调控的作用。文献表明miRNA在心血管疾病包括高血压的发生和发展中扮演着重要作用[8]。研究发现,miR-126高表达于血管内皮细胞,参与维持血管正常内皮功能,对血管生成具有调控作用[9]。本研究旨在通过检测miR-126在自发性高血压大鼠中颈动脉的表达,探讨其在高血压颈动脉血管重构中的作用。
1 材料与方法
1.1 实验动物与主要试剂
实验动物:20周龄的雄性SHR大鼠和WKY大鼠各12只,体重(200±10)g,动物购自湖南斯莱克景达实验动物有限公司,动物许可证编号:SCXK(湘)2010-000。SHR大鼠为实验组,WKY大鼠为对照组。
实验仪器:XR900无创大鼠血压心率测定仪(上海欣软信息科技有限公司),Thermo Veriti7500实时荧光定量PCR仪,Alpha-1860S紫外可见分光光度计。
实验试剂:Trizol 试剂(Invitrogen),RT-PCR 试剂盒(Invitrogen)。RT-PCR引物序列见表1。
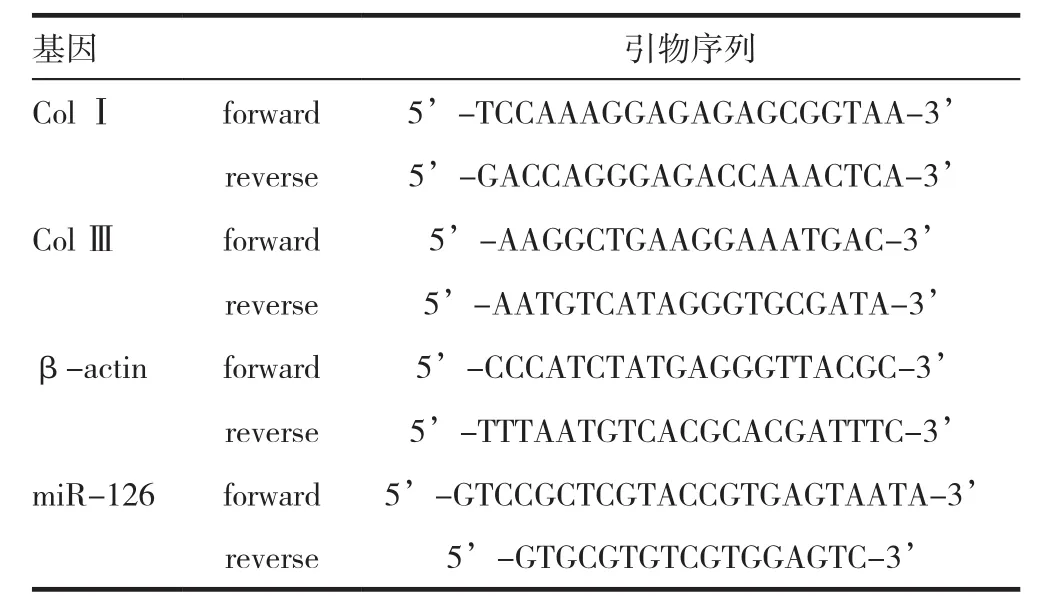
表1 RT-PCR引物序列
1.2 血压测量
两组大鼠培养条件为:12h日夜交替、(24±2)℃和相对湿度60%,从20周龄培养至34周龄,期间每隔2周进行血压测量,使用无创大鼠血压心率测定仪测量大鼠尾部动脉收缩压,每次重复测量3次,取3次的平均值为最终结果。
1.3 小鼠颈动脉RNA提取及RT-PCR检测
于34周,处死小鼠并取其颈动脉组织。然后将颈动脉组织至于液氮中保存。从液氮保存的组织中取5mg颈动脉组织,Trizol试剂盒提取总RNA,然后逆转录合成cDNA,根据RT-PCR试剂盒说明书和前期文献描述步骤[10],利用RT-PCR检测颈动脉 Col Ⅰ、Col Ⅲ和 miR-126的表达。以 β-actin为对照,采用 2-ΔΔCt方法分析 Col Ⅰ、Col Ⅲ和miR-126的相对表达量。
1.4 统计学方法
采用SPSS19.0统计学软件对数据进行分析,采用t检验对两组数据进行统计学分析;采用Pearson方法分析miR-126与血管重构的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 两组收缩压比较
观察组大鼠从20~34周期间收缩压均高于140mm Hg,为高血压,对照组大鼠20~34周期间收缩压均低于140mm Hg,血压正常。观察组收缩压显著高于对照组,差异有统计学意义(P<0.05),见表2。
2.2 血管结构观察
与对照组比较,观察组大鼠颈动脉血管腔径显著小于对照组,观察组中膜厚度、中膜横截面积、中膜厚度/腔径显著大于对照组,差异均有统计学意义(P< 0.05),见表 3。
2.3 颈动脉Ⅰ、Ⅲ型胶原蛋白的表达
颈动脉Col Ⅰ和Col Ⅲ的表达水平一定程度上可以反映颈动脉重构程度。利用RT-PCR技术检测对照组和观察组劲动脉Col Ⅰ和Col Ⅲ的表达,结果显示观察组Col Ⅰ和Col Ⅲ均显著高于对照组,差异有统计学意义(P<0.05),见图1。
表2 两组大鼠收缩压比较

表2 两组大鼠收缩压比较
组别 20周 22周 24周 26周 28周 30周 32周 34周观察组 166.51±5.04 164.65±4.12 167.33±6.26 168.37±4.45 165.98±5.47 167.39±4.24 168.53±5.19 170.84±4.36对照组 116.35±4.26 117.62±5.93 117.99±5.14 119.41±5.82 121.75±6.42 120.63±7.26 119.79±5.21 120.25±6.14 t 26.330 22.562 21.102 23.150 18.166 19.266 22.959 23.272 P 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000
表3 两组颈动脉血管结构参数比较()
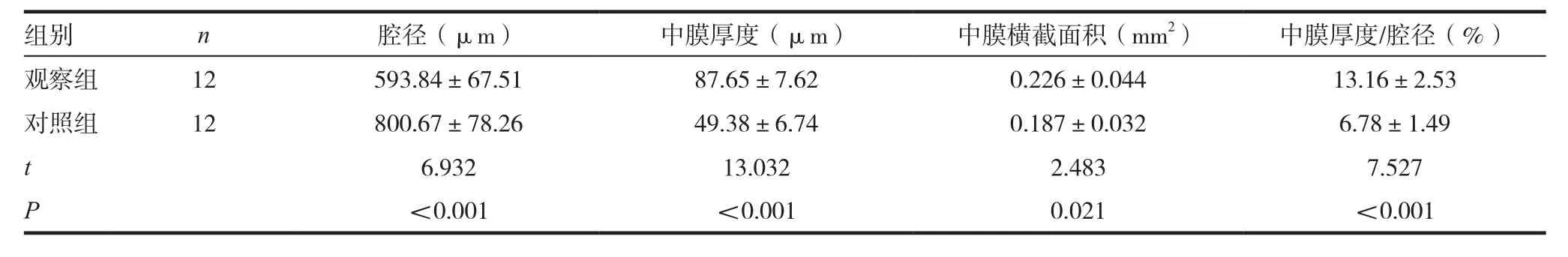
表3 两组颈动脉血管结构参数比较()
组别 n 腔径(μm) 中膜厚度(μm) 中膜横截面积(mm2) 中膜厚度/腔径(%)观察组 12 593.84±67.51 87.65±7.62 0.226±0.044 13.16±2.53对照组 12 800.67±78.26 49.38±6.74 0.187±0.032 6.78±1.49 t 6.932 13.032 2.483 7.527 P<0.001 <0.001 0.021 <0.001

表4 miR-126与颈动脉重构的相关性分析
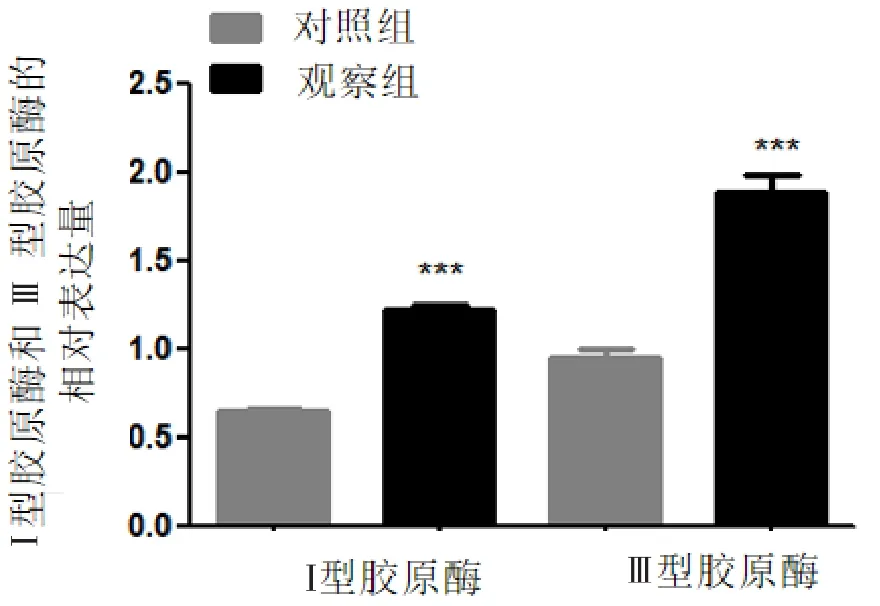
图1 Ⅰ型胶原蛋白和Ⅲ型胶原蛋白在对照组和观察组的相对表达
2.4 miR-126在颈动脉组织的表达
RT-PCR结果显示观察组miR-126表达显著低于对照组,差异有统计学意义(P<0.05),见图2。
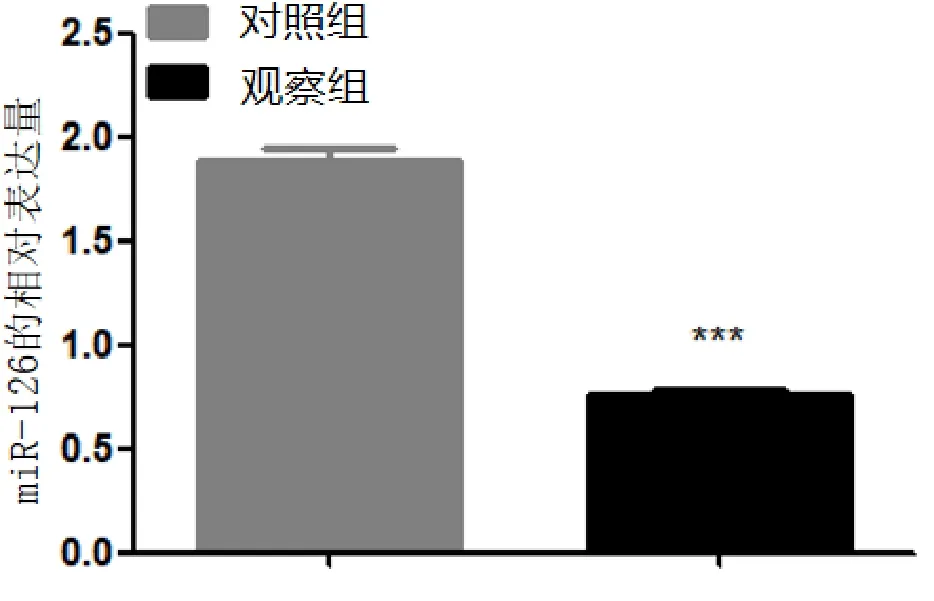
图2 miR-126在对照组和观察组颈动脉的相对表达量
2.5 miR-126表达与颈动脉血管重构相关性分析
经Pearson相关性分析,发现miR-126与中膜厚度、中膜横截面积、中膜厚度/腔径、ColⅠ型胶原蛋白和ColⅢ型胶原蛋白表达均为负相关(P<0.05),miR-126与腔径均无显著相关性,见表4。
3 讨论
高血压是常见心血管疾病,也是导致心血管不良事件的主要原因之一。目前对原发性高血压的具体发病机制尚不清楚,随着研究的深入,近年来,基础医学发现血管重构既是高血压患者重要的病理改变表现,同时又是维持高血压状态、导致靶器官受损的原因[11]。颈动脉是脊椎动物最主要的大动脉之一,该动脉的管壁含有大量的胶原蛋白和弹性蛋白,具有良好的弹性,以缓冲血压的冲击[12-13]。高血压患者的血管变化主要为血管壁变硬,弹性下降,顺应性下降,血管管腔变窄,对血压的缓冲能力减弱。miRNA是一段保守的单链非编码RNA,可以调控人体约30%的基因表达,参与细胞的增殖和凋亡,被称为是基因的转录后调节器[14]。近年来研究发现miRNA参与高血压的发病过程,但其与血管重构是否存在相关性还有待研究[15-16]。
本研究以SHR大鼠为观察组,WKY大鼠为对照组,研究两组的血压和颈动脉血管结构差异。发现从20~34周,观察组大鼠收缩压均符合高血压特征,且显著高于对照组。34周龄时,观察组大鼠颈动脉血管腔径明显缩小,中膜厚度、中膜横截面积、中膜厚度/腔径明显增加。而血管壁变厚、中层细胞肥大、细胞外基质扩充是血管重构的最显著征象[17-18],在本研究中,观察组颈动脉血管的形态发生显著变化,为颈动脉发生重构提供一定的证据。细胞外基质的改变是血管重构的另一重要特征,在血管壁增厚变硬的过程中,胶原纤维的含量直接决定血管的弹性。Col Ⅰ和Col Ⅲ型胶原蛋白是细胞外基质的主要成分,两者的表达变化是血管壁重构的基础。本研究发现观察组Col Ⅰ型和Col Ⅲ型表达显著增加,且Col Ⅲ型增加较为显著,说明SHR大鼠颈动脉发生重构,与薛扬等[2]研究报道一致。
miRNA可以通过调控细胞分化、炎症反应、细胞增殖和内皮功能等多种途径参与血管重构。研究发现miRNA具有调节内皮细胞生长因子的作用,而内皮细胞是维持血管功能动态平衡的关键因素[19]。miR-126是一种特异高表达于内皮细胞的miRNA,其表达水平与内皮细胞功能和血管重构密不可分[20]。本研究发现观察组miR-126表达显著低于对照组,说明miRNA低表达可能与血管重构相关。目前相关研究已经证实miR-126可以通过调节相关酶的活性促进血管内皮生长因子和碱性成纤维细胞生长因子的表达来维持内皮功能[21],体外实验发现miR-126的敲除会直接影响血管内皮生长因子依赖的下游通路受损,引起血管生产缺陷[22]。miR-126还能通过丝氨酸/苏氨酸蛋白激酶1通路调节血管结构完整性[23]。进一步分析,发现miR-126的表达水平与中膜厚度、中膜横截面积、中膜厚度/腔径、Col Ⅰ和Col Ⅲ均为负相关,说明miR-126低表达可能是导致血管重构的原因之一。
综上所述,自发性高血压大鼠颈动脉组织miR-126表达显著降低,与中膜厚度、中膜厚度/腔径、Col Ⅰ和 Col Ⅲ均为负相关,miR-126 有望成为高血压治疗的新靶点。
