非小细胞肺癌根治术后EGFR基因突变状态对EGFR-TKI靶向治疗效果的影响*
2020-11-03吴志美喻海忠桑玉玉
吴志美,喻海忠,桑玉玉
(江苏省南通市中医院检验科,江苏南通 226001)
非小细胞肺癌属原发性肺癌中最常见类型,据报道,近年来,其发病率呈逐年上升的趋势,占肺癌的80%~85%,可能与吸烟、电离辐射等有关[1]。目前,根治性手术是治疗早期非小细胞肺癌的标准治疗方案,但有报道显示,ⅠA~ⅡB期患者术后5年生存率仅为50%~80%,ⅢA期者仅为10%~30%[2]。已有研究证实肿瘤局部复发及远处转移是非小细胞肺癌根治性手术治疗失败与患者死亡的主要因素,而术后辅以化疗,可预防癌症转移、复发,延长患者生存期[3]。但有报道指出,含铂类的标准化化疗方案仅对30%左右的非小细胞肺癌患者有效,且不良反应较多[4]。有研究显示,表皮生长因子受体(EGFR)家族参与细胞增殖、凋亡、运动及新血管形成,是肿瘤形成的关键因素;而EGFR酪氨酸激酶抑制剂(EGFR-TKI)已被临床公认为是治疗非小细胞肺癌有效的靶向药物,尤其对EGFR基因突变型晚期非小细胞肺癌者,能取得良好的临床疗效,且普遍存在良好的依从性和耐受性[5]。但有报道指出,EGFR基因突变状态是影响患者靶向治疗效果的重要因素,其对非小细胞肺癌根治术后辅助化疗效果的影响及EGFR-TKI靶向治疗联合化疗影响的结论尚不一致[6]。基于此,笔者针对此方面展开相关研究,以供临床参考,现报道如下。
1 资料与方法
1.1一般资料 选取2017年3月至2018年1月本院收治的80例非小细胞肺癌根治术后患者为研究对象。纳入标准:(1)非小细胞肺癌临床诊断参考《2010中国肺癌临床指南》[7],均经病理学、细胞学、组织学等检查确诊,且均已行单纯根治性手术,入组前未接受除单纯根治性手术外的任何抗肿瘤治疗,预计生存期>6个月;(2)根据文献[8]提到的病理TNM分期标准,患者TNM分期为ⅠB~ⅢA期;(3)年龄≥18岁,体能状况(PS)评分≤2分;(4)首次接受术后辅助治疗[化疗和(或)靶向治疗],且均可耐受;(5)首次接受EGFR基因突变检测,无相关禁忌证。排除标准:(1)心、肾、肺等重要脏器功能不全及精神疾病;(2)ⅢB期及Ⅳ期非小细胞肺癌;(3)合并其他恶性肿瘤;(4)伴肺心病、肺气肿、慢性支气管炎或其他严重疾病;(5)过敏体质或对本研究所涉及的药物过敏;(6)妊娠或哺乳期女性。80例非小细胞肺癌根治术后患者中,EGFR野生型36例,EGFR突变型44例。按照EGFR基因突变检测结果,将80例患者中36例EGFR野生型者纳为A组;其余44例患者均为EGFR突变型,按照随机数字表法分为B组(24例)和C组(20例)。3组均自术后第2周起接受顺铂+多西紫杉醇化疗方案治疗,以21 d为1个化疗周期,持续4个周期;其中,C组于化疗结束2周后行EGFR-TKI靶向治疗。
1.2方法
1.2.1治疗方法 (1)手术方案:根治性手术具体方法参考文献[9]。(2)化疗方案:所有患者均自术后第2周起接受顺铂+多西紫杉醇化疗方案,以21 d为1个化疗周期,持续4个化疗周期。(3)EGFR-TKI靶向治疗方案:单药口服厄洛替尼。维持用药4~8个月。注意治疗期间,若有不可耐受的药物不良反应出现时,予以停药处理。
1.2.2EGFR基因突变检测方法 (1)标本采集及DNA提取。入院后采集患者清晨空腹静脉血3 mL,置入带分离胶的黄色促凝管中,常温下静置4 h后室温下3 000 r/min离心10 min,留取上层血清后置入Eppendorf管中,于-80 ℃保存备用。参考DNA提取试剂盒(德国Qiagen公司,QIAamp Blood Mini Kit型)操作说明书,提取DNA。结束后,采用Nanodrop2000核酸定量仪(美国Thermo公司),行DNA浓度及纯度测定,光密度(A)值(A260 nm/A280 nm)维持1.8~2.0。纯度要求满足后行DNA质量凝胶电泳检测,置入-20 ℃冰箱保存备用,保存时间<6个月。(2)EGFR基因突变检测步骤。将阳性质控品及Tap酶(EGFR21)取出,先行阳性质控品解冻处理,后振荡混匀,快速离心15 s待用。Tap酶(EGFR21)快速离心15 s备用。在45 μL阳性质控品及45 μL待测样品DNA中均加入2.25 μL Tap酶(EGFR21),在45 μL超纯净水中加入2.25 μL Tap酶(EGFR21),涡旋器上混匀后快速离心15 s。于聚合酶链反应(PCR)管冰架上,将8联PCR管反应条条盖揭开。将混匀的DNA样品依次取5 μL,沿PCR管的管壁加入8联PCR管反应条中。采用突变特异性扩增系统法(ARMS)行PCR扩增,检测EGFR基因外显子18、19、20、21突变情况。待8联PCR管反应条离心或轻甩处理后放入7300型荧光定量PCR仪(美国ABI公司)进行扩增。具体扩增程序如下:第1阶段,95 ℃ 5 min,1个循环;第2阶段:95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15个循环;第3阶段:93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,31个循环;第4阶段,60℃时进行FAM、HEX信号收集,执行实时PCR。(3)检测结果判读。确定样品各反应管中突变Ct值及对应样品外控Ct值。当样品突变Ct值为阴性临界值及以上时,判定此样品为阴性或样品浓度低于检测试剂盒下限;当样品突变Ct值低于阴性临界值,且反应管突变Ct值低于阳性临界值时,该样品则属突变阳性;当样品突变Ct值低于阴性临界值,且反应管突变Ct值为阳性临界值及以上时,按照该反应管ΔCt(ΔCt=突变Ct-外控Ct)进行结果判定。若ΔCt低于对应ΔCt的Cut-off时,则属突变阳性,反之则为阴性或低于检测限值。
1.2.3血清肿瘤标志物的检测 分别于治疗前及治疗6个月时,采集患者静脉血3 mL,肝素抗凝,以2 500 r/min的速度离心10 min,取上层血清置于-20 ℃冰箱保存待测。采用i2000型化学发光免疫分析仪(美国雅培公司),以电化学发光法检测血清神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、糖类抗原125(CA125)水平,试剂盒均购自美国雅培公司。
1.2.4不良反应的判断 参照美国国立癌症研究所制定的不良反应分级标准3.0版本[10],分析骨髓抑制、神经毒性等不良反应发生情况。
1.3观察指标 跟踪观察18个月,主要观察指标包括治疗前及治疗6个月时血清肿瘤标志物水平、化疗及靶向药物不良反应和6、12、18个月无病生存率。

2 结 果
2.13组临床资料比较 3组临床资料比较,差异均无统计学意义(P>0.05),见表1。

表1 3组临床资料比较
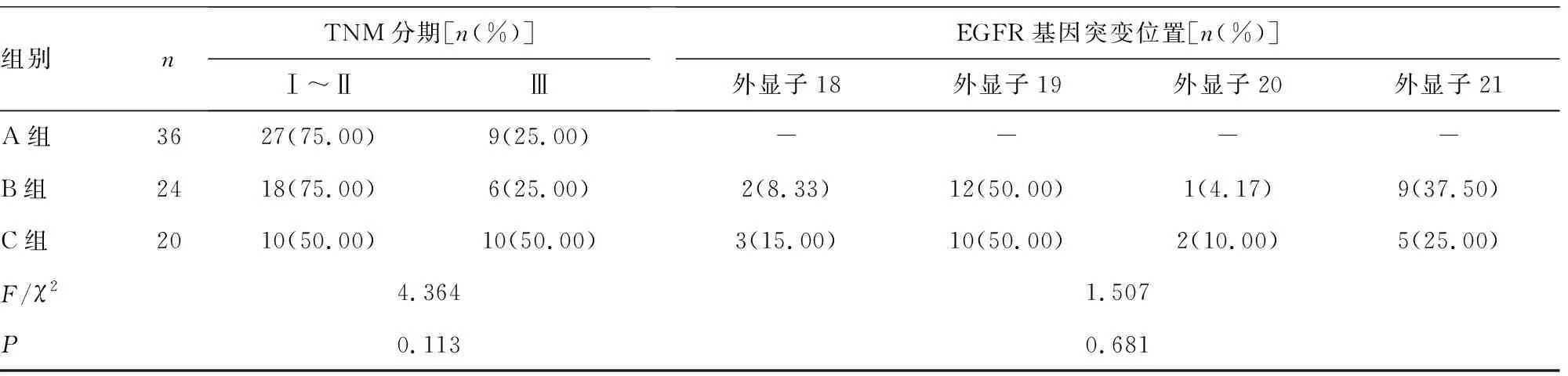
组别nTNM分期[n(%)]Ⅰ~ⅡⅢEGFR基因突变位置[n(%)]外显子18外显子19外显子20外显子21A组3627(75.00)9(25.00)----B组2418(75.00)6(25.00)2(8.33)12(50.00)1(4.17)9(37.50)C组2010(50.00)10(50.00)3(15.00)10(50.00)2(10.00)5(25.00)F/χ24.3641.507P0.1130.681
2.23组血清肿瘤标志物水平比较 3组治疗前血清NSE、CEA、CA125水平比较,差异均无统计学意义(P>0.05);3组治疗6个月时上述指标均显著低于治疗前(P<0.05);A组治疗6个月时上述指标均显著高于B、C组(P<0.05),B组治疗6个月时上述指标均显著高于C组(P<0.05),见表2。

表2 3组血清肿瘤标志物水平比较
2.33组不良反应发生情况比较 3组不良反应发生率比较,差异均无统计学意义(P>0.05),见表3。C组对EGFR-TKI靶向治疗药物耐受性均较好,仅4例(20.00%)发生Ⅰ度肝、肾损害,2例(10.00%)发生Ⅰ度胃肠道反应。

表3 不良反应发生情况比较[n(%)]
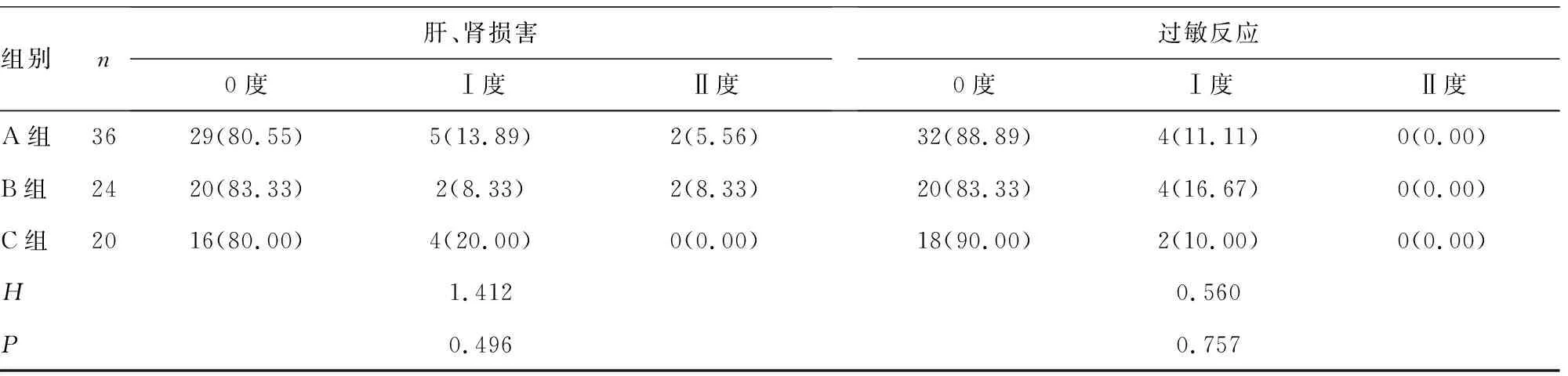
组别n肝、肾损害0度Ⅰ度Ⅱ度过敏反应0度Ⅰ度Ⅱ度A组3629(80.55)5(13.89)2(5.56)32(88.89)4(11.11)0(0.00)B组2420(83.33)2(8.33)2(8.33)20(83.33)4(16.67)0(0.00)C组2016(80.00)4(20.00)0(0.00)18(90.00)2(10.00)0(0.00)H1.4120.560P0.4960.757
2.43组无病生存率比较 A组6、12、18个月无病生存率分别为75.00%(27/36)、55.56%(20/36)、44.44%(16/36),B组分别为100.00%(24/24)、83.33%(20/24)、75.00%(18/24),C组分别为100.00%(20/20)、100.00%(20/20)、90.00%(18/20)。经Log-rank检验,3组6个月无病生存率比较,差异无统计学意义(χ2=0.221,P=0.637)。A组12个月无病生存率显著低于C组,差异有统计学意义(χ2=4.485,P=0.030);A、B组12个月无病生存率比较差异无统计学意义(χ2=2.109,P=0.145),B、C组12个月无病生存率比较差异无统计学意义(χ2=1.284,P=0.258)。A组18个月无病生存率显著低于B、C组,差异有统计学意义(χ2=4.462、6.105,P=0.035、0.013);B、C组18个月无病生存率比较差异无统计学意义(χ2=1.260,P=0.262)。
3 讨 论
非小细胞肺癌是最常见的恶性肿瘤之一,早中期治疗主要以根治性手术为主,但有报道显示,其术后总复发和转移率为30%~70%[11]。而目前多项研究表明,针对高危ⅠB~ⅢA期根治性手术后的非小细胞肺癌患者,行含铂类两药化疗方案常规治疗4个周期,可明显提高5年生存率[12-13]。非小细胞肺癌根治术后行含铂类两药化疗方案能有效清除微小转移灶及微小残存灶,并将外周血循环肿瘤细胞清除,促使局部复发及远处转移减少,改善患者远期生存状况。但目前关于EGFR突变型患者与EGFR野生型患者对化疗疗效的差异性仍存在争议[14-15]。
本研究结果显示,3组治疗6个月时血清NSE、CEA、CA125水平均明显低于治疗前;而A组治疗6个月时上述指标均明显高于B、C组,B组治疗6个月时上述指标均明显高于C组(P<0.05),提示非小细胞肺癌根治术后EGFR基因突变状态对EGFR-TKI靶向治疗及化疗疗效有明显影响。以往报道显示,CEA、CA125等肿瘤标志物在非小细胞肺癌等恶性肿瘤患者中会出现一定程度的升高[16]。且EGFR突变型非小细胞肺癌患者化疗后血清NSE、CEA、CA125水平较野生型患者低[17-18]。笔者认为,顺铂+多西紫杉醇化疗方案可有效减少肿瘤负荷,降低肿瘤恶性程度,促使血清NSE、CEA、CA125水平下降,但EGFR野生型和EGFR突变型患者血清肿瘤标志物水平差异有统计学意义(P<0.05),可能与其抑制原癌基因过度表达、增加抑癌基因表达量等有关。而EGFR-TKI靶向治疗能进一步清除恶性肿瘤细胞内DNA合成,加快机体对恶性肿瘤细胞的清除,使血清肿瘤标志物水平降低。
本研究结果显示,3组6个月无病生存率差异无统计学意义(P>0.05),且A组18个月无病生存率显著低于B组,差异有统计学意义(P<0.05),说明非小细胞肺癌根治术后EGFR基因突变状态影响术后辅助化疗疗效。分析原因,有丝分裂原活化蛋白激酶途径属细胞增殖、分化、凋亡调节的信号传导通路,铂类药物可通过激活有丝分裂原活化蛋白激酶通路,促使细胞凋亡;而EGFR基因突变易诱发EGFR过表达,亦通过激活有丝分裂原活化蛋白激酶通路,促使肿瘤细胞对化疗的敏感性增加,但具体机制尚不明确。此外,本研究结果显示,A组12、18个月无病生存率明显低于C组,证实术后采用EGFR-TKI靶向治疗联合化疗的EGFR突变型患者无病生存率明显优于术后单纯化疗的EGFR野生型者。有报道通过对167例ⅠB~ⅢA期行肺腺癌根治术的患者进行系统研究,发现含铂类化疗联合EGFR-TKI靶向治疗的EGFR基因突变型患者2年无病生存率达87.4%,明显优于术后单纯化疗的EGFR野生型者(71.2%),与本研究结果相似[19]。原因可能为EGFR-TKI靶向治疗能进一步抑制根治性手术后的残存病灶、微转移灶与外周血循环中肿瘤细胞,但具体机制有待今后深入研究。笔者认为,EGFR靶向治疗经特定分子靶向药物识别及攻击肿瘤细胞特定分子靶点,可控制肿瘤发展、侵袭、转移,改善患者生存情况。此外,本研究中B组与C组12、18个月无病生存率差异无统计学意义(P>0.05),可能与观察时间较短、选取病例数偏少有关。
另外,本研究发现,3组化疗不良反应发生率差异无统计学意义(P>0.05),说明3组化疗的不良反应均较轻。而本研究中,C组接受EGFR-TKI靶向治疗,仅4例发生肝、肾损害,2例发生Ⅰ度胃肠道反应,预示患者耐受性良好,证实EGFR-TKI靶向治疗安全性较高。笔者认为,术后辅助化疗联合EGFR-TKI靶向治疗,不良反应较轻,无严重后遗症,患者耐受性较好。
4 结 论
综上所述,非小细胞肺癌根治术后EGFR基因突变状态对EGFR-TKI靶向治疗效果具有重要影响,临床应引起足够重视。但本文因样本量偏小,观察时间受限,结果可能存在偏倚,故今后需深入探讨。
