中国传统发酵乳中嗜热链球菌H2的培养及益生特性评价
2020-11-03刘冬梅胡金双黄泳尧黄燕燕
刘冬梅 胡金双 黄泳尧 黄燕燕
(华南理工大学 食品科学与工程学院,广东 广州 510640)
相对于欧美国家,发酵乳制品在中国起步虽晚,但发展迅速,产量逐年大幅增加[1]。然而进口发酵剂几乎占据了我国发酵剂市场的全部份额[2],发酵剂的长期受制于人会限制我国乳品业的发展速度。研发具有自主知识产权的发酵剂是促进我国乳业发展的重要途径之一,而筛选源于中国本土传统发酵制品的新菌株,并对其潜在特性进行研究是研发自主知识产权发酵剂的基础。
嗜热链球菌(Streptococcusthermophilus)是仅次于乳酸乳球菌(Lactococcuslactis)的第二大工业乳酸菌菌种[3],是乳品发酵剂的主要菌株之一。其产酸[4]、产胞外多糖[5]、产风味物质[6-7]等性能直接关系到发酵乳的品质。其产生的乳酸可以赋予发酵乳酸爽的口感,同时可提高产品的保藏性能,促进人体的胃肠蠕动,促进蛋白、矿物质等的消化吸收[8]。在实际生产中,球菌的繁殖能力相对弱于杆菌,随着传代次数的增加,球菌的占比会逐渐减小[9],因此优化得到适宜嗜热链球菌生长的培养基和培养条件是发酵剂制备的重要内容之一。
嗜热链球菌是具有益生性质的发酵剂菌株,其益生性质可使发酵乳制品具有功能性,满足消费者“绿色、健康、功能性”的追求。研究表明,嗜热链球菌能够合成多种维生素,如叶酸等[10];刺激机体的免疫系统,提高机体抗病能力[11];抑制或清除病原菌产生的毒素,净化肠道环境[12];产生乳糖酶,有效缓解乳糖不耐症[13]。此外,乳酸菌胞内存在多种与抗氧化有关的酶系和活性物质,可用于功能性食品或天然抗氧化添加剂的研发与生产[14]。
本研究从中国传统发酵乳——内蒙古家庭自制酸奶中筛选得到了一株嗜热链球菌H2(简称H2),对其增殖培养基和培养条件进行了优化,同时对其体外益生性质做了初步探究,为该菌用于发酵具有益生价值的产品提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
实验样品为内蒙古自治区呼和浩特市的家庭自制酸奶。
1.1.2 材料与试剂
MRS培养基:牛肉膏10 g/L、酵母膏5 g/L、蛋白胨10 g/L、葡萄糖20 g/L、柠檬酸三铵2 g/L、乙酸钠5 g/L、七水硫酸镁0.2 g/L、四水硫酸锰0.05 g/L、磷酸氢二钾2 g/L、吐温-80 1 g/L、pH=6.4±0.2.
丙氨酸、半胱氨酸、甘氨酸、组氨酸、蛋氨酸、酪氨酸购自BBI生命科学有限公司;其余试剂购自天津市大茂化学试剂厂。
1.2 仪器与设备
立式压力蒸汽灭菌锅、SW-CJ-1F型超净工作台购自上海博讯实业有限公司;HWS型恒温恒湿培养箱购自宁波东南仪器有限公司;生物显微镜购自凤凰光学股份有限公司;JW-3021HR型高速冷冻离心机购自安徽嘉文仪器装备有限公司;FE20 Plus pH计购自梅特勒-托利多仪器有限公司;多功能微孔板检测仪购自美国BioTek公司;高效液相色谱仪购自美国赛默飞世尔公司;冷场发射扫描电镜Regulus 8100购自日立公司。
1.3 实验方法
1.3.1 菌株分离与鉴定
采用梯度稀释平板涂布法,从内蒙古自治区呼和浩特市的家庭自制酸奶样品中分离得到一特征菌落H2,反复划线纯化至无杂菌后甘油管保存。
参照伯杰氏细菌鉴定手册(第9版)[15]对H2进行生理生化鉴定,使用电子显微镜和冷场扫描电镜观察形态,参照闫颖娟等[16]的方法制备扫描电镜样品。将菌株H2送至广州基迪奥生物科技有限公司测序,用MEGA 5.2软件中的邻接法(Neighbor-joining)进行发育树的构建分析。
1.3.2 增殖培养基优化
根据前期实验结果,H2生长最适氮源为酵母提取物、最适生长因子为半胱氨酸、最适缓冲盐体系补充物为碳酸钙。分别测定不同浓度的酵母提取物、半胱氨酸、碳酸钙对嗜热链球菌H2生长的影响,确定各因素的最佳范围。根据单因素实验结果,以酵母提取物、半胱氨酸和碳酸钙为影响因素,以活菌数为响应值,设计三因素三水平的Box-Behnken试验,得到各组分的最佳浓度。
1.3.3 最佳静态培养条件测定
其他条件不变,分别测定不同初始培养pH、接种量以及培养温度对H2菌体密度的影响,确定最佳静态培养条件。
1.3.4 耐酸、胆盐和人工胃肠液能力测定
将活化后的H2按2%(体积分数)的比例接种于pH值为2.0、3.0、4.0、5.0、6.0的MRS培养基中,测定初始活菌数A0和37 ℃培养3 h后的活菌数A1。将H2分别接种于含有胆盐质量分数为0%、0.25%、0.50%、0.75%、1.00%的MRS培养基中,测定初始活菌数A0和37 ℃培养3 h后的活菌数A2。
参照Tarrah等[17]的方法配制人工胃液,接种H2,初始活菌数为A0。37 ℃、200 r/min培养1 h后测定活菌数A3。将上述人工胃液调节为人工肠液,继续培养2、4 h后测定活菌数A4、A5。存活率R的计算公式如下:
1.3.5 抗氧化能力测定
自由基清除能力是常用的抗氧化性能评价指标,如1,1-二苯基-2-三硝基苯肼(DPPH)、·OH、O2-的清除能力等[14]。研究表明,乳酸菌在发酵过程中的不同组分均可具有抗氧化活性[18],且发酵上清液的自由基清除能力远高于菌体和胞内提取物[19]。参考蒋雨鹤等[20]的方法制备H2发酵上清液和细胞破碎液,分别测定两组分的DPPH、·OH和O2-清除率。
1.3.6 产酸能力测定
将过夜培养的H2菌液于4 ℃、6 000 r/min离心15 min,收集上清液,经0.22 μm微膜过滤得到发酵上清液。使用高效液相色谱(HPLC)测定H2发酵上清液中酸的种类和含量。所用标准品为1.00、1.25、1.67、2.50、5.00、10.00 mmol/L的甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸标准溶液和6.68、8.35、11.14、16.71、33.41、66.83 mmol/L的乳酸(L-乳酸和D-乳酸)标准溶液。参考周全兴[21]的测定方法,得到各标准品的保留时间和峰面积。以标准品浓度为横坐标(mmol/L),有机酸峰面积(mAU·min)为纵坐标绘制标准曲线,得到回归方程。
1.4 数据处理
采用Deisgn Expert 8.0软件进行Box-Behnken试验设计及分析,SPSS 16.0软件进行数据分析,Origin 9.1软件进行绘图。
2 结果与讨论
2.1 菌株H2的鉴定与电镜分析
菌株H2为革兰氏阳性菌,菌体呈卵圆形,成对存在或形成长链,如图1所示。KOH试验阴性,过氧化氢酶试验阴性,明胶液化试验阴性,可利用葡萄糖、半乳糖、乳糖、蔗糖发酵产生有机酸。
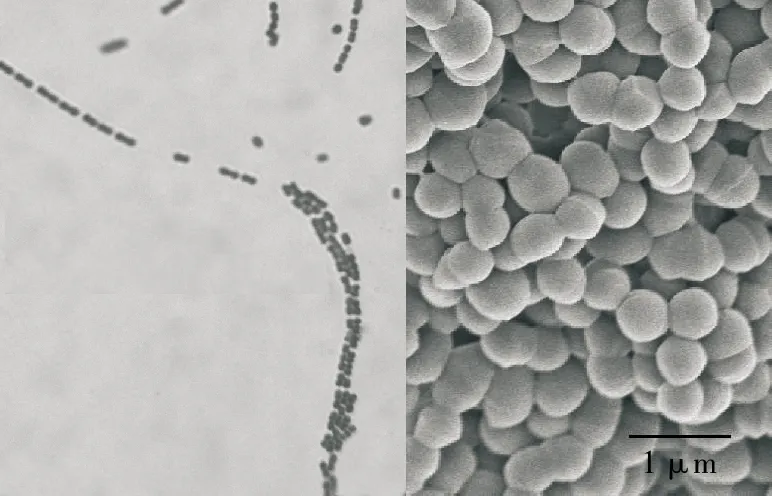
图1 H2的光学显微镜图(×1 600)和扫描电镜图(×50 000)Fig.1 Optical micrographs(×1 600)and scanning electron pictures (×50 000)of H2 microscope
将H2的16S rDNA序列在美国国家生物技术信息中心(NCBI)数据库进行Blast比对,结果显示其与StreptococcusthermophilusTSGB1184的相似度大于99%,构建的系统发育树如图2所示。综合其菌体形态、生理生化及系统发育结果,可将H2鉴定为嗜热链球菌。

图2 H2的进化树Fig.2 Phylogenetic tree of H2
2.2 菌株H2培养基配方的响应面法优化
酵母提取物不仅能提供微生物生长所需氮源,还含有多种维生素、核苷酸和微量元素等,可显著促进乳酸菌的生长[22]。李康宁等[23]的实验表明,酵母提取物和半胱氨酸均是影响嗜热链球菌活菌数的显著因子。碳酸钙是常用的发酵中和剂,可使菌体达到更高的密度[24]。由图3可知,促进H2生长的酵母提取物的最适质量浓度为45.0 g/L,半胱氨酸的最适质量浓度为169.5 mg/L,碳酸钙的最适质量浓度为0.7 g/L。图3中,D(600)表示H2菌液在600 nm波长处的吸光值,Y表示H2的活菌数。响应面试验设计的因素及水平如表1所示。
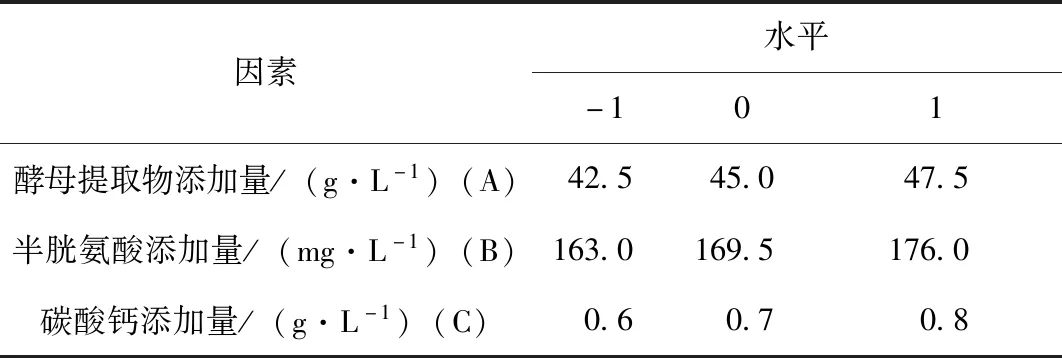
表1 Box-Behnken试验设计的因素和水平Table 1 Variables and their levels in Box-Behnken design

(a)酵母提取物添加量对H2菌体密度的影响
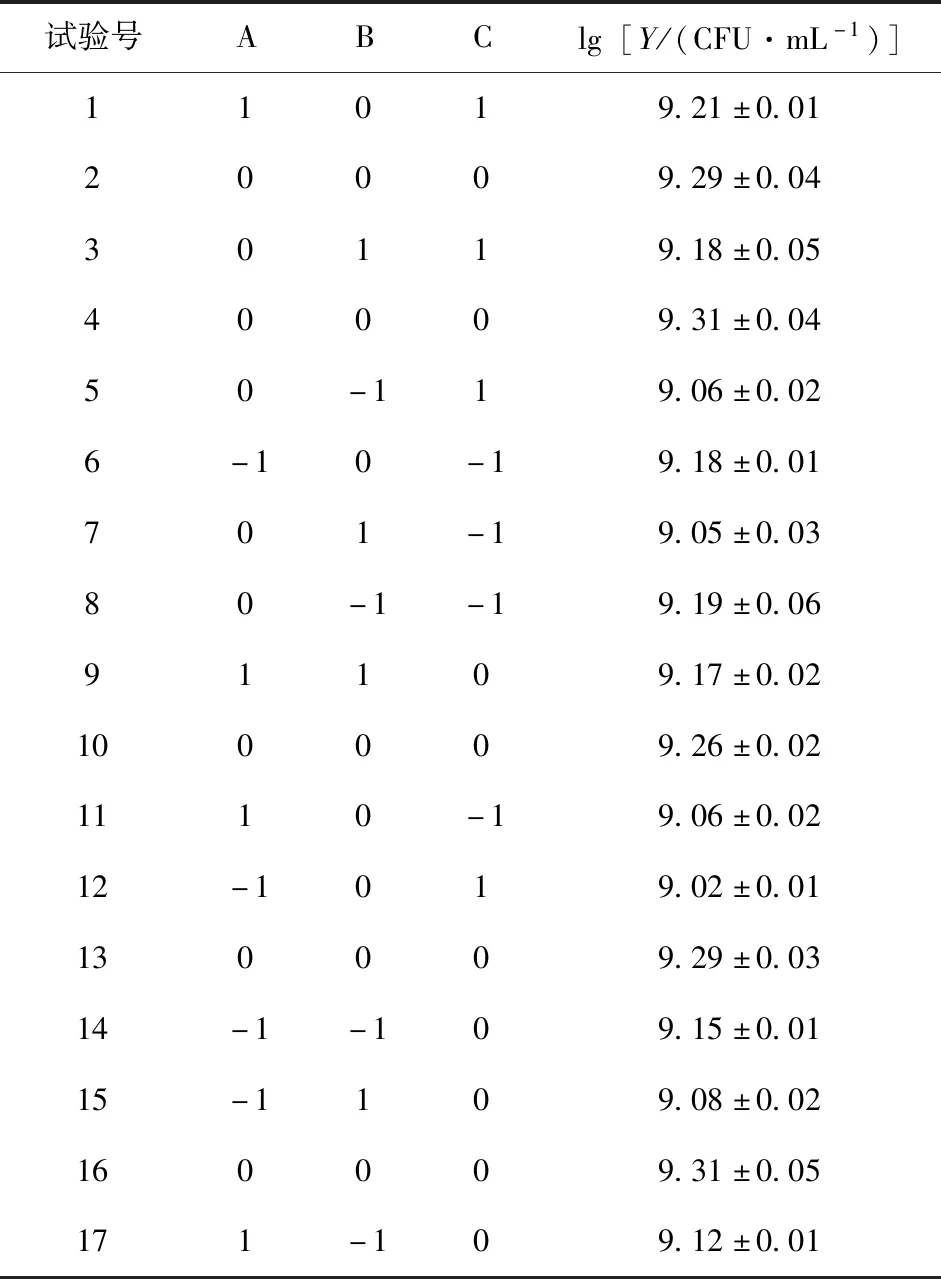
表2 Box-Behnken试验结果Table 2 Box-Behnken test results
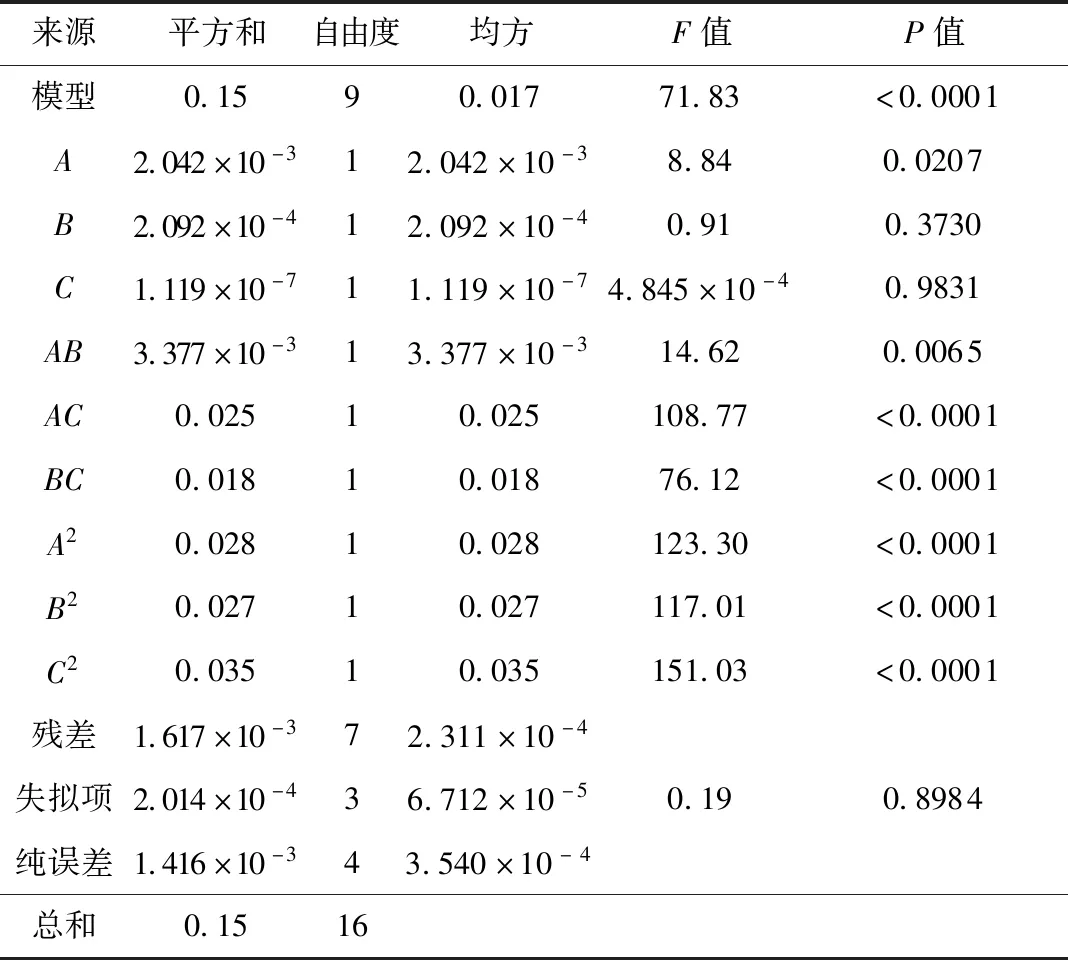
表3 响应面二次模型方差分析Table 3 ANOVA for response surface quadratic model
酵母提取物、半胱氨酸、碳酸钙的响应面和等高线如图4所示。随着酵母提取物与半胱氨酸含量的增加,H2活菌数先增加后降低,等高线呈椭圆形,两者的交互作用对活菌数的影响显著(P<0.05)。同理,酵母提取物与碳酸钙的交互作用、碳酸钙与半胱氨酸的交互作用也对H2活菌数有显著影响(P<0.05)。
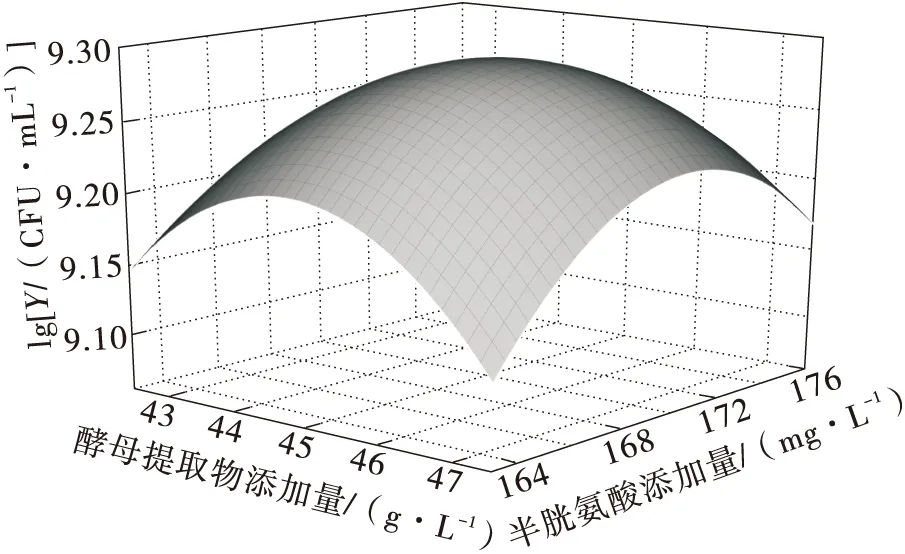
(a)酵母提取物与半胱氨酸的响应面图
模型得到最优培养基配方为酵母提取物添加量45.25 g/L、半胱氨酸添加量169.5 mg/L、碳酸钙添加量0.705 g/L,理论活菌数为1.96×109CFU/mL,实验验证活菌数为1.93×109CFU/mL,预测值与实际值接近,说明该预测参数可靠。
2.3 菌株H2的最适培养条件控制
图5(a)表明,随着初始pH的增加,H2的菌体密度呈现先增加后下降的趋势,其中初始pH值为5.5时菌体密度最大.由图5(b)可知,接种量增加可提高H2的菌体密度,但接种量为3.5%、4.0%和4.5%时菌体密度无显著差异(P>0.05),选择3.5%作为最佳接种量。图5(c)表明,温度为40℃时,H2菌体密度显著高于其他温度。该结果与陈琳等[25]报道的嗜热链球菌WHH 003的最佳培养条件(pH 5.5、温度45℃、接种量4%)相近,但H2的最适温度和接种量均低于WHH 003,可节省控温消耗的能量,节省种子量。
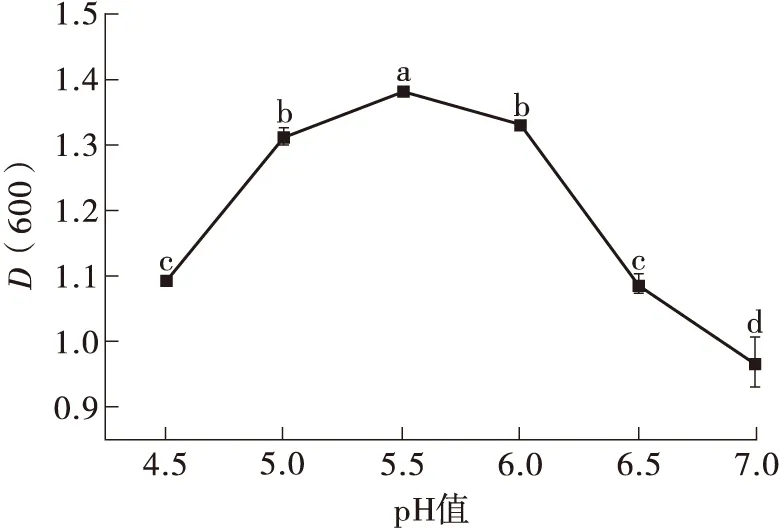
(a)不同初始培养pH对H2菌体密度的影响
综上,优化后的H2培养基为酵母提取物添加量45.25 g/L,半胱氨酸添加量169.5 mg/L,碳酸钙添加量0.705 g/L;最适培养温度40 ℃,初始pH值5.5,种子液添加量3.5%。培养条件优化后活菌数达4.20×109CFU/mL,是优化前的37.8倍。
2.4 菌株H2益生特性的体外评价
作为益生菌,耐受人体消化道环境是其发挥益生性能的前提[26-27]。大多嗜热链球菌对pH 3以下、胆盐质量分数0.5%以上敏感[28]。由表4可知,H2在pH值为5和6时存活率大于100%,从pH 4开始,随着pH值的降低菌株的存活率降低,在pH 3时,3 h后存活率为49.65%。随着胆盐质量分数的增大,H2的存活率减小,当胆盐质量分数为0.3%时,3 h后H2的存活率为99.62%。

表4 H2在不同pH值和胆盐质量分数下的存活率Table 4 Survival rate of H2 at different pH and bile salt concentration
实验结果表明:经人工胃液1 h后,H2的存活率为88.68%,降低值小于1个数量级,说明H2对人工胃液的耐受性良好;进入人工肠液2 h后的存活率为86.86%,4 h后的存活率为82.04%。Tarrah等[17]使用相似方法测定了多株嗜热链球菌对人工胃肠液的耐受性,H2的存活率与其最优菌株MTH17CL396、M17PTZA496、TH982等相近。
如表5所示,H2的发酵上清液和细胞破碎液对3种氧化自由基均有清除作用。其中H2上清液对DPPH的清除率最高,为94.06%,远高于王玥[29]报道的42株嗜热链球菌对DPPH自由基的清除平均值34.45%。
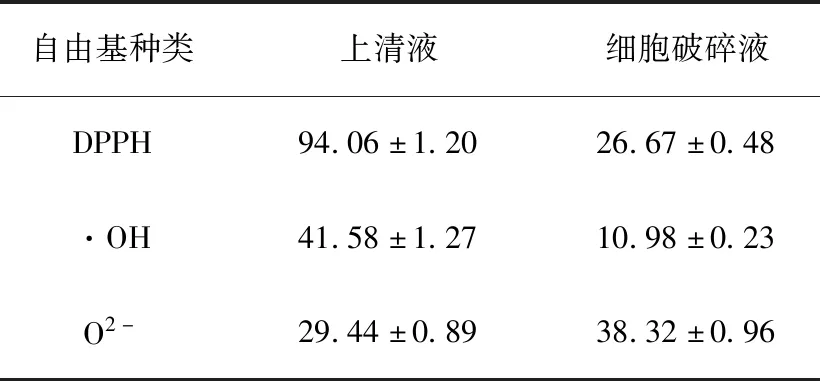
表5 H2对DPPH、·OH和O2-的清除率Table 5 Scavenging activities of H2 on DPPH,·OH and O2- %
L-乳酸可被人体代谢,促进人体的胃肠蠕动和蛋白、矿物质等的消化吸收[30],而D-乳酸则会在体内堆积,危害健康[31]。由图6和图7可知,在嗜热链球菌H2的发酵液中可检测到L-乳酸而无D-乳酸,说明H2所产乳酸安全。此外还可检测到甲酸、乙酸、丙酸、异丁酸、异戊酸。各标准品的标准曲线及H2发酵上清液中各酸含量如表6所示,其中L-乳酸浓度最大为12.64 mmol/L。表中,x代表峰面积,y表示浓度。
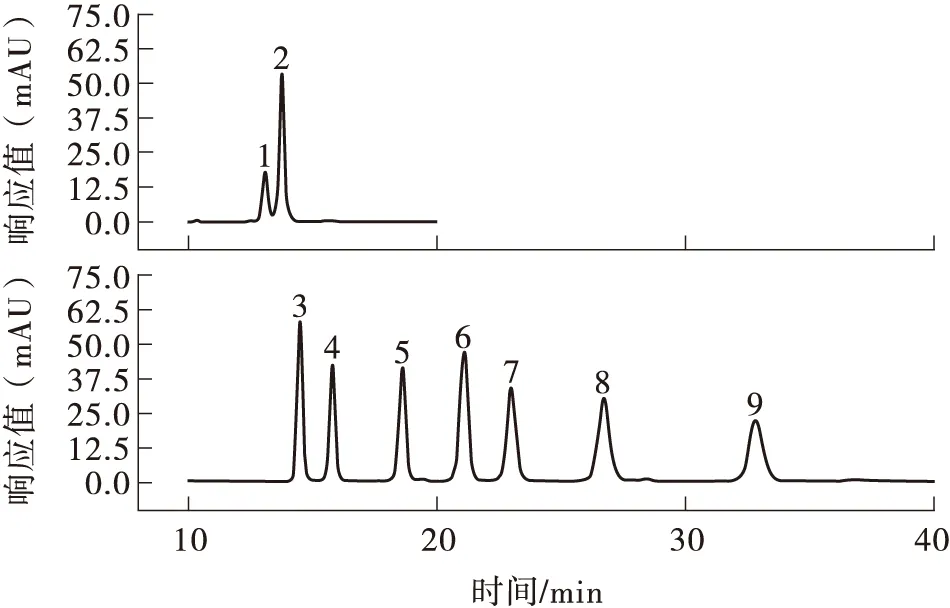
1-9分别为D-乳酸、L-乳酸、甲酸、乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸图6 标准样品色谱图Fig.6 Chromatogram of standard sample
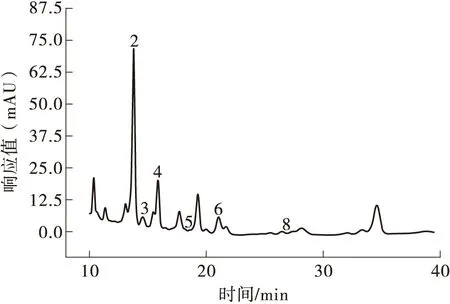
图7 H2发酵上清液的色谱图Fig.7 Chromatogram of H2 fermentation supernatant
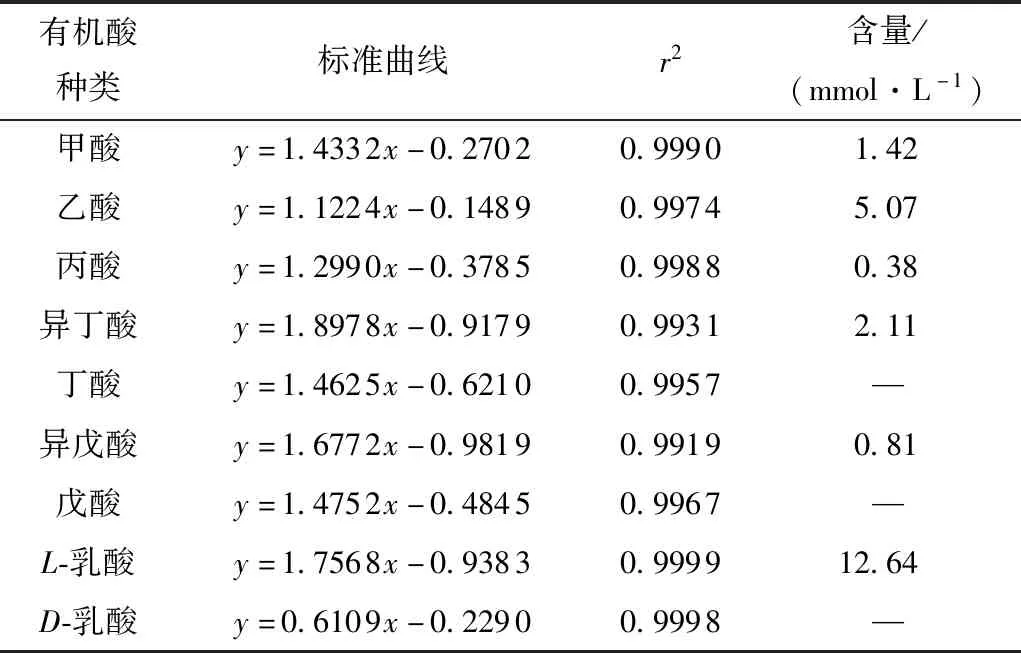
表6 各标准品的标准曲线及H2发酵上清液中各酸含量
3 结语
H2是源于内蒙传统发酵乳的一株嗜热链球菌,经培养基优化和培养条件控制后活菌数可达4.20×109CFU/mL;其可耐受酸、胆盐和人工胃肠液,符合益生菌耐受人体消化道环境的初步标准;其可产生L-乳酸及各种短链脂肪酸,且发酵上清具有抗氧化能力,具有一定的益生性能。本研究为其日后进行菌粉制备和功能性食品生产提供了基础。
