缓释TGF-β3的去细胞软骨微丝/温敏型水凝胶复合支架的制备
2020-11-03何林杰廖鑫潘逸男黄义星
何林杰,廖鑫,潘逸男,黄义星
(温州医科大学附属第二医院育英儿童医院 骨科,浙江 温州 325027)
近年来由于经济水平的提高及人口的老龄化,因运动损伤、交通意外及骨性关节炎等导致的软骨缺损发生率急剧上升,其导致的关节疼痛、功能障碍等症状严重影响着人们的生活质量[1]。但由于关节软骨本身无血供,且缺乏修复损伤的未分化细胞,加之软骨细胞的低代谢活性和高密度的细胞外基质的限制,使得其自身修复能力非常有限。目前的治疗方法主要包括关节清理术、微骨折术、自体或异体骨软骨移植、人工关节置换术等,这些治疗方法均存在明显的不足,如远期疗效不佳、高额的治疗费用、有限的供体来源及免疫排异等[2-3]。本研究拟制备一种可注射且能缓释TGF-β3的去细胞软骨微丝/温敏型水凝胶复合支架,并探讨其诱导骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)成软骨分化的情况,期望能为临床上治疗软骨缺损提供一种新的思路。
1 材料和方法
1.1 材料 由温州医科大学实验动物中心提供4周龄,体质量为160~200 g的雄性SPF级SD大鼠,实验动物许可证号:SYXK(浙)2015-0009。透明质酸(hyaluronic acid,HA)、聚乙烯亚胺(polyethyleneimine,PEI)、碳化二亚胺盐酸盐(carbodiimide hydrochloride,EDC)、羟基硫代琥珀酰亚胺(sNHS)购自上海阿拉丁公司;苯甲基磺酰氟(phenylmethyl sulfonyl fluoride,PMSF)、聚赖氨酸(polylysine,PLL)、TritonX-100购自美国Sigma公司;Tris-HCl、Dnase、RNase购自北京索莱宝公司;SD大鼠BMSCs成软骨诱导分化培养基试剂盒购自美国Cyagen Bioscience公司;TGF-β3购自美国Peprotech公司;Collagen II(Col II)抗体、Aggrecan(AGG)抗体、GAPDH抗体、DAPI购自美国Abcam公司;CCK-8试剂盒购自日本Dojindo公司;SOX9抗体购自美国Cell Signal Technology公司;BCA蛋白浓度试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 去细胞软骨微丝的制备:①无菌条件下获取兔新鲜肋软骨,置于含蛋白酶抑制物PMSF的 10 mmol/L Tris-HCl缓冲液中离心5 min,清洗3次,低温组织粉碎机粉碎软骨组织,采用差速离心法获取所需规格的软骨微丝;②将离心后的软骨微丝加入含1% Triton X-100的Tris-HCl缓冲液(pH 7.5内含PMSF),恒温震荡机上震荡8 h,去除细胞成分;4 ℃,7 000×g,离心5 min后,PBS液冲洗3次;③软骨微丝在含有1 U/mL的RNase酶及50 U/mL的 DNase酶溶液中消化12 h,37 ℃,轻微搅拌,离心后PBS液反复离心冲洗,将沉淀配成30 g/L的乳状悬液。将悬液均匀涂抹于载玻片上,显微镜下观察其微观结构;④将软骨微丝悬液-20 ℃冷冻过夜后,-80 ℃冻3 h,放入冷冻干燥机中冻干24 h,用DNA试剂盒提取DNA,使用酶标仪定量法检测DNA含量。
1.2.2 采用层层自组装技术制备缓释TGF-β3的去细胞软骨微丝:首先用聚乙烯亚胺 (polyethyleneimine,PEI)对去细胞软骨微丝进行修饰,使基底材料表面带上正电荷,随后以HA为聚阴离子,以PLL为聚阳离子,在带正电的基底上交替沉积,组装得到(HA/PLL)多层膜,完成多层膜PEI-(HA/PLL)15多层膜。向完成层层自组装的软骨微丝中加入EDC和sNHS的混合溶液即刻吹打混匀后,静置过夜,完成多层膜的交联。次日7 000×g离心 5 min弃上清液,用PBS清洗离心3遍。TGF-β3通过后扩散的方法装载入(HA/PLL)多层膜。
1.2.3 复合支架的制备及TGF-β3缓释实验:①4 ℃ 下将已组装TGF-β3的软骨微丝加入温敏型水凝胶(PDLLA-PEG-PDLLA,由四川大学生物治疗国家重点实验室提供),振荡混匀,制成缓释TGF-β3的去细胞软骨微丝/温敏型水凝胶复合支架,观察复合支架在4 ℃、25 ℃和37 ℃时的形态;②取0.5 mL复合支架材料于离心管内置于37 ℃成凝胶后,加入 37 ℃的1 mL PBS缓冲液进行体外缓释,每24 h更换1次PBS,每次换液将液体完全吸出,储存于-20 ℃,再加入预热好的37 ℃的PBS,使用TGF-β3 ELISA试剂盒检测,制作TGF-β3缓释曲线。
1.2.4 BMSCs的分离培养及与复合支架体外共培养:采用全骨髓贴壁法分离、培养股骨中的大鼠 BMSCs[4]。将大鼠安乐死,无菌环境下取下大鼠后肢,去除软组织和肌肉。将股骨和胫骨浸泡于PBS中转移至超净台,用含有10% FBS,1%青霉素和链霉素的DMEM培养基冲洗股骨和胫骨的骨髓腔。将细胞接种在25 cm2的培养瓶中,并在37 ℃且含5% CO2中培养箱中生长。24 h后更换培养基除去非贴壁细胞。将剩余的贴壁细胞集落培养14 d,直至达到80%汇合,并用0.25%胰蛋白酶消化3 min后传代。取3~5代细胞用于后续实验。复合支架组:将支架材料用紫外线灭菌后平铺于6孔板中孔中的一侧(只覆盖6孔板的1/3面积),置于37 ℃环境中凝固,将BMSCs以2×105个/孔的密度接种到含有复合支架的6孔板中,然后再加入SD大鼠BMSCs成软骨诱导分化完全培养基。对照组:直接将BMSCs以2×105个/孔 的密度接种到空白的6孔板中,同样加入等量的SD大鼠BMSCs成软骨诱导分化完全培养基。期间每3 d 更换1次培养基(所有培养基均为37 ℃预热),培养21~28 d,电镜下观察细胞生长情况。
1.2.5 Western blot法检测蛋白表达水平:使用蛋白质裂解液(radio immunoprepciption assay buffer,RIPA)和1%的蛋白酶抑制剂 (phenylmethanesulfonyl fluoride,PMSF)分别提取2组中的总蛋白质,再使用BCA蛋白质检测试剂盒测定相应的蛋白质浓度,并都配置成上样量为30 μg,总体积为20 μL。上样到SDS-PAGE凝胶上进行电泳,转膜,5% BSA封闭2 h,将对应的PVDF膜与Col II、AGG和SOX9的一抗稀释液置于4 ℃过夜。然后与相应二抗室温孵育2 h。加入ECL显影液,于化学发光仪上曝光分析。比较2组Col II、AGG和SOX9的表达水平。
1.2.6 CCK-8法检测细胞活性:复合支架组:先将消毒后的复合支架材料置于24孔板中的一角,于 37 ℃凝固,再将细胞以2×105个/孔接种于24孔板中,4 h后再加入500 μL/孔的完全培养基,使其没过支架。对照组:直接将细胞以2×105个/孔接种于空白的24孔板中,4 h后再加入500 μL/孔的完全培养基。2组都在37 ℃、5% CO2培养箱中培养1、2、3、4、5、6 d,在各个检测时间点,每孔用PBS洗3次,每次5 min,再加入490 μL DMEM、10 μL CCK-8工作液继续培育2 h,吸取100 μL加入96孔板后置于酶标仪测量450 nm处的吸光度值。并通过OD值计算公式计算复合支架组相对于对照组的细胞活性。
1.3 统计学处理方法 采用SSPS18.0统计软件进行统计学分析。计量资料用表示,两组间的比较使用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组软骨微丝组织学观察及DNA定量检测 软骨微丝去细胞前,显微镜下可见基质内有大量的细胞成分;去细胞处理后,显微镜下未见细胞成分,细胞成分基本已被去除,软骨微丝直径一般小于100 μm,见图1。去细胞前软骨微丝中DNA含量为(49.52±7.12)μg/mg,去细胞后软骨微丝中DNA含量为(5.36±0.56)μg/mg;去细胞后软骨微丝中DNA含量显著降低,差异有统计学意义(P<0.05)。
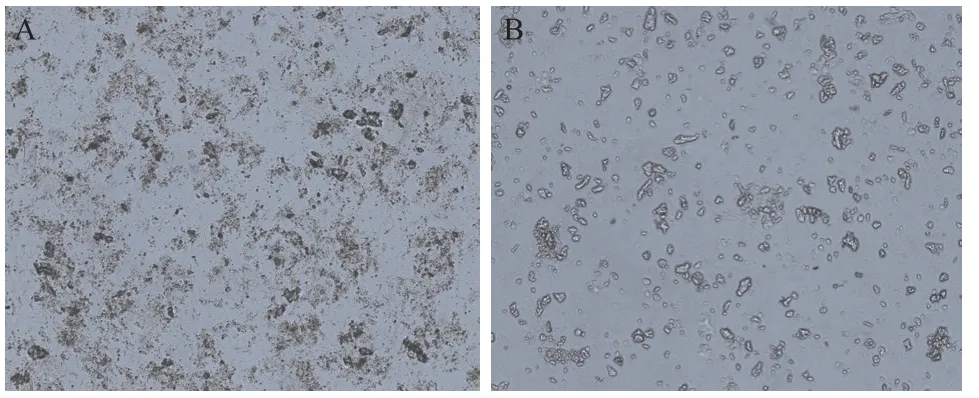
图1 2组软骨微丝形态学
2.2 复合支架的温敏特性及TGF-β3缓释情况 TGF-β3 的去细胞软骨微丝/温敏型水凝胶复合支架在 4 ℃低温状态下为溶胶状态,在25 ℃时仍为溶胶状态,当温度升高至37 ℃时变为凝胶状态,具有良好的温敏特性,见图2A。绘制TGF-β3缓释曲线图可见TGF-β3能缓慢释放,可有效释放25 d左右,见 图2B。
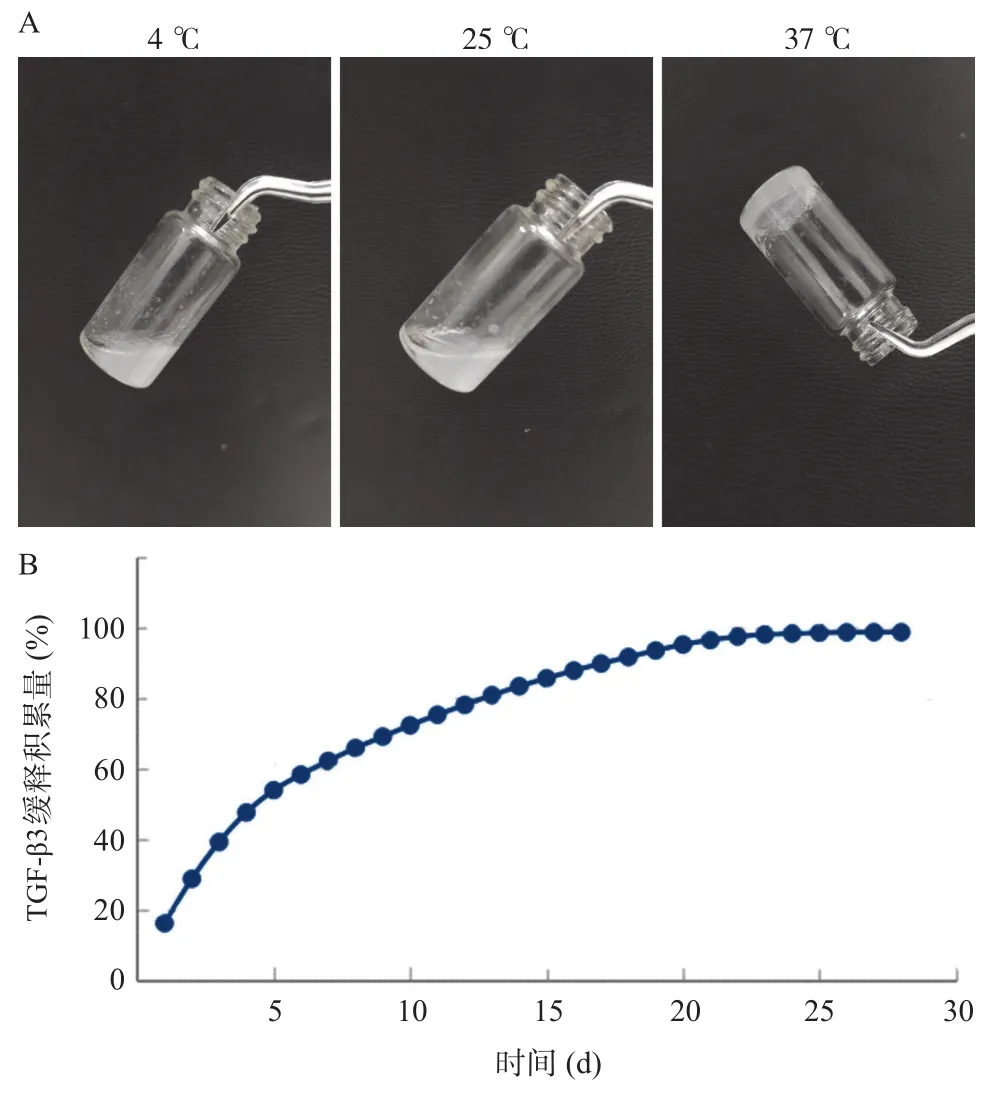
图2 复合支架的温敏特性及TGF-β3缓释情况
2.3 BMSCs的获取及其与复合支架共培养的情况 分离培养的SD大鼠BMSCs,在显微镜下可见为短梭形或多角形,细胞两端形成突起,见图3A;BMSCs与复合支架共培养后,显微镜下见细胞呈现类似软骨细胞的形态,细胞轮廓清晰,呈圆形或椭圆形,细胞核明亮清楚,见图3B。
2.4 2组Col II、AGG和SOX9表达比较 与对照组比,复合支架组的Col II、AGG和SOX9的表达均显著增 加,差异均有统计学意义(P<0.01),见表1。
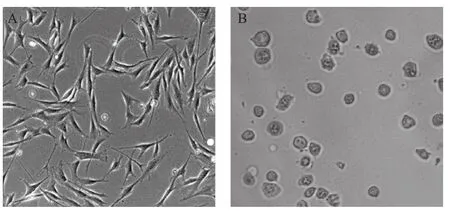
图3 BMSCs的获取及其与复合支架共培养的情况(×400)
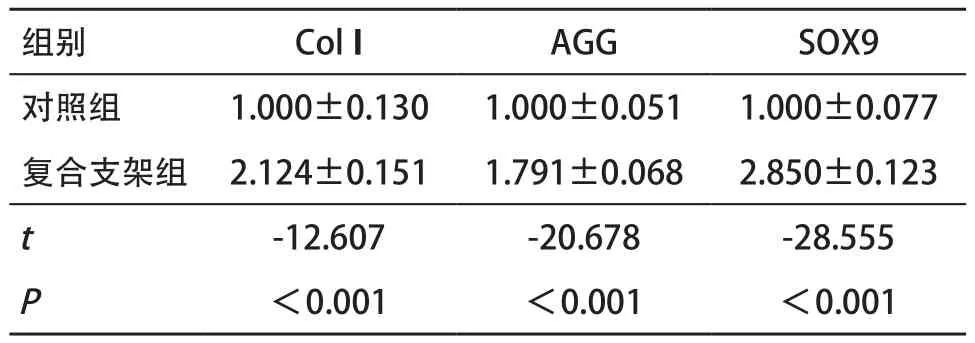
表1 2组Col II、AGG和SOX9蛋白相对表达量比较
2.5 2组不同时间细胞活性测定 测定对照组和复合支架组第1、第2、第3、第4、第5、第6天的OD值,通过OD值计算公式计算复合支架组和对照组的细胞活性差异无统计学意义(P>0.05),复合支架材料对BMSCs无细胞毒性,见图4。
图4 2组不同时间CCK-8法测定细胞的相对活性
3 讨论
由于关节软骨本身无血液供应,使得软骨损伤后的自身修复能力非常有限。目前的治疗方法主要包括关节清理术、微骨折术、自体或异体骨软骨移植、人工关节置换术等,这些治疗方法均存在明显的不足,如远期疗效不佳、高额的治疗费用、有限的供体来源及免疫排异等问题[2-3]。而组织工程技术作为一种可选择的替代修复方式,为临床上治疗软骨缺损开辟了一条新路径[5-6]。
利用组织工程方法进行软骨修复需具备3个核心条件:①足够数量、功能正常、具有软骨分化能力的种子细胞;②调节种子细胞增殖、分化,并维持其表型特征的细胞因子;③具有良好生物相容性、可无毒降解、合适空隙大小和孔隙率的三维支架。BMSCs来源充足,获取相对简便,具有强大的自我增殖及多向分化的能力,而且随着细胞的扩增,细胞的性状和分化特性并不会改变和丧失。在特定的成软骨诱导培养条件下,BMSCs能分化为软骨细胞,被认为是软骨组织工程最有发展潜力的种子细胞[7]。
此外,人们已发现多种细胞生长因子参与并调节关节软骨的修复过程,其中起主要诱导作用、研究最为深入的是TGF-β[8]。TGF-β有3个亚型,TGF-β1、TGF-β2和TGF-β3,它们均可诱导间充质干细胞分化成软骨细胞,并能促进软骨特异性基质的合成,从而促进软骨修复[9-10]。相关研究表明,TGF-β3可能更适合于软骨损伤的组织工程修复[11]。
支架材料大致可分为天然支架材料、人工合成支架材料及复合支架材料。目前已有多种软骨再生支架材料被应用于诱导软骨再生,但各种支架材料各有优缺点,目前尚无公认的理想支架材料。天然支架材料是生物机体的成分,生物相容性好,有利于细胞黏附、增殖和分化,与细胞外基质结构相似,理论上可以为种子细胞提供最佳的生存条件,但其存在力学性能较差、降解速度太快等缺点。去细胞基质材料是对天然的细胞外基质进行处理,剔除其中的抗原成分,具有良好的生物相容性、能为细胞提供接近体内的生存环境。人工合成支架材料的优点是具有较好的生物相容性,来源广泛、容易获得且可大批量生产,其空间结构、大体形态、机械强度、降解时间等都能预先设计和调控。其中以水凝胶为代表的人工合成支架材料是一类比较受关注的仿生支架材料。水凝胶是以水为分散介质的凝胶,能保持一定的形状,结构特征与细胞外基质相似。它具有以下优点[12-14]:①前体呈液态,可使细胞、药物等有形成分较均匀地分布于其中;②可使用注射的微创方式将材料植入任意不规则的缺损部位;③在胶凝化的过程中可渗入邻近组织,提高支架与周围组织的附着整合能力;④胶凝化后形成的三维结构有助于细胞-细胞、细胞-支架之间的相互作用。但合成材料表面没有天然材料所具有的特定的细胞识别信号,细胞的黏附性较差,不利于细胞的增殖分化和基质的合成。
本实验制备的缓释TGF-β3的去细胞软骨微丝/温敏型水凝胶复合支架,兼具天然支架材料和人工合成支架材料的优点,具有良好的生物相容性,能为细胞提供接近体内的生存环境,利于细胞的增殖分化和基质的合成;同时还具有温敏特性,在低温状态下为溶胶,当温度升高至体温附近时变为凝胶,因此可使用微创注射的方法达到软骨缺损部位,充填任意形状的缺损。此外,通过层层自组装技术将TGF-β3组装到去细胞软骨微丝上,使TGF-β3能长久缓慢释放,避免了生长因子半衰期短、容易降解等不利因素,充分发挥其生物学功能,较好地诱导BMSCs成软骨分化与增殖。国内外的一些研究发现温敏型水凝胶对药物和生长因子亦具有缓释作 用[15-16]。因此,本研究制备的能缓释TGF-β3的去细胞软骨微丝与温敏型水凝胶复合后的缓释作用可能更佳。将BMSCs与复合支架共培养后,软骨细胞的特异性表达指标Col II、AGG和SOX9较对照组显著增加,说明复合支架对BMSCs向软骨细胞分化有明显促进作用。
这种可注射且能缓释TGF-β3的去细胞软骨微丝/温敏型水凝胶复合支架,能有效缓释TGF-β3,为临床上治疗软骨缺损提供了一种新思路。
