DAXX在胃癌中的表达定位及其小泛素化修饰对胃癌恶性表型的影响
2020-11-03陈琛斌黄群佳谢旺凯徐剑峰沈贤薛向阳赵志光
陈琛斌,黄群佳,谢旺凯,徐剑峰,沈贤,薛向阳,赵志光
(1.温州医科大学附属第二医院育英儿童医院 胃肠外科,浙江 温州 325027;2.温州医科大学附属第二医院育英儿童医院 病理科,浙江 温州 325027;3.温州医科大学 微生物学与免疫学教研室 分子病 毒与免疫研究所,浙江 温州 325035)
胃癌是全球高发病率的五大恶性肿瘤之一,也是造成中国癌症相关死亡的第二大常见原因[1]。死亡结构域相关蛋白(death domain-associated protein,DAXX)最初被认为是促凋亡蛋白[2],可与Fas受体的死亡结构域特异性结合[3]。我们前期的研究[4]发现,DAXX表达量的增加与胃黏膜的恶性表型相关,且在胃癌中存在较高的核/浆比值 (nucleus/cytoplasm ratio,NCR)。有研究显示小泛素化修饰(small ubiquitin-like modification, SUMO)对DAXX的亚细胞定位及功能的调节具有重要意义[5]。但是,在胃癌中关于SUMO化修饰改变DAXX的核-浆定位,进而影响胃癌恶性表型的相关研究,仍未见明确报道。本研究旨在比较DAXX在胃癌组织中的表达和亚细胞定位,及其对胃癌细胞增殖和迁移能力的影响,并探讨SUMO影响DAXX的细胞核-浆定位的机制。
1 材料和方法
1.1 材料
1.1.1 细胞株和质粒:人胃癌细胞AGS、BGC-823、MGC-803、SGC-7901、MKN-45和永生化胃黏膜细胞系GES-1购自中国科学院细胞库/干细胞库。pcDNA3.1-DAXX-HA重组质粒由本实验室构建并长期保存于 -80 ℃冰箱,质粒大量抽提试剂盒购自美国Omega公司。
1.1.2 主要试剂:人脂质体LipofectamineTM2000和TRIzol试剂购自美国Invitrogen公司;FBS、DMEM培养基购于美国Gibco公司,Western blot及细胞裂解液试剂盒、ECL化学发光试剂盒以及PBS购自上海碧云天生物研究所,RealMaster Mix试剂盒、ReverTra Ace反转录试剂盒购自日本Toyobo公司,SYBR Green PCR Master Mix、反转录试剂盒购于大连Takara公司,细胞核-浆分离试剂盒购自美国赛默飞世尔科技公司。HA抗体、SUMO-2/3抗体、α-tubulin抗体和Lamin-A/C抗体购自美国Cell Signaling Technology公司;GAPDH抗体购自杭州贤至生物科技有限公司;FITC标记的羊抗兔抗体购自杭州联科生物技术股份有限公司。DAXX的PCR引物由深圳华大基因科技有限公司合成,FP:5’-TGACC CAGACTCCGCATAC-3’,RP:5’-CCGAAGCACATCCCCATA-3’。
1.2 方法
1.2.1 标本收集:回顾性收集2017年1月至6月温州医科大学附属第二医院育英儿童医院术后经病理确诊为胃癌的癌组织和癌旁组织(距离病灶>2 cm范围的组织),共20对。
1.2.2 生物信息学分析:分析DAXX基因在胃癌组织和癌旁正常组织中的转录水平,以及DAXX和SUMO-2/3的表达分别与胃癌患者预后的关系。同时,分析DAXX的表达情况与SUMO-2/3之间的相关性。
1.2.3 免疫组化:石蜡切片脱蜡和水化,修复抗 原,滴加封闭液。滴加DAXX一抗。滴加二抗孵育,PBS冲洗,DAB显色,苏木素复染,中性树胶封固。每个标本在高倍镜下随机选取3个视野,拍照、保存并采用Image-Pro Plus图像软件进行半定量分析,分别记录阳性细胞核与浆的积分光密度(IOD)值与面积值。
1.2.4 RT-qPCR:参照TRIzol试剂使用说明书,提取各胃癌细胞总RNA,使用DNA去除试剂盒去除DNA污染并进行反转录。按照RT-qPCR使用说明书检测mRNA含量。
1.2.5 重组质粒转染:将胃癌细胞接种于6孔板,待细胞生长至底面积的60%~70%时,将2 μg/孔的DAXX-HA质粒转染胃癌细胞,操作按LipofectamineTM2000产品说明书进行,同时分别设空载质粒3.1作为阴性对照组,分别称为DAXX组和空载质粒组。
1.2.6 Western blot实验:样品经SDS-PAGE胶分离后并转移至PVDF膜,37 ℃下5%脱脂牛奶封闭 0.5 h,分别加入一抗(兔抗HA标签抗体1:1 000、鼠抗DAXX 1:200、兔抗SUMO-2/3抗体1:1 000、鼠抗GAPDH 1:1 000)4 ℃孵育过夜。于37 ℃加入二抗 (羊抗兔1:5 000),室温孵育2 h;加入ECL显色液后显色并拍照。
1.2.7 CCK-8实验:以5 000个细胞/孔接种于96孔板(100 μL/孔)中培养,铺板12 h后转染,空白孔调零。在3个时间点(转染后24、48、72 h),按说明书要求加入CCK-8试剂,由酶标仪在450 nm波长下测定各孔吸光度值,比较各组细胞的增殖情况。
1.2.8 细胞划痕实验:将转染后的细胞接种到6孔板中并培养过夜。当细胞达到90%汇合时,每个孔用1 mL移液器枪头划线以形成2个线性区域,然后用培养基洗涤2次。随后将具有2% FBS的DMEM培养基用于细胞培养。分别在划线0、24和48 h后,在显微镜下拍摄板的摄影图像以检测伤口愈合并进行分析。
1.2.9 细胞免疫荧光:将转染后的胃癌细胞弃去原有培养液,PBS洗涤,加入4%多聚甲醛37 ℃孵育10 min,0.1% Triton X-100室温下处理15 min。5%山羊血清封闭1 h,鼠抗HA抗体(1:200),4 ℃孵育过夜。FITC标记的羊抗兔抗体孵育1.0 h,加入 1 μg/mL DAPI于37 ℃下染色5 min。加入抗荧光淬灭剂并于荧光显微镜下观察并拍照。
1.2.10 细胞核-浆蛋白分离:收集转染24 h后新鲜培养的细胞,冰PBS洗涤2次。根据试剂盒说明书,将细胞重悬于100~500 μL冰冷的细胞分级缓冲液中,孵育5~10 min,4 ℃和500×g下离心样品 5 min。上清液为细胞浆蛋白;使用细胞破碎缓冲液重悬沉淀,得到细胞核蛋白。

图1 DAXX在胃癌组织中的表达情况
1.3 统计学处理方法 采用SPSS19.0和Graphpad Prism 7.0软件进行统计学分析。计量资料以表示,2组间比较采用配对t检验,两变量之间的相关性使用Person相关系数;分类变量以例(%)表示,2组间使用χ2检验或Fisher精确检验。生存分析使用Kaplan-Meier方法,并采用对数秩检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 DAXX在胃癌及癌旁组织中的表达 对TCGA数据库中胃癌组织和癌旁组织分析显示,DAXX在胃癌组织中的转录水平升高,差异有统计学意义(P<0.01),见图1A。DAXX的表达高低对胃癌患者的生存预后无明显影响(P=0.52),见图1B。DAXX典型的免疫组化染色如图1C中所示,13个GC组织中DAXX表达评分为阳性(占总数的65.0%),10个相邻正常组织(占总数的50.0%)显示阳性表达。同时,在DAXX表达阳性的组织中,DAXX主要表达于细胞核内(见图1D),且胃癌组织的DAXX NCR值显著高于正常组织中的DAXX NCR值(P<0.01),见图1E。
2.2 DAXX在人胃癌细胞系的表达 通过qRT-PCR在5个胃癌细胞系和永生化胃黏膜细胞系GES-1细胞中检测了DAXX的mRNA表达水平(见图2)。与GES-1相比,在检测的5个GC细胞系中,BGC-823细胞中DAXX表达相对较高,而DAXX在SGC-7901和MKN-45细胞中表达相对偏低。基于这些结果,选择BGC-823细胞系用于进一步分析。
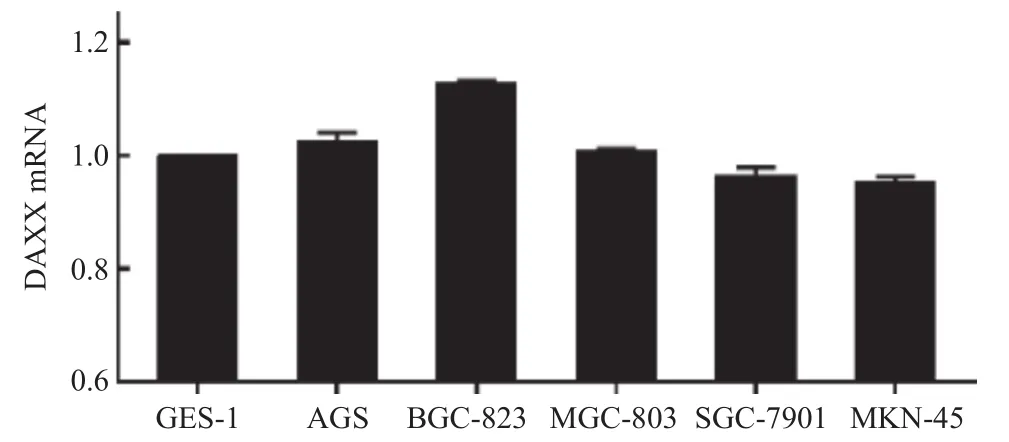
图2 qRT-PCR检测人胃癌细胞系中DAXX蛋白的mRNA表达
2.3 DAXX重组质粒转染胃癌细胞及蛋白表达的验证 以BGC-823细胞的cDNA为模板,含HA标签的DAXX全长基因正向引物及反向引物扩增DAXX基因,将PCR产物克隆至pcDNA3.1质粒中,经琼脂糖电泳验证,成功构建含有DAXX基因的重组质粒(见图3A)。将DAXX-HA重组质粒转染胃癌细胞24 h后,收集胃癌细胞的总蛋白,使用HA标签抗体进行Western blot验证,结果显示,重组质粒转染的胃癌细胞能够表达DAXX蛋白,不含目的基因的对照质粒未检测到DAXX蛋白表达(见图3B)。免疫荧光结果显示,DAXX蛋白可表达于胃癌细胞的胞浆和细胞核中,且主要集中于细胞核内(见图3C)。
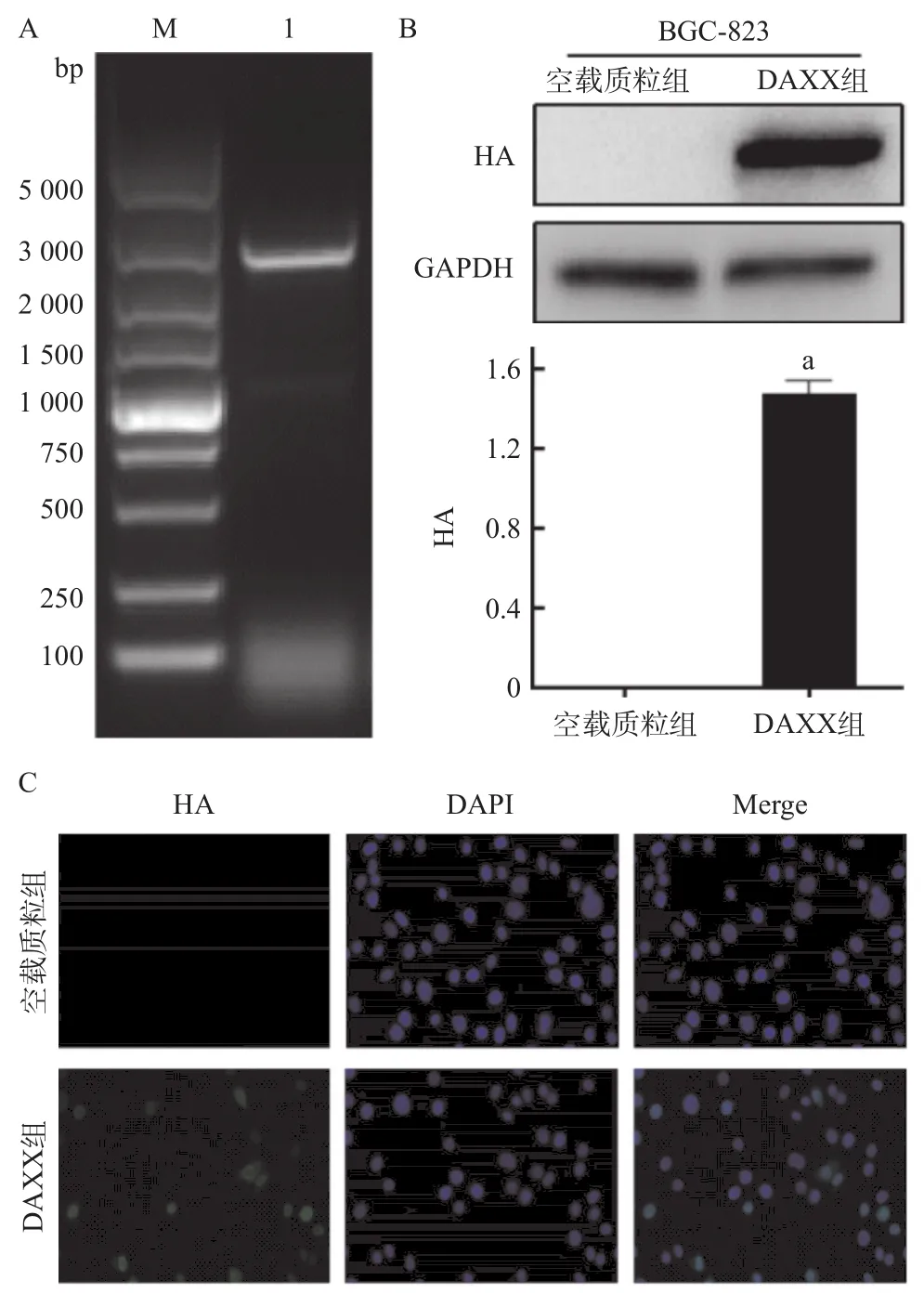
图3 DAXX重组质粒转染胃癌细胞及蛋白表达
2.4 DAXX过表达对BGC-823细胞功能的影响 Western blot结果显示,转染DAXX质粒24 h后,较空载质粒组相比,过表达后DAXX的含量增加1倍以上,差异有统计学意义(P=0.001),说明过表达成功(见图4A)。随后,转染后第24、第48、第72 h进行CCK-8实验检测细胞增殖能力,结果显示,DAXX组BGC-823细胞增殖能力较空载质粒组明显降低(P<0.05),提示过表达DAXX能抑制BGC-823细胞的增殖能力(见图4B)。细胞划痕实验显示,与空载质粒组相比,过表达DAXX后BGC-823细胞的迁移能力明显增强,差异有统计学意义(P<0.05),见图4C。
2.5 DAXX与SUMO2/3的相互作用 对于TCGA数据库内胃癌组织样本,通过GEPIA分析显示,DAXX转录水平与SUMO-2/3之间存在相关性(见图5A-B)。同时,收集转染后第24、第48、第72 h胃癌细胞的总蛋白,使用HA标签抗体和SUMO2/3抗体进行Western blot验证;结果显示,DAXX组表达DAXX蛋白,空载质粒组未检测到DAXX蛋白表达,且DAXX组的SUMO修饰程度较空载质粒组更多(见图5C)。之后根据核-浆分离结果显示,过表达DAXX后其浆蛋白明显升高,DAXX组的NCR明显低于空载质粒组(P<0.01),见图5D-E。
3 讨论
DAXX是一种除睾丸和胸腺外在人全身各器官均高表达的蛋白。本课题组前期研究[4]发现,DAXX的增多与胃黏膜的恶性表型相关,且高DAXX NCR的胃癌患者相对于低DAXX NCR的患者,其生存预后更差。本研究进一步通过免疫组化证实了DAXX在胃癌组织中高表达,DAXX NCR在胃癌组织中明显高于其配对的癌旁正常组织。
由于转录后加工,DAXX以3种同种型存在,分子量分别为70、97和120 kDa。结构和功能研究显示,DAXX是一种高度保守的蛋白,并通过与早幼粒细胞白血病蛋白、Fas等多种蛋白结合,在转录调控、细胞凋亡、细胞周期等方面发挥着重要作用[6-7],但关于DAXX的功能目前尚未阐明完全。DAXX与Fas受体之间的相互作用表明DAXX在细胞质中起作用,而其他报道表明DAXX主要位于细胞核[5,8]。有研究发现,DAXX既可以是促凋亡因子,也可以是抗细胞凋亡因子,主要取决于其在细胞中的亚定位变化[9]。DAXX最初被鉴定为细胞质分子,其通过凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)将Fas信号传导与JNK途径联系起来[3]。除了在细胞质中的作用外,DAXX还可作为核内的转录共抑制因子,抑制多种蛋白和转录因子的活性,包括ETS1、Pax3、糖皮质激素受体(GR)和p53[10]。在肿瘤细胞中,DAXX主要位于细胞核中,被认为是促癌因子。HORVILLEUR等[11]研究发现,具有高DAXX表达的弥漫性大B细胞淋巴瘤患者预后较差。据报道,DAXX通过激活ERK信号通路促进卵巢癌腹水细胞增殖和迁移[12],但在胃癌中尚未见关于DAXX的亚细胞定位与细胞生物学行为的相关性的报道。本研究通过qRT-PCR检测各胃癌细胞系中DAXX的mRNA表达水平,挑选其中表达量最高的BGC-823细胞进行后续实验。构建DAXX-HA的过表达质粒,转染BGC-823细胞后DAXX的过表达效果显著,并且通过免疫荧光显示其主要定位于细胞质中;使用CCK-8、细胞划痕实验等方法,证实了过表达DAXX能抑制胃癌细胞BGC-823的增殖能力和促进其迁移能力,这与之前的研究报道基本一致。

图5 DAXX可能通过与SUMO-2/3作用调节核-浆定位
DAXX的亚细胞定位决定了它的功能,而DAXX的亚细胞定位与小泛素相关修饰蛋白(Small ubiquitin-related modifier,SUMO)关系十分密切。SUMO是一种与泛素类似的多肽分子,由98个氨基酸组成,广泛存在于真核生物中,其存在4个同源异构体:SUMO-1、SUMO-2、SUMO-3和SUMO-4。其中,SUMO-2/3主要修饰应激状态下的蛋白[13]。SUMO调节多种细胞过程,包括信号转导、核转运、基因组不稳定性和转录[6,14]。据报道,DAXX通过SUMO介导的转录调控过程,进而影响细胞表型。本研究使用DAXX-HA转染BGC-823细胞,通过Western blot检测24、48和72 h的SUMO2/3表达水平。结果显示,在同一时间点,与空载质粒组相比,DAXX组的SUMO水平明显升高;而在3个时间点上,DAXX的SUMO水平逐渐降低。研究报道显示,SUMO2/3修饰可促进核浆转运。此外,过表达DAXX后NCR的降低,引起细胞增殖能力的下降,与之前研究中免疫组化的发现相一致[4]。因此,本研究认为,DAXX可能通过与SUMO2/3结合发生SUMO,促进DAXX从细胞核向胞浆转运过程,但其具体机制还有待进一步的研究。
综上所述,DAXX在胃癌组织高表达,而且DAXX在胃癌细胞的核中表达量较高。过表达DAXX可能通过SUMO促进细胞核-浆转运,进而抑制BGC-823肿瘤细胞的增殖和促进细胞迁移,提示DAXX在细胞核内的高表达可能是胃癌发生发展的潜在危险因素。胃癌细胞中导致DAXX的SUMO具体机制,将是我们未来研究的方向。
