c(RGDyk)环肽修饰的脂质体包载量子点荧光成像脑胶质瘤引导手术精准切除效果评价
2020-11-03吴钊航董伟杰薛鹏鹏左佳怡王丽芬袁健东徐荷林
吴钊航,董伟杰,薛鹏鹏,左佳怡,王丽芬,袁健东,徐荷林
(1.温州医科大学 药学院,浙江 温州 325035;2.温州医科大学附属第一医院 骨外科,浙江 温州 325015)
脑胶质瘤是神经系统中常见的疾病之一,易于转移并且难以治疗,表现出较高的复发率和病死率,对神经系统的功能具有很大的危害[1]。脑胶质瘤的治疗至今沿用传统的外科手术+药物治疗+经颅放疗综合治疗模式。但由于脑胶质瘤具有侵袭和转移的特点,手术时肿瘤边界难以精确定位导致手术切除不彻底,致使微小病灶残留[2]。术后微小病灶的残留是导致肿瘤复发、预后不良的重要原因。因此准确识别原发性神经胶质瘤边界和转移性肿瘤细胞不仅是完全切除的主要因素,还是预防神经胶质瘤复发的关键因素[3]。
术中MRI成像、近红外荧光成像以及多种方式相结合的多模态成像可使原发性肿瘤病灶可视化,精准定位转移性微小肿瘤结节,引导肿瘤精准切 除[4-5]。无论是发光肿瘤模型还是手术前造影剂标记肿瘤模型,均证明成像引导的手术切除相比自然光下的标准手术在提高肿瘤切除完全率,降低肿瘤复发率以及提高患者术后存活率等方面具有明显的优势,近年来受到广泛关注。DOGLIETTO等[6]结合荧光物质5-氨基乙酰丙酸(5-ALA)和高清晰度的三维立体镜,用于神经胶质瘤手术切除。尽管许多研究已经使用诸如5-ALA和荧光素钠之类的荧光物质来指导神经胶质瘤的切除,但是仍然存在一些问题如荧光稳定性差和荧光效率低等[7]。
量子点(quantum dots,QDs)具有良好的荧光信号和稳定性,较宽的激发光谱和较窄的发射光谱,并已应用于标记特异性细胞和组织以实现多色生物成像[8-10]。但QDs由于其理化特性容易受到环境影响从而导致细胞毒性,这使得其应用受到限制[11]。研究发现将QDs与脂质体相结合,不仅改善了QDs的稳定性,使其能保持荧光,还大大降低了其生物毒性[12],而且还可以对载体进行修饰,使其能够靶向作用在肿瘤区域,提高其成像精确度。神经胶质瘤细胞表达αvβ3整合素,可以与含有精氨酸-甘氨酸-天冬氨酸(RGD)序列短肽特异性结合[13]。相比之 下,RGDyk环肽对αvβ3整合素具有更强的亲和力和更高的特异性,已被众多研究用作靶向配基来修饰纳米药物载体[14-15]。本研究拟以靶向脑胶质瘤的RGDyk环肽修饰脂质体包载QDs,用于脑胶质瘤的精准成像,实现术中荧光成像引导的肿瘤精准切除。
1 材料和方法
1.1 材料与试剂 氢化大豆磷脂(HSPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基(DSPE-PEG-NH2)、胆固醇购自上海艾维特公司;c(RGDyk)环肽购自上海吉尔生化多肽公司;ZnCdSe/ZnS量子点购自武汉伽源量子点公司;N-羟基琥珀酰亚胺(NHS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)购自上海阿拉丁公司;2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐(CCK-8)购自日本株式会社同仁化学研究所;PC12和C6细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;DMEM培养基、RPMI1640培养液、胰酶、胎牛血清购自美国GIBCO公司。
1.2 方法
1.2.1 c(RGDyk)环肽修饰的QDs脂质体制备:称取85 mg HSPC,5 mg DSPE-PEG-NH2和10 mg胆固醇至25 mL圆底烧瓶中,加入10 mL乙醚,600 r/min 搅拌使溶解后,至旋转蒸发仪40 ℃蒸除乙醚,形成均匀的脂质膜后,将一定量的QDs添加到适量磷酸盐缓冲液(PBS pH 7.4)加入上述脂质膜中,旋转洗膜,用超声波发生器在300 W超声30 min后,即可得到多室脂质体混悬液,分别依次过400 nm和100 nm碳酸酯膜挤出整粒,得到平均粒径100 nm以下的小单室脂质体。c(RGDyk)环肽溶液在室温下经EDC/NHS活化后,加入至上述单室脂质体混悬液中,轻轻搅拌反应4 h,超滤除去缩合剂以及未反应的c(RGDyk)环肽,即可得到c(RGDyk)环肽修饰的量子点脂质体[QDs-c(RGDyk)-Lip]。
1.2.2 粒径以及形态:动态光散射激光粒度测定仪(LitesizerTM 500,奥地利安东帕公司)对游离的QDs以及c(RGDyk)环肽修饰的量子点脂质体进行粒径和Zeta电位的测定。样品经过适当稀释后,于常温条件下固定激光波长为632.8 nm,散射角为90°测定其粒径以及Zeta电位。透射电镜(transmission electron microscope,TEM)检测游离的QDs以及c(RGDyk)环肽修饰的量子点脂质体形态。取样品滴于铺有碳膜的铜网上,以无纤维滤纸从铜网边缘吸掉多余液体,滴入2%磷钨酸染色,自然晾干2 d,以200 kV加速电压,TEM(JEM1200EX,日本JEOL公司)检视并拍照。
1.2.3 荧光光谱:荧光分光光度计(RF-6000,日本Shimadzu公司)对游离的QDs以及c(RGDyk)环肽修饰的QDs脂质体进行荧光发射光谱分析。激发波长设置为450 nm,在500~800 nm发射波长范围内进行扫描,扫描间隔为1.0 nm,扫描速度为2 000 nm/min。 QDs-c(RGDyk)-Lip与含有10% FBS的pH 7.4 PBS在37 ℃孵育不同时间后,固定激发波长为450 nm,检测发射波长610 nm处的荧光强度变化,检测其在生理相关介质中的荧光稳定性。
1.2.4 细胞毒性:体外CCK-8法评估QDs-c(RGDyk)-Lip对正常PC12神经细胞以及C6肿瘤细胞的毒性。C6细胞在含有10%胎牛血清、青霉素(100 U/mL)、 链霉素(100 μg/mL)以及谷氨酰胺(2 mmol/L)的RPMI 1640培养基中进行培养;PC12细胞则利用DMEM高葡萄糖培养液培养;细胞放入37 ℃、5% CO2、饱和湿度的培养箱培养,待细胞生长至对数生长期时进行实验操作。将PC12细胞或C6细胞接种到装有100 μL培养基的96孔板(每孔3×103)中培养过夜。然后,加入含有QDs-c(RGDyk)-Lip的培养基,进一步培养24 h或48 h,PBS洗涤2次,加入10 μL CCK-8,置培养箱内继续孵育2 h,酶标仪在450 nm波长处测量吸光度。按照如下公式计算细胞的存活率(%)。细胞存活率(%)=[(A加药-A空白)÷(A0加药- A空白)]×100%。A加药:具有细胞、CCK-8溶液和药物溶液的孔的吸光度;A空白:具有培养基和CCK-8溶液而没有细胞的孔的吸光度;A0加药:具有细胞、CCK-8溶液而没有药物溶液的孔的吸光度。
1.2.5 肿瘤细胞靶向性:C6细胞以每孔1×106个细胞的密度接种在6孔板的盖玻片上,培养箱内孵育过夜。加入含有游离QDs(30 nmol/L)或 QDs-c(RGDyk)-Lip(相对应QDs浓度为30 nmol/L)的培养基,孵育2 h,冷PBS冲洗,DAPI(1 mg/mL)染色,荧光显微镜(尼康,日本)观察。为了证明QDs-c(RGDyk)-Lip的c(RGDyk)靶向性,贴壁C6细胞预先用游离的c(RGDyk)孵育2 h,后加入含有QDsc(RGDyk)-Lip(相对应QDs浓度为30 nmol/L)的培养基孵育2 h,观察细胞荧光强度变化。
1.2.6 体内靶向性:按照文献方法[16]建立C6脑胶质瘤大鼠模型。荷瘤大鼠6只分为2组,每组3只,分别尾静脉注射游离QDs溶液(50 nmol/L)和QDsc(RGDyk)-Lip(相当于QDs浓度为50 nmol/L)。2 h 后,将荷瘤大鼠处死,0.9%氯化钠溶液心脏灌流后,分离出荷瘤大脑,放置在活体成像仪内进行离体荧光成像。同时,荷瘤大脑进行冰冻切片,DAPI染色 后,置荧光显微镜下观察组织荧光分布。
1.2.7 荧光引导脑胶质瘤精准切除:荷瘤大鼠6只分为2组,每组3只,分为荧光引导手术组和白光手术组。荧光引导手术组静脉注射QDs-c(RGDyk)-Lip(相当于QDs浓度为50 nmol/L)2 h后,麻醉大鼠,乙醇皮肤消毒,在肿瘤上方行一个约1.5 cm的切口,在暗室激光照射脑组织造成荧光手术环境,在显微镜下用显微镜的镊子和剪刀手术切除。白光手术组荷瘤大鼠直接在白光下开颅,实行肿瘤切除。为了评估手术边缘是否存在残留的神经胶质瘤病变组织,从手术边缘提取厚度为3 mm的活检样本,并用4%多聚甲醛固定以进行HE染色。
2 结果
2.1 c(RGDyk)环肽修饰的QDs脂质体的制备与表征 ZnCdSe/ZnS的QDs具有较高的毒性,本实验以氢化大豆磷脂,二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基和胆固醇为材料,采用逆向蒸发法制备包载QDs的脂质体。后经EDC/NHS介导的缩合反应,将RGDyk环肽与QDs-Lip表面氨基键合,制备c(RGDyk)环肽修饰的量子点脂质体(QDs-c(RGDyk)-Lip)。动态光散射(dynamic light scatting,DLS)以及TEM技术对QDs-(RGDyk)-Lip进行了粒径与形态表征,结果如图1所示。DLS结果显示,游离QDs的粒径约为35 nm,而QDs-(RGDyk)-Lip粒径增大为175 nm,且分布较为集中(PDI=0.12)。TEM结果显示,游离QDs呈稀疏的点状分布,其大小同DLS结果相近;而QDs-(RGDyk)-Lip则呈囊泡状,且其中心可见数个微小QDs聚集,表明QDs有效包裹在脂质体内。

图1 游离量子点(A、C)和QDs-(RGDyk)-Lip(B、D)粒径分布与TEM形态
2.2 c(RGDyk)环肽修饰的QDs脂质体的稳定性 RGDyk环肽修饰的QDs脂质体在白光下,呈浅粉红色浑浊液,而在405 nm紫外光照射下,则发射出强的紫红色荧光,见图2A。对其发射荧光进行光谱扫描(见图2B),游离QDs和QDs-(RGDyk)-Lip均显示出在610 nm处的最大发射波长,而且由于包裹后聚集诱导荧光发射效应,QDs-(RGDyk)-Lip荧光强度较游离QDs略增强。这些特性表明QDs包载在脂质体后,其荧光发射特性不受损害。为了考察QDs-(RGDyk)-Lip在生理相关介质中的稳定性,QDs-(RGDyk)-Lip与含有10% FBS的pH 7.4 PBS于37 ℃孵育不同时间后,检测其在610 nm处荧光强度以及粒径变化(见图2C-D),游离QDs在孵育过程中,其荧光强度逐渐降低,48 h孵育后降低20%,而QDs-(RGDyk)-Lip则在整个检测时间内荧光强度没有发生明显改变,48 h 孵育后,荧光强度仅仅5%降低,这表明脂质体包裹能提高量子点荧光稳定性,同时,QDs-(RGDyk)-Lip整个孵育过程中未见明显的粒径及粒径分布指数(particle distribution index,PDI)改变,进一步说明QDs-(RGDyk)-Lip在生理相关介质中的稳定性。
2.3 细胞毒性实验 QDs-c(RGDyk)-Lip对正常PC12细胞以及C6肿瘤细胞株均展现出剂量依赖性的微弱细胞毒性,而且C6胶质瘤细胞相比PC12细胞具有更高的敏感性,见图3。孵育24 h后,QDs-c(RGDyk)-Lip在5~60 μg/mL浓度范围内对PC12几乎无细胞毒性,在浓度80~100 μg/mL展现出略微微弱的毒性。而QDs-c(RGDyk)-Lip对C6细胞,在浓度为40 μg/mL 时能观察到对细胞的损伤,当浓度为100 μg/mL时,细胞的存活率约为82%。孵育48 h后,QDs-c(RGDyk)-Lip对2种细胞株展现出相似的趋势,但与24 h结果相比,没有显著增大。相比PC12细胞,QDs-c(RGDyk)-Lip对C6胶质瘤细胞具有更高的细胞毒性可能是因为C6细胞表面更高的αvβ3整合素受体表达,促进更多的QDs摄取进入细胞。
2.4 c(RGDyk)环肽修饰的QDs脂质体体对胶质瘤细胞的靶向性成像 C6细胞与QDs或QDs-(RGDyk)-Lip孵育2 h后,激光共聚焦显微镜对细胞进行显像,见图4。游离QDs处理细胞仅在细胞外缘显示出微弱的红色荧光,而QDs-c(RGDyk)-Lip处理的细胞周围显示出强的红色荧光,而且能清晰显示其细胞质骨架,表明QDs-c(RGDyk)-Lip对C6细胞特异靶向性。C6细胞表面整合素受体预先用游离c(RGDyk)饱和后,评价其对QDs-c(RGDyk)-Lip摄取变化,结果显示,与QDs-c(RGDyk)-Lip相比,游离c(RGDyk)+QDs-(RGDyk)-Lip处理组细胞荧光明显降低,仅在细胞外缘表面显示微弱红色荧光,表明QDs-(RGDyk)-Lip的靶向性与C6胶质瘤细胞膜表面的整合素有关。

图2 c(RGDyk)环肽修饰的量子点脂质体的稳定性

图3 QDs-(RGDyk)-Lip对C6和PC12的细胞毒性
2.5 c(RGDyk)环肽修饰的QDs脂质体体内肿瘤靶向性 离体荧光成像结果显示,游离QDs组大鼠的脑组织观察到微弱的红色背景信号,但肿瘤组织区域(黄色虚线标注)荧光信号并未强于背景荧光,表明游离的QDs无法向胶质瘤组织聚集。相比之下,QDsc(RGDyk)-Lip组大鼠脑组织肿瘤区域则显示出强的荧光信号,明显高于周边正常组织产生的背景荧光,表明QDs-c(RGDyk)-Lip静脉注射后特异分布在脑胶质瘤组织,展现出体内特异肿瘤靶向性。离体荷瘤大脑进一步进行冰冻切片,激光共聚焦观察发现,游离QDs组脑组织无论在肿瘤区域(T)还是脑实质区域(P)均无QDs有关的红色荧光信号,与离体成像结果一致。相比之下,QDs-(RGDyk)-Lip组大脑组织仅仅在肿瘤区域(T)内展示出强的QDs有关的红色荧光,在脑实质区域(P)未见有荧光,表明QDs-(RGDyk)-Lip能精确定位在胶质瘤区域。见图5。
2.6 荧光成像引导脑胶质瘤大鼠肿瘤精准切除 术中肿瘤区域显像如图6所示,在手术切除前的明视野图像中,荧光引导手术组和白光手术组均可观察到明显的神经胶质瘤区,但在白光下只能观察到模糊的肿瘤区域,而在荧光下可以观察到肿瘤与脑实质间清晰的边界。白光手术组的神经胶质瘤大鼠肿瘤实行经验式切除,荧光引导手术组的神经胶质瘤大鼠进行荧光引导肿瘤切除,直到在肿瘤区未观察到荧光信号为止。手术切除后,取切口边缘 3 mm厚的组织进行切片,HE染色,评价手术切除的效果。结果显示,白光手术组切除的活检样本在正常的脑实质(P)边缘观察到了残留的神经胶质瘤(T),能观察到明显的残留肿瘤组织,而荧光引导手术组的活检样本在切口边缘(黄色虚线所示)未见有残留的肿瘤组织,表明QDs-c(RGDyk)-Lip对脑胶质瘤荧光成像能引导术中肿瘤精准切除。
3 结论
由于颅内肿瘤的过度生长及其边界模糊,手术难以完全切除是导致脑胶质瘤复发的重要原因。准确定位肿瘤边界实行精准切除是目前脑胶质瘤手术治疗成功与否的关键。有许多成像技术可以帮助最大程度地切除肿瘤。如手术前经颅磁刺激和弥散张量成像检查,以及手术中的超声导航和直接皮层刺激导航等都能定位肿瘤边界,引导手术切除[17]。但由于这些技术的成本高、可操作性差以及检测灵敏性低等局限,尚未在临床上广泛使用。荧光成像引导的手术切除在提高肿瘤切除完全率,降低肿瘤复发以及提高患者术后存活率等方面具有明显的优势,近年来受到临床外科医师广泛关注[18]。本研究构建了c(RGDyk)环肽修饰的脂质体包载QDs,并对其粒径、形态以及荧光发射性质进行了表征,评价了其体内外对脑胶质瘤的成像可行性以及术中荧光成像引导肿瘤切除的精准性。结果表明,QDsc(RGDyk)-Lip粒径大小为175 nm,在生理相关介质中具有良好的粒径与荧光稳定性;QDs-(RGDyk)-Lip体外不但对PC12脑神经细胞具有低毒性,而且可以有效地靶向C6肿瘤使其荧光显像。动物实验表明QDs-c(RGDyk)-Lip静脉注射后能高效地靶向原位荷瘤大鼠脑胶质瘤,使其发射强荧光引导手术精准切除。
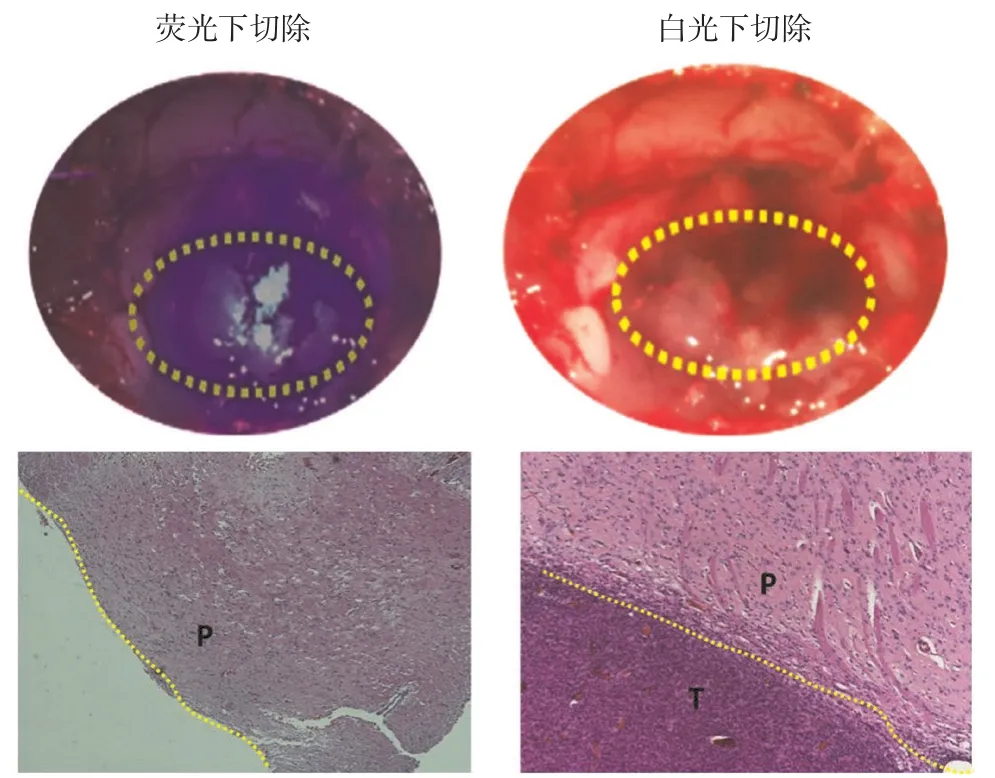
图6 荷瘤大鼠静脉注射QDs-(RGDyk)-Lip后实行荧光成像手术及术后切口边缘HE染色(×200)
