母乳寡糖的研究进展
2020-11-02揭良苏米亚贾宏信陈文亮齐晓彦
揭良,苏米亚,贾宏信,陈文亮,齐晓彦
光明乳业股份有限公司光明乳业研究院,乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心(上海 200436)
母乳被认为是婴儿营养的“黄金标准”,是婴儿唯一的天然食物来源。母乳中特殊的成分适合消化系统和免疫系统都不成熟的婴儿。它能保护婴儿免受感染和炎症,促进其免疫功能的发展和器官的成熟[1]。部分原因是由于母乳中大量寡糖的存在。母乳寡糖(HMOs)占到母乳中碳水化合物的20%,是母乳中第三大固体成分[2]。婴儿的肠道不能消化HMOs,却能够为新生儿提供多重保护作用,如帮助调节肠道微生物群,促进肠道发育,预防致病性感染及刺激免疫系统成熟。HMOs是母乳喂养优越性的重要法宝。对于不能母乳喂养的婴儿,婴幼儿配方奶粉则成为婴幼儿食物营养的重要来源。对于配方奶粉HMOs的母乳化,始终是母乳深入研究的热点课题。特别是近几年随着国外首次实现HMOs的商品化应用,使得HMOs研究成为母乳研究的一大热点。因此对母乳寡糖的背景知识进行介绍,分析现阶段对于HMOs含量和影响因素及功能研究。
1 母乳寡糖的特点
HMOs结构复杂、种类较多,研究证明母乳中存在200多种寡糖,但研究报道较多的是20多种常见HMOs。 HMOs有5种基本单糖单体:D-葡萄糖(Glc)、D-半乳糖(Ga1)、N-乙酰葡萄糖胺(Glc NAc)、L-岩藻糖(Fuc)和唾液酸(Sia)。其聚合方式为在乳糖的基础上以β-1, 3或β-1, 6键连接半乳糖β-1, 3-N-乙酰氨基葡萄糖双糖(双糖称为Lacto-N-biose),形成HMOs的核心结构,在乳糖或者核心结构基础上可以再延伸进行岩藻糖化或者唾液酸化(图1)。因此HMOs的类型主要分为3类:中性岩藻糖基化、中性非岩藻糖基化和酸性唾液酸化糖,分布依次为35%~50%,42%~55%和12%~14%,在成熟乳母乳中,HMOs含量在5~15 g/L之间[3]。
2 HMOs的组成及其影响因素
HMOs在不同个体中的分布存在很大差异。因此不同文献报道的HMOs数量和含量差异较大。如魏远安等[4]报道来自中国的22位母亲中母乳的HMOs,分析22种HMOs的总含量在2.6~12.5 g/L之间。Samuel等[5]研究了欧州7个国家的母亲的母乳中的20种HMOs,其总含量在6.7~13.1 g/L之间。表1是文献报道的常见HMOs含量[6-8]。这些变化除了分析方法外,可能归因于乳母的孕龄、遗传、乳母的分泌状态和哺乳期的影响。

图1 母乳寡糖的组成单元及聚合规律
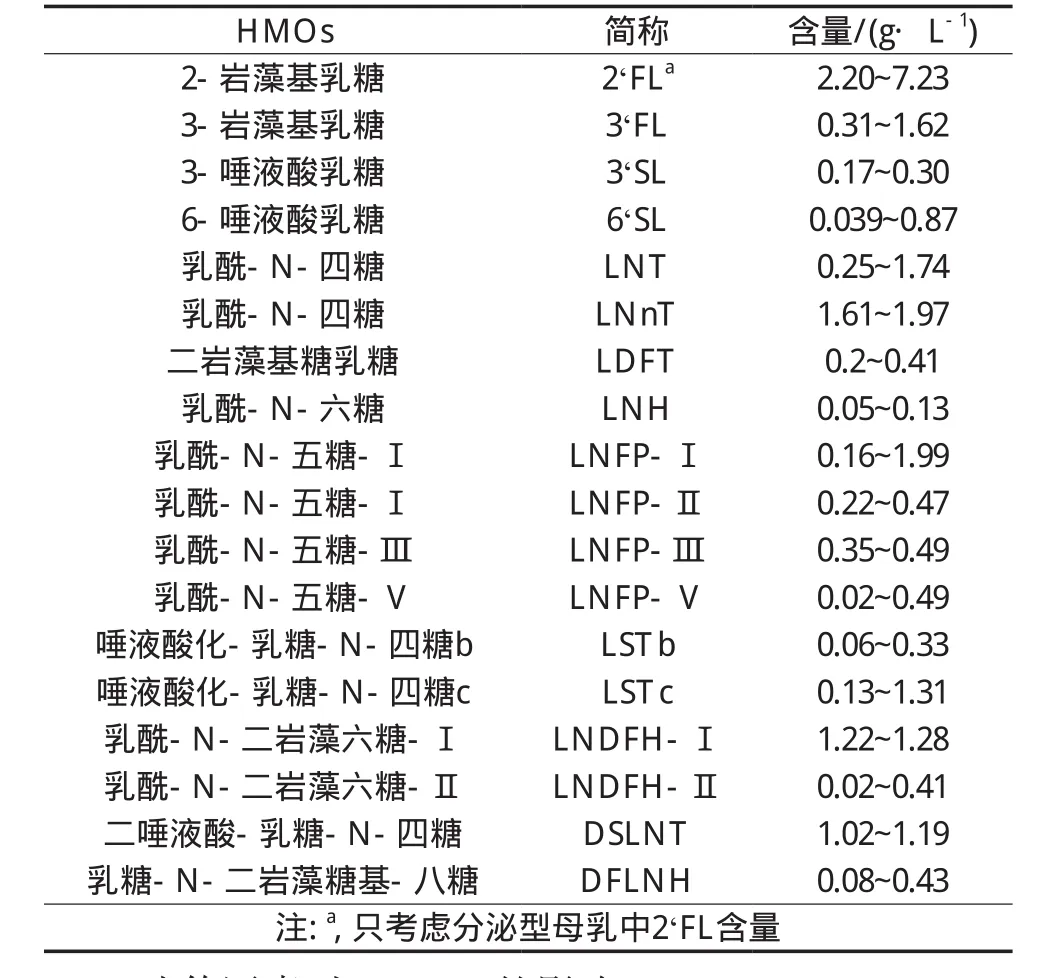
表1 母乳中常见HMOs种类和含量
2.1 遗传因素对于HMOs的影响
母乳中一些最具代表性的HMOs如2’FL、LNFP I和LNFP II具有显著遗传差异性,a-1, 2岩藻糖基化HMOs的差异取决于母亲岩藻糖基转移酶基因(FUT2)表达,从而决定分泌体(Se)状态。分泌型母亲的乳汁中含有丰富的2’FL、LNFPI等a-1, 2-岩藻糖化HMOs,而在非分泌性母亲的乳汁中FUT2和a-1, 2-岩藻糖化HMOs比较缺乏[9]。因此可以通过血清学检测或母乳中HMOs模式确定母亲的分泌状态。
2.2 泌乳期对HMOs的影响
HMOs的结构和组成在哺乳过程中各不相同,一项欧洲母乳研究报告称,泌乳期和遗传血型一样,是HMOs变化的最大影响因素之一[5]。总HMOs浓度随泌乳时间的延长而降低;但有些HMOs则可能增加。对中国乳母产后第3~第202天的母乳样本中HMOs的一项研究表明,随着泌乳时间的延长,2’FL水平显著降低,3’FL水平显著升高[4]。但也存在一些相反的研究结果。如姚文等[10]检测上海的51名乳母的母乳中9种低聚糖的变化趋势,认为2’FL和3’FL随泌乳期呈上升趋势。可能是检测技术手段或人群差异导致的。
2.3 妊娠期对HMOs的影响
关于妊娠期对母乳中HMOs的影响研究较少。Gabrielli等[11]通过对早产儿和足月儿分娩乳母的系列母乳样本中HMOs的岩藻糖基化和唾液酸化的质谱分析表明,与足月母乳相比,早产儿母乳中LNT含量更丰富,变化也更大,其中分泌性早产儿初乳中HMOs含量最高。国外学者Austin等[12]对25名早产儿和28名足月儿乳母的500份母乳样本进行分析。大多数HMOs浓度相当,但是a-1, 2-岩藻糖化HMOs在早产儿乳母的母乳中低于足月儿乳母,3’FL在早产儿乳母的母乳中较高。最大的差异出现在产后40周左右,此时足月儿乳母的母乳中HMOs浓度最高。
2.4 其他母体因素对HMOs的影响
乳母的生理状况(如BMI)和分娩条件(如分娩方式和产次)也可能影响乳母中母乳的糖基化,从而影响HMOs的组成。有限数据表明HMOs与母体因素之间存在相关性,如体重、体重指数(BMI)、胎次和年龄。最新对来自欧盟7个国家的290名健康母乳的一项研究表明,高体重和高BMI的乳母中3’SL和6’SL显著较低,剖腹产分娩的乳母中,2’FL、3’SL和6’SL浓度低于顺产的乳母,初次分娩的乳母的母乳中几种HMOs(3’FL、6’SL、LNFP-II、LNFP-V)浓度较低,而其他HMOs(如DSLNT、LNnT)浓度较高[5]。
3 HMOs的功能
对HMOs的功效研究一直是HMOs研究的热点之一,研究报道HMOs的有益作用包括肠道微生物群的调节,对病原体的抗黏附作用,以及免疫系统发展。
3.1 调节肠道菌群
婴儿肠道菌群定植在分娩前就已开始,并且持续至出生后最初2~3年,对于婴儿的胃肠道、代谢、神经及免疫发育均具有至关重要的作用[13]。母乳喂养与配方奶喂养婴儿的肠道菌群存在差异[14],究其原因,部分是由于母乳中含有高浓度HMOs,而婴儿配方中却缺少HMOs[14]。一些体外研究表明,HMOs能促进某些益细菌的生长,抑制致病菌的生长。由于大多数HMOs不被人体的胃酸破坏,不被消化酶分解,能直接达到大肠,从而被某些细菌发酵利用,产生短链脂肪酸,形成酸性环境,有利于肠道益生菌的生长。此外,HMOs作为黏膜表面条件致病菌的诱饵受体,减少病原体而发挥作用。但不是所用HMOs能被所有双歧杆菌利用。在母乳喂养婴儿肠道菌群中,通常以双歧杆菌类为主,尤其是长双歧杆菌的富集[15]。经基因组测序发现,长双歧杆菌的独特性在于其拥有所有能将完整的HMOs转运至细胞内所需的低聚糖转运蛋白和酶,并在细胞内对其进行分解[16]。而其他双歧杆菌和类杆菌拥有的酶可分解细胞外膜上的HMOs,并将其产物转运至细胞内进行代谢[17]。如果HMOs在细胞外被水解,那么其他细菌就可以利用这些糖类化合物,此即交叉喂养。有证据表明,与配方奶喂养的婴儿相比,母乳喂养的婴儿含有更多的双歧杆菌。婴儿喂食添加2’FL和LNnT的配方奶粉时,与未添加益生菌的配方奶粉相比,会产生一种独特的粪便细菌谱,与母乳喂养的婴儿更相似。
3.2 抗菌黏剂
母乳可以保护婴儿免受肠道和其他病原体的侵害,原因之一在于母乳中大量存在HMOs。HMOs通过增强肠道屏障功能来改善宿主的防御机制。如作为抗菌剂直接减少微生物感染,并通过向非致病性微生物提供竞争优势,间接控制病原体。HMOs可能模仿病毒受体的结构,并阻止对目标细胞粘附,从而防止感染[18]。
3.3 免疫调节剂
HMOs的一个重要特性是免疫调节。HMOs直接调控肠道细胞的基因表达,导致细胞表面聚糖表达改变和其他细胞反应[19]。HMOs调节淋巴细胞细胞因子的产生,使TH1/TH2反应更加平衡。母乳喂养的婴儿和实验配方添加2’FL的婴儿的血浆炎症细胞因子浓度明显低于对照配方添加低聚半乳糖的婴儿。补充2’FL的配方奶粉喂养的婴儿血浆炎症细胞因子水平较低,并与母乳喂养的参照组相似[20]。
4 母乳寡糖的安全性
针对健康足月婴儿的一项随机对照研究表明,添加2-FL的配方奶粉耐受性良好,且2-FL吸收曲线与母乳喂养的婴儿相似。从出生到4个月大,婴儿的体重、身高和头围发情期没有显著差异[21]。另一项对健康婴儿的随机对照试验表明,含有2-FL和LNnT的配方奶粉安全、耐受性好,支持适当年龄的正常生长[22]。国内外行业领先的奶粉企业意识到HMOs对婴儿的重要性及安全性,并不断加强对这一重要成分的研究与探索,而且一些具有强大科研实力的国外企业已经推出相关产品。
5 结语
HMOs是当代新生儿营养领域的一大热点,因为它们构成母乳对婴幼儿免疫保护的一个主要组成部分。临床研究进展认为,补充提供HMOs对不能母乳喂养的新生儿是一个有吸引力的选择。随着分析技术和生产水平进步,母乳低聚糖的研究取得长足发展,并在过去几年得到较大突破,特别是对于HMOs的安全性和功能。但仍有许多关键问题需要回答。如HMOs的特别选择,哪些是特定的HMOs,具体的量是多少,应该使用多长时间。中国母乳研究领域母乳寡糖数据有限,有必要提供新的和全面的数据。更深刻地认识中国母乳的特点及其对婴幼儿健康的影响。在未来,可通过了解母亲HMOs相关的基因型及乳母状自身状态因素来预测母乳中HMOs种类和含量,为母婴的个体化营养提供参考。
