阻塞性睡眠呼吸暂停综合征与视网膜分支静脉阻塞的关系
2020-11-02李晓清李璐希
李晓清,陈 莲,李璐希,姜 钊,何 珂,雷 敏,张 鹏
0 引言
视网膜分支静脉阻塞(branch retinal vein occlusion,BRVO)为常见的视网膜血管性疾病。流行病学研究表明,BRVO主要发生于60岁以上的老年人群,其在人群中的发病率高达0.5%~1.6%[1]。BRVO多累及颞侧视网膜,其中以颞上BRVO最为多见,约占全部病例的60%以上[2]。病理学研究证实,视网膜动静脉交叉处的动、静脉共用鞘膜。由于老年人硬化、增厚的视网膜小动脉压迫共同鞘膜内的静脉,使静脉狭窄、静脉的血流形成湍流而损伤血管内皮细胞,进而引起血栓形成,这可能是BRVO发生的主要病理机制[3]。与BRVO相关的全身及眼部危险因素包括动脉硬化、高血脂、高血压、糖尿病、高黏度血症、吸烟、肥胖、青光眼以及视网膜血管炎等[4]。阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是一组与上呼吸道狭窄、阻塞以及呼吸中枢神经调节障碍有关的睡眠呼吸疾病,其典型的临床特征为睡眠状态下反复发作的呼吸暂停和(或)低通气、睡眠中断,导致夜间低氧血症和高碳酸血症。OSAS不但使患者的夜间睡眠质量严重下降及白天嗜睡,还会使机体产生一系列病理生理改变[5],如继发交感神经兴奋,造成小动脉收缩、外周循环阻力增加、脑血流自主调节障碍等。研究证实,OSAS是高血压、糖尿病、动脉粥样硬化、脑卒中等疾病以及开角型青光眼的重要危险因素[6-7]。多导睡眠呼吸监测(polysomnography,PSG)是目前国际公认的用于诊断OSAS的金标准[5]。由于BRVO的发病危险因素与OSAS相关的系统性病变如高血压等类似,为了明确OSAS与BRVO的关系,本研究对BRVO患者中OSAS的发病情况进行了分析。
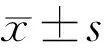
表1 BRVO患者及对照组的一般资料和多导睡眠监测结果比较
1 对象和方法
1.1 对象将2016-10/2018-12在西安市第三医院连续就诊的70例BRVO患者纳入研究。BRVO患者就诊时年龄为44~75(平均59.75±13.69)岁。男45例,女25例。病程为1wk~24mo。70例BRVO均为单眼发病,其中,右眼发病者38例(54%),左眼发病者32例(46%)。对纳入研究的BRVO患者均行最佳矫正视力(BCVA)、裂隙灯显微镜、直接及间接检眼镜、眼底彩色照相、荧光素眼底血管造影(FFA)后予以确诊,并被排除糖尿病、难治性高血压、白血病、贫血、肝肾疾病等。随机选择2016-10/2019-12在西安市第三医院睡眠实验室进行OSAS筛查,且与BRVO患者的性别、年龄相匹配的健康体检者70人作为对照组。纳入对照组的研究对象均被排除患有难治性高血压、糖尿病、肝肾疾病、贫血、血液病等全身疾病及青光眼、视网膜血管病变、黄斑疾病以及视神经疾病。本研究符合《赫尔辛基宣言》伦理准则并获得西安市第三医院医学伦理委员会同意,所有受试者均签署知情同意书。
1.2 方法
1.2.1 BRVO分期标准BRVO分期标准[8]:急性期:视网膜分支静脉扩张、迂曲,可见视网膜出血、水肿及棉绒斑。慢性期:视网膜有侧支循环生成,可见视网膜渗出或分支静脉已呈白线样闭塞,视网膜出血及棉绒斑仍存在或已消失。
1.2.2 OSAS诊断
1.2.2.1 OSAS评估问卷采用Berlin调查问卷对BRVO患者及对照组进行调查分析。该问卷由打鼾频率及响度、呼吸暂停次数、白天嗜睡状况及体质量指数(body mass index,BMI)等组成[9]。根据问卷结果的分值对OSAS进行评级,对OSAS高危者进一步进行PSG检查。
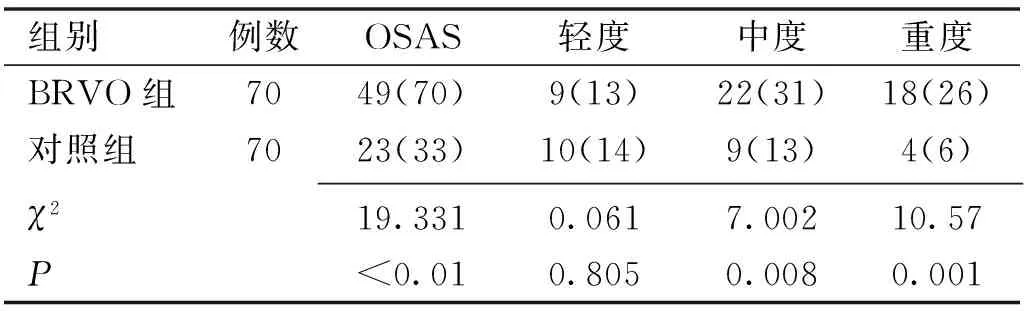
表2 BRVO组及对照组OSAS患病情况比较例(%)
1.2.2.2夜间睡眠监测BRVO患者及对照组患者于19∶00前进入西安市第三医院睡眠实验室适应环境,并在检查当日禁止饮用咖啡、饮酒等兴奋性饮料并禁服安眠药、禁止午睡以及剧烈活动,以保证夜间睡眠质量。由同一名技师于20∶00将PSG(型号:Somté)的电极及信号采集器连接于患者身体特定部位的皮肤表面,从21∶00至次日6∶00对患者的呼吸暂停低通气指数(apnea-hypopnea index,AHI)及最低血氧饱和度(minimum oxygen saturation,MOS)等指标进行持续监测。监测指标包括:以中华医学会呼吸病学分会睡眠学组修定的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》[10]作为诊断标准:有典型的睡眠时打鼾及白天嗜睡症状,经PSG提示AHI≥5次/h。根据AHI数值将OSAS病情分为轻、中、重度。轻度:5≤AHI<15,中度:15≤AHI<30,重度:AHI≥30。
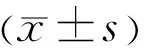
2 结果
2.1 BRVO组和对照组一般情况及PSG监测结果比较对BRVO组和对照组的年龄、性别、BMI、平均AHI及夜间MOS进行比较,结果见表1,两组间AHI及MOS的差异均有统计学意义(P<0.01)。
2.2 BRVO组和对照组OSAS患病情况比较根据PSG获得的AHI,70例BRVO患者中有49例(70%)伴发OSAS,其中轻度OSAS 9例、中度OSAS 22例、重度OSAS 18例。对照组中OSAS患者为23例(33%),其中轻度OSAS 10例、中度OSAS 9例、重度OSAS 4例。对两组的OSAS患病人数及病情分级进行比较,BRVO组OSAS的患病人数明显多于对照组(P<0.01),且BRVO组中度及重度OSAS人数也显著多于对照组(P=0.008、0.001),见表2。

表3 急性与慢性BRVO患者的一般资料和多导睡眠监测结果比较
2.3 OSAS与BRVO之间的相关性对OSAS与BRVO进行Spearman相关性分析,两者呈正相关(rs=0.319,P=0.033)。
2.4 急性与慢性BRVO患者的一般资料和PSG结果比较根据BRVO患者眼部体征,70例患者中急性及慢性BRVO患者分别为39例和31例。急性BRVO患者与慢性BRVO患者的年龄、BMI、OSAS患病率、AHI及MOS比较,差异均无统计学意义(P>0.05,表3)。
3 讨论
BRVO虽然累及部分视网膜,但仍可导致患者出现视力下降及视野缺损,甚至可因BRVO继发视网膜新生血管(retinal neovascularization,RNV)、黄斑水肿以致产生玻璃体积血、牵拉性视网膜脱离、黄斑视网膜萎缩、新生血管性青光眼等并发症而永久致盲[4]。
针对BRVO患者,除了严格控制血脂等全身因素之外,目前主要的治疗方法包括视网膜激光光凝以及眼内注射糖皮质激素或抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物,然而,BRVO的发生机制尚不完全清楚,现有的各种治疗方式有其自身的优点和不足之处[11]。如激光光凝可封闭扩张、渗漏的视网膜毛细血管并触发内皮修复,从而减少血视网膜屏障(blood retina barrier,BRB)的渗漏造成的黄斑水肿。此外,激光光凝视网膜无灌注区可进一步减少VEGF的产生、抑制RNV的生长,但激光作用于病变部位可导致光感受器等组织细胞永久受损[11]。眼内药物注射可抑制视网膜血管渗漏及RNV生成,促进黄斑水肿减轻,但药物注射后可能出现眼压升高、眼内炎等并发症不容忽视[12-13]。因此,明确BRVO发病原因,控制与BRVO相关危险因素对于预防BRVO的发生或减轻BRVO的病情至关重要。
由于BRVO患者以老年人为主,且系统性高血压及动脉粥样硬化是BRVO发生、进展的主要危险因素。研究证实,OSAS作为老年人代谢综合征的一部分,也是高血压及动脉粥样硬化的独立危险因素[14-15]。OSAS是睡眠过程中出现的因间歇性上呼吸道阻塞引起的频发性呼吸障碍,对OSAS的诊断主要依靠睡眠呼吸记录装置在患者夜间睡眠后对AHI的记录分析[5]。
在本研究中我们发现,BRVO患者中有49例(70%)伴发OSAS,而对照组中仅有23例(33%)OSAS患者,即BRVO患者中OSAS的发病率显著高于对照组(P<0.01),且BRVO患者的AHI(19.74±7.59)较对照组(13.69±6.35)明显提高(P<0.01),与之相对应,BRVO患者的MOS也较对照组明显降低(P<0.01)。AHI升高及MOS降低均说明BRVO患者在夜间更易于发生通气障碍。
研究证实,OSAS引起的慢性间歇性低氧可引起血清总胆固醇及低密度脂蛋白胆固醇水平升高,并可通过多种病理生理机制加重动脉粥样硬化的发生及发展[5-6],其可能的机制包括:(1)MOS降低可引起机体氧化应激损伤,触发体内多种炎性转录因子的表达,引起超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、白介素6(interleukin 6,IL6)、单核细胞趋化蛋白(monocyte chemoattractant protein-1,MCP-1)等炎性因子增加,促进动脉管壁中巨噬细胞对脂质的摄取、内皮细胞粘附因子的表达及内皮功能紊乱,进而诱发或加剧动脉粥样硬化。(2)OSAS引起的间断性低氧可导致机体交感神经兴奋性增高,使心搏加快、心肌收缩力增加、心肌耗氧量增多,并进一步激活机体内肾素-血管紧张素-醛固酮系统,使去甲肾上腺素、肾上腺素等儿茶酚胺类物质水平升高,继而导致血压升高,增加心血管事件发生风险。(3)OSAS导致的MOS降低可引起血液成分改变,造成促红细胞生成素增多,红细胞数量升高,同时OSAS患者易于出现脂质代谢紊乱,导致体内血糖、总胆固醇、三酰甘油、低密度脂蛋白胆固醇等水平升高,血液粘稠度增加,进而通过对血流动力学的影响引起血管内皮功能改变,促进动脉粥样硬化的发生和发展。(4)MOS降低可诱导激活体内环氧合酶途径,其通过对血管紧张度的调节及诱导前列腺素等血管炎症因子,促进动脉粥样硬化的发生[16-17]。此外,OSAS可导致患者动脉血氧分压下降、血二氧化碳分压上升,造成儿茶酚胺大量释放、血压升高[18]。
此外,我们的研究还显示,OSAS与BRVO正相关(rs=0.319,P=0.033)。因此,我们认为,OSAS可能是导致BRVO发病的始动因素,其通过诱发或加重视网膜动脉粥样硬化影响BRVO的发生及进展。
根据BRVO病程及病理改变,BRVO在临床上可被分为急性及慢性[8]。急性BRVO即发病时间较短,此时视网膜分支静脉阻塞部位因动脉受压而变细,其远端静脉则因血液回流受阻而迂曲、扩张,沿静脉呈现扇形分布的出血,病变区域水肿、增厚,可见棉绒斑。BRVO发生6mo后即慢性期,约50%的患眼视力可逐渐提高,此时BRVO患眼的视网膜出血逐渐吸收、水肿消退,视网膜出现渗出,受累静脉管径恢复或粗细不均,静脉管壁白鞘或闭塞呈白线样。阻塞支静脉与邻近未阻塞的静脉形成侧支循环。约36%的BRVO患眼有RNV生成。另有约50%患者因长期黄斑水肿、萎缩或瘢痕形成而导致视力永久受损[19-20]。
我们对急性及慢性BRVO患者中OSAS情况进行了对比,结果显示,急、慢性BRVO患者的AHI及MOS差异无统计学意义(P>0.05),即急、慢性BRVO患者的OSAS病情类似。因此,OSAS不但与BRVO的发生相关,也可能是导致BRVO病情迁延的重要原因。鉴于OSAS可能是BRVO发病的始动因素,或者与OSAS相关的系统性病变如动脉粥样硬化等可导致BRVO发生,因此有必要将OSAS的筛查及治疗作为防治BRVO的手段之一。
目前,有关OSAS与BRVO相关性的研究已有零星报道,如Kwon等[21]对19例BRVO患者进行OSAS筛查,发现其中有8例(42.1%)伴发OSAS,该研究组认为OSAS可能是BRVO发病的重要危险因素。而我们的研究纳入的BRVO患者多达70例,且研究方法为病例对照,所获得的有关OSAS与BRVO相关性的循证医学证据质量较高。
综上所述,OSAS与BRVO以及高血压、动脉粥样硬化等系统性疾病的发生发展密切相关。眼科医师须重视OSAS与BRVO的关系,通过对OSAS的早期诊断及治疗以期减少BRVO的发生及进展。然而,本研究尚有不足之处,如研究中的样本量较小、未针对BRVO患者伴发的OSAS进行试验性治疗以观察其对BRVO病情的改善是否有作用。因此,有关OSAS与BRVO的关系仍需进行大样本、多中心性研究。
