耐盐碱溶磷菌Y2R2的分离鉴定及溶磷特性
2020-11-02杨海霞刘希旻潘奕臣赵香林黄海东
杨海霞 刘希旻 潘奕臣 赵香林 黄海东
(天津农学院 农学与资源环境学院,天津 300384)
土壤盐渍化是影响农业产量的主要因素之一,全球盐渍土壤面积已达9.5×108hm2,其中由于灌溉、施肥不当及城市融雪等人类活动造成的次生盐渍化日益严重[1-3]。盐渍土及碱性环境下,大量磷元素转化为难溶性的磷酸盐而被土壤固定,从而出现土壤盐碱化和“遗传学缺磷”并存的现象,新施入磷肥的当季作物利用率低,造成土壤的潜在磷库虽很大,但有效磷含量却很低,植物很难直接吸收利用[4-5]。前人研究发现,自然界中存在大量具有溶磷能力的微生物,这类溶磷微生物能分泌有机酸、磷酸酶或以其他方式将被土壤固定的难溶性磷转化为植物可利用的有效磷[6]。将溶磷菌制成菌剂在农田中施用,能在不增加土壤磷库的情况下,提供更多的磷元素供作物生长,溶磷菌还能改善土壤的盐碱条件,增加土壤微生物群落多样性,通过在作物根际的繁殖而抑制其他病原菌的生长,从而减轻作物病害[7]。目前筛选到溶磷能力较强的细菌包括芽孢杆菌属(Bacillus)、节杆菌属(Arthrobacter)、曲霉属(Penicillium)和假单胞菌属(Pseudomonas)的一些菌株[8],这些溶磷菌大多从耕作土壤或植物根际中筛选得到[9-10],对盐碱土壤的适应能力较差。盐碱土壤中有一些优势的种群,如盐单胞菌属(Halomonas)。这种革兰氏阴性无芽孢的细菌大多可以耐受12%以上的盐度[11],但目前盐碱土壤中盐单胞菌属溶磷特性的研究还未见报道。
天津滨海新区属于海积平原地貌,土壤长期受到海水和风暴潮的浸蚀,地下水位高,排水不畅,形成高盐碱度的滨海盐渍土[12-13],是耐盐碱微生物筛选的理想采样地。本实验从天津滨海新区盐碱土中分离到一株耐盐碱溶磷菌Y2R2,对该菌株进行了分类鉴定,并研究了其溶磷特性,旨为今后制作耐盐碱溶磷菌剂提供菌种资源及滨海盐碱地改良和解决盐碱土壤固磷强度高的问题提供支持。
1 材料与方法
1.1 材料
1.1.1 试剂 土样采自于天津滨海新区盐碱地土壤,北纬39°4'46'',东经117°41'37''。细菌基因组DNA提取试剂盒,Taq酶,质粒提取试剂盒,普通DNA产物纯化试剂盒,pGM-T克隆试剂盒均等购自北京天根公司,钼酸铵、丙酮酸钠、抗坏血酸等均为分析纯。
1.1.2 培养基 R2A培养基(g/L):酵母膏0.5,蛋白胨0.5,酸水解酪素0.5,磷酸氢二钾0.3,葡萄糖0.5,可溶性淀粉0.5,丙酮酸钠0.3,硫酸镁0.05,氯化钠20,琼脂15,pH 9.0±0.2。无机磷培养基(g/L):葡萄糖10,硫酸铵0.5,酵母浸粉0.5,氯化钾0.3,硫酸镁0.3,硫酸亚铁0.03,硫酸锰0.03,磷酸三钙5,琼脂15,氯化钠20,pH 9.0±0.2。
1.2 方法
1.2.1 耐盐碱溶磷菌的筛选 取10 g盐碱地土样,加入90 mL无菌水涡旋振荡10 min,静置5 min后将上层悬液进行倍比稀释,取100 μL涂布于pH 9.0、盐度4%的R2A培养基平板上,30℃培养72 h,筛选耐盐碱细菌,分离纯化的耐盐碱菌再转接到无机磷固体培养基上,筛选有溶磷圈的菌落,分离纯化后保藏于-80℃冰箱中。
1.2.2 菌株的形态学及生理生化特征测定 使用JEM1230透射电子显微镜进行菌株的形态学观察;接触酶、脲酶、七叶苷水解、生长的温度、pH和NaCl范围等生理生化指标的测定参考文献[14]进行;使用BioMérieux公司的API ZYM试剂条测定19种酶的活性。
1.2.3 菌株的16S rDNA基因序列测定及系统进化分析 利用细菌DNA提取试剂盒提取试验菌株的基因组DNA,采用细菌16S rDNA扩增通用引物27F和1492R进行PCR扩增,程序为95℃预变性5 min;94℃变性45 s,59℃退火45 s,72℃延伸1 min,共30个循环;72℃延伸10 min。PCR产物进行琼脂糖凝胶电泳检测后,用DNA产物纯化试剂盒纯化PCR产物,与pGM-T载体连接后,转化至TOP10感受态细胞中,在含 IPTG和X-Gal的LB平板上37℃过夜培养,挑取白色单菌落,验证并送上海生工进行测序。将得到的16S rDNA序列与GenBank中的核酸数据进行BLAST比对,得到与其同源性较高的对照菌株及序列,采用软件Clustal X1.83进行多序列比对分析[15],得到序列之间的相似值;用软件Mega 6计算出序列的系统进化距离,采用邻位相连法构建进化树[16],Bootstrap值为1 000。
1.2.4 菌株Y2R2的全基因组测序及分析 提取菌株Y2R2的基因组DNA,在北京百迈客公司的Nanopore和Illumina平台进行文库构建和基因组测序,测得4 221 Mb的原始数据,通多过滤接头、短片段及低质量数据后,共得到4 146 Mb的Clean Data,测序深度为847 X,拼接得到0 gap的菌株Y2R2基因组完成图。参考文献[17]的方法进行平均核苷酸一致性(Average Nucleotide Identity,ANI)和DNA-DNA杂交(DNA-DNA hybridization,DDH)分析。
1.2.5 全细胞脂肪酸分析 按照Sasser[18]的方法进行样品的提取、皂化、甲基化和萃取,使用Agient 7890气相色谱仪检测脂肪酸组分,参考MIDI Sherlock细菌系统数据库进行分析鉴定。
1.2.6 可溶性磷含量的测定 取1.0 mL发酵液,于4℃,8 000 r/min离心5 min,取上清液稀释至合适倍数,用钼蓝比色法测定可溶性磷的含量[19],计算公式如下:Y=m×15.91A,式中Y为发酵液中可溶磷含量(mg/L),m为稀释倍数,A为660 nm处吸光度值。
1.2.7 数据处理 可溶磷含量的测定,每个处理3个重复,采用Excel 2016进行数据分析和作图。
2 结果
2.1 耐盐碱溶磷菌的筛选
在天津滨海新区盐碱地土壤中分离得到多株耐盐碱细菌,将这些菌种转接到无机磷固体培养基上,筛选得到1株耐盐碱溶磷菌(图1),命名为Y2R2,进一步试验表明该菌株可以耐受的最高pH为14,NaCl浓度为15%,具有较强的耐盐碱性能。
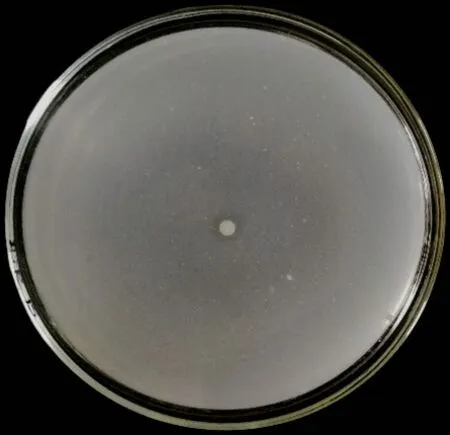
图1 菌株Y2R2产生的溶磷圈
2.2 菌株Y2R2的分类鉴定
2.2.1 菌株Y2R2的形态特征 在R2A培养基平板上30℃培养2 d,菌株Y2R2形成边缘整齐的乳白色菌落,质地均匀、边缘整齐,直径1.5-2.3 mm。菌株Y2R2的细胞大小为0.4-0.7 μm × 1.7-2.6 μm,杆状,无鞭毛(图2),革兰氏阴性。
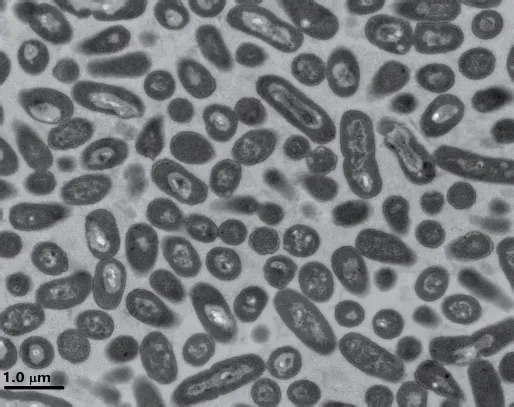
图2 菌株Y2R2的细胞形态(5000×)
2.2.2 菌株Y2R2的16S rDNA序列测定及系统进化分析 扩增得到菌株Y2R2的16S rDNA序列,长度为1 460 bp,在GenBank/EMBL/DDBJ中的序列登记号为MK660018。将该序列在GenBank数据库中进行BLAST比对,得到与其同源性高的序列信息,进而进行Clustal X1.83比对,并利用软件MEGA 6的邻位相连法构建系统进化树(图3),结果表明菌株Y2R2属于盐单胞菌属(Halomonas),与Halomonas huangheensisBJGMM-B45划分在同一个簇内,与该菌株的同源性也最高,为98.1%。
2.2.3 菌株Y2R2的全基因组测序及分析 菌株Y2R2的基因组长度为4 895 267 bp,在GenBank/EMBL/DDBJ中的登记号为CP038437,基因组数据分析表明菌株Y2R2的G+C含量为57.02 mol%,基因组中非编码RNA中有rRNA 15个,tRNA 65个;基因组中编码基因为4 286个,总长度4 327 563 bp,编码基因的平均长度为1 010 bp;有33个磷酸酶相关的编码基因,其中有2个碱性磷酸酶编码基因。利用ANI分析,可以从全基因组水平评估菌株Y2R2与同属中相似菌株的亲缘关系,将菌株Y2R2与16S rDNA序列最接近菌株H. huangheensisBJGMM-B45的基因组数据(CP013106)进行ANI分析,按照BLAST(ANIb),MUMmer(ANIm)和OrthoANIu三种算法,ANI数值分别为74.9%,84.7%和75.1%,均小于95%的新菌判定阈值。按照基因组间距离计算(Genome-to-genome distance calculator,GGDC)方法,进一步将菌种Y2R2与H.huangheensisBJGMM-B45的基因组进行digital DDH分析,数值为22.2%。

图3 菌株Y2R2的16S rDNA序列系统进化树
2.2.4 菌株Y2R2的全细胞脂肪酸分析 全细胞脂肪酸分析是细菌化学分类鉴定的重要指标,菌株Y2R2的细胞脂肪酸分析结果如图4所示,经MIDI Sherlock全自动细菌鉴定系统分析,菌株Y2R2所含脂肪酸主要有C16:0(29.4%),C19:0 cyclo w8c(18.4%),C18:1 w7c/C18:1 w6c(17.8%),C16:1w7c/C16:1w6c(8.3%);而与Y2R2同源性最高的菌株H. huangheensisBJGMM-B45的细胞脂肪酸组成主要为:C18:1w7c(32.4%),C16:0(24.6%),C19:0 cyclo w8c(12.6%),C16:1w7c/C16:1w6c(11.1%),C12:0 3-OH(7.8%),C12:0(5.2%)。二者在占比最高的脂肪酸组分上不同,分别为C16:0和C18:1w7c,在其他细胞脂肪酸比例和组成上也有明显差别,说明Y2R2与菌株H. huangheensisBJGMM-B45在化学分类指标上不同。
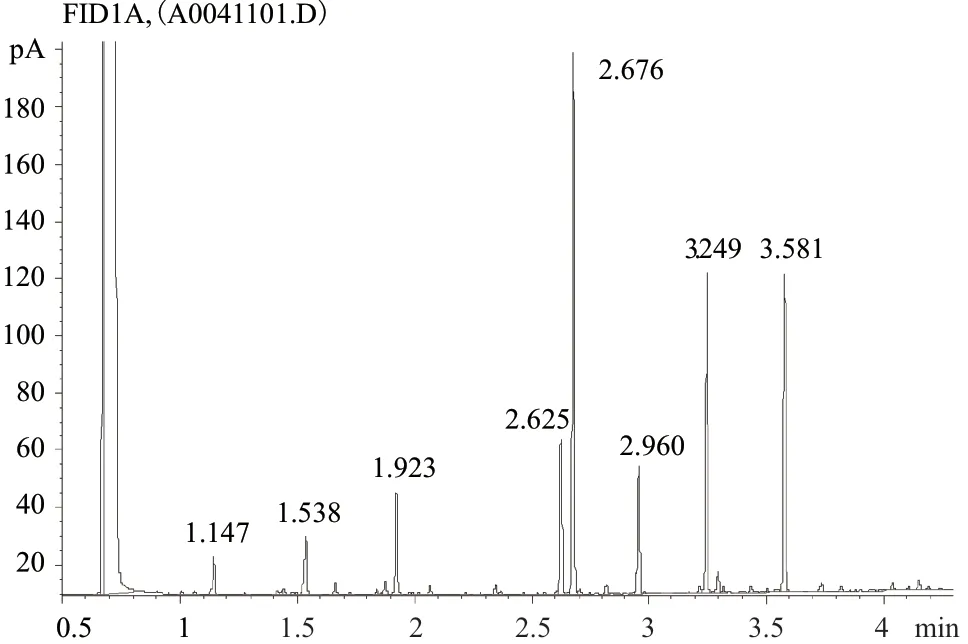
图4 菌株Y2R2的全细胞脂肪酸分析
2.2.5 菌株Y2R2的生理生化特征 菌株Y2R2的生长温度范围为10-45℃,生长的NaCl范围为0-15%,生长的pH范围是5-14。该菌株的其他生理生化指标如表1所示,可以看出菌株Y2R2的脲酶为阳性;酯酶(C14)为弱阳性;酪蛋白水解、酪氨酸利用、胰凝乳蛋白酶、β-半乳糖苷酶、α-甘露糖苷酶、α-葡萄糖苷酶、α-半乳糖苷酶和β-葡萄糖苷酶为阴性;菌株Y2R2的这些生理生化指标与H. huangheensis均不同。结合形态学、生理生化、基于16S rDNA系统进化、全基因组数据和细胞脂肪酸分析,确定菌株Y2R2为盐单胞菌属的一个新种。
2.3 培养时间对菌株Y2R2溶磷量的影响
将菌种Y2R2接种于无机磷液体培养基中,每12 h取样1次,检测发酵液pH、细胞浓度和上清液中的可溶磷含量,结果如图5所示,菌株Y2R2在发酵培养48 h达到最高菌量,细胞浓度为2.6×109CFU/mL,随着培养时间的增加,Y2R2培养液的pH也随之逐渐降低,36 h的pH为5.0,此后发酵液的pH稳定在5.0左右,随着发酵液pH的降低,溶磷量随之增高,在36 h出现溶磷量降低的现象,是由于此时菌株Y2R2处于对数生长期,快速繁殖的细胞需磷增加,将发酵液中的可溶磷重新摄入胞内。在48 h培养液中的可溶磷含量达到最高167.9 mg/L,48 h后由于细胞代谢活力的降低,菌株Y2R2的溶磷量开始下降。

表1 菌株Y2R2与H. huangheensis的生理生化特征比较

图5 培养时间对菌株Y2R2溶磷量的影响
2.4 NaCl浓度对菌株Y2R2溶磷量的影响
在NaCl浓度0-18%的培养条件下,检测培养48 h的发酵液,可以看出菌株Y2R2可以耐受较高的盐浓度(图6),当培养基中含有9%的NaCl时,细胞浓度为不含NaCl对照的91.3%,说明该菌株具有良好的耐盐性能。当NaCl浓度在12%以下时,发酵终点的pH均在5.8以下,且具有较好的溶磷效果,在9%的NaCl浓度时可溶磷含量最高,为239.2 mg/L。当盐浓度达到15%,菌株Y2R2的生长被抑制,可溶磷含量为9%盐度时的13.4%。
2.5 初始pH对菌株Y2R2溶磷量的影响
为研究菌株Y2R2在盐碱条件下的溶磷能力,在NaCl浓度9%,初始pH为7-14的无机磷液体培养基中进行发酵培养,结果如图7所示,可以看出菌株Y2R2的最适生长pH为8,在pH 9时细胞浓度为中性条件下的100.8%,pH 13时细胞浓度为中性条件下的70.6%。
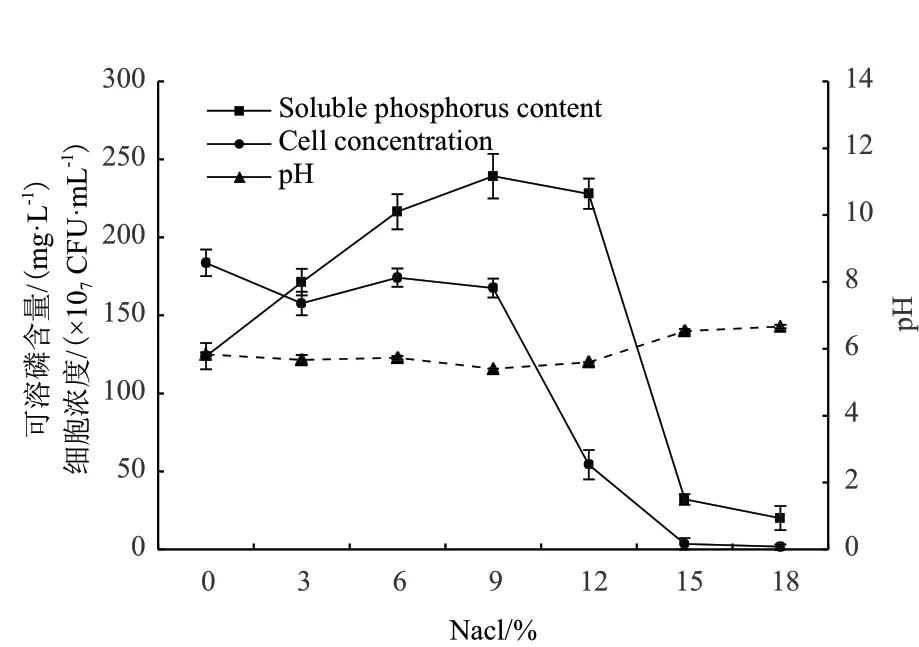
图6 NaCl对菌株Y2R2溶磷量的影响
在初始pH 7-9的范围内,发酵终点pH为5.1-5.4,具有较高的溶磷量,最高为pH 8时的247.6 mg/L;在初始pH 13时的溶磷量为115.4 mg/L,说明菌株Y2R2在盐碱条件下具有较强的溶磷能力。
3 讨论
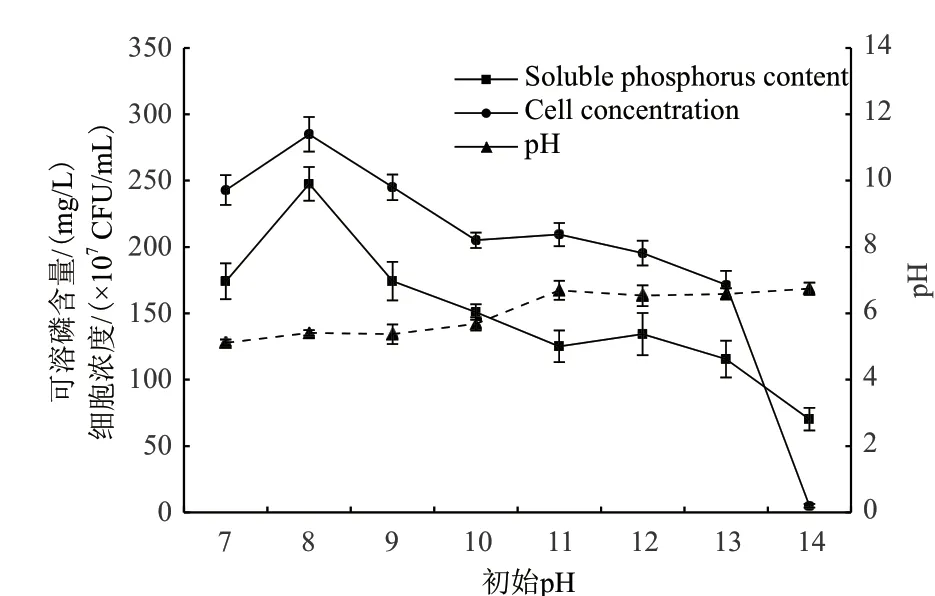
图7 初始pH对菌株Y2R2溶磷量的影响
本研究从天津滨海新区盐碱土中分离得到菌株Y2R2,基于16S rDNA的分子分类标准[20]及基因组、生理生化和全细胞脂肪酸的多相分类鉴定结果,试验菌株与H. huangheensis等[21]盐单胞菌属的模式菌种都存在明显不同,鉴定该菌株是盐单胞菌属的一个新种。盐单胞菌属是Vreeland等[11]根据从太阳能海水制盐厂分离到的菌株Halomonas elongata提出的,属于变形菌门(Proteobacteria),γ-变形菌纲(Gammaproteobacteria),海洋螺菌目(Oceanospirillales),盐单胞菌科(Halomonadaceae)的一个属,革兰氏阴性杆菌,能在0.1%-20%的NaCl浓度下生长,常在盐碱土、工业卤水和深海等高盐环境中分离得到[22-23]。王永妍等[24]研究表明在养殖海水中,盐单胞菌属在细菌种群中占比11.4%,是主要的优势菌属,汪辉等[25]从连云港赣榆附近海泥中分离到盐单胞菌GY1,任世英等[26]从黄海海域分离到盐单胞菌YSR-3。盐单胞菌属的一些菌株在降解芳香族污染物,生物脱氮和多糖合成方面均有潜在的应用价值,但在溶磷方面的应用尚未见报道。本研究分离得到的盐单胞菌Y2R2具有耐盐碱和溶磷能力,为该菌属提供了新的微生物资源。
施用微生物菌肥是盐碱土壤生物改良的重要措施,郑晓梅等[27]将分离得到的黑曲霉制成菌剂,施加到实验室的盐碱土壤中,56 d后土壤的pH值降低0.86-1.60,含盐量也下降;杨美英等[28]将含肠杆菌属NDW1和沙雷氏菌属NDW3的外源溶磷菌液施用在盐碱土中,盆栽试验表明水稻的净光合速率提高,产量增加。目前微生物菌剂种类繁多,在不同类型土壤上的应用效果相差较大,施入外来菌剂后,菌剂中的微生物在土壤中能否存活及繁殖数量受很多因素影响,如土壤环境变化的干扰、与土壤中其他土著微生物的生态位竞争等[29],外来菌株在盐碱土壤中的定殖就更为困难。天津盐碱地有4.9×105hm2,其中滨海新区盐碱程度最重,盐分主要以氯化物为主,土壤物理性状差,植物生长受到不同程度的影响[30]。本研究筛选到的菌株Y2R2是滨海新区盐碱土中的土著微生物,能较好地适应当地土壤和气候环境,后续将研究其菌剂对土壤和植物生长的影响,探索一种改良滨海盐碱土壤,增加土壤养分,并促进作物生长的方法。
本研究发现,盐单胞菌Y2R2可以在盐碱条件下将难溶性无机磷化物转变为植物可吸收利用的可溶性有效磷。细菌对难溶性无机磷的解磷机制,普遍认为是细胞向胞外分泌的各种有机酸降低了外界环境的pH,从而产生酸解效应[31]。本实验中,在发酵液初始pH 10以下时,接入菌种培养48 h后,发酵液的pH均在5.7以下;在NaCl浓度12%以下时,发酵48 h后的pH均在5.6以下,说明试验菌株在盐碱条件下可产酸,从而造成难溶磷酸盐的酸解。由于盐单胞菌Y2R2的全基因组测序已经完成,从基因组功能注释和代谢分析可以找到与丙酮酸合成相关的基因5个,顺乌头酸酶编码基因5个,柠檬酸合成酶编码基因3个,苹果酸脱氢酶编码基因2个,葡萄糖醛酸合成所需的葡萄糖脱氢酶编码基因2个。鉴于盐单胞菌属菌株产生有机酸的种类和溶磷机制还未见报道,菌株Y2R2与溶磷相关的有机酸合成种类和含量,还需要进一步的试验测定,特别是盐碱对这些有机酸合成的调控机制需要进行深入研究。本研究筛选到的的菌株具有较高的耐盐碱和溶磷能力,为滨海盐碱地的土著微生物新种,能够更好地适应本地土壤和气候环境,有望用于溶磷菌剂的制备,为滨海盐碱地改良和解决盐碱土壤固磷强度高的问题提供了优良菌种。
4 结论
菌株Y2R2为革兰氏阴性杆菌,其16S rDNA序列与盐单胞菌属其他菌株的最高同源性为98.1%,基因组ANI和DDH值均小于新菌判定的阈值,结合生理生化和全细胞脂肪酸数据分析,鉴定菌株Y2R2是盐单胞菌属的一个新种。菌株Y2R2的生长温度范围为10-45℃,具有一定的耐盐碱能力,在0-15%的NaCl范围,5-14的pH范围内均可生长。菌株Y2R2在pH 8和NaCl浓度9%的无机磷培养基中,发酵48 h溶磷能力最高,达到247.6 mg/L。
