一株能够降解聚乙烯的霍氏肠杆菌的鉴定及分析
2020-11-02高超郝孔利赵宇婷毛樱翔池明眼张杰
高超 郝孔利 赵宇婷 毛樱翔 池明眼 张杰
(东北林业大学生命科学学院 东北盐碱植被恢复与重建教育部重点实验室,哈尔滨 150040)
1950年以来全世界仅非纤维塑料产量就达到了7 300 Mt,其中聚乙烯(Polyethylene,PE)就占到了36%[1]。PE触感似蜡,无味,无毒且稳定性极佳,可以承受除氧化性酸以外的大多数强酸和强碱[2]、PE在室温下不溶于大部分溶剂,有较低的吸水率,具有很强的耐低温性,因此PE被广泛应用与于各行各业[3]。然而使用周期短又难以回收的特点使其造成了严重的白色污染。排放到土壤中的PE碎片可存在长达数十年,累积的PE碎片不仅影响土壤环境,还可能进入食物链[4]。而一旦PE被排放到水环境中,它们可以持续存在50年,完全矿化可能需要数百年甚至数千年[5]。此外,PE碎片或颗粒还可以吸附和运输持久性有机污染物[6],进而作为有毒化学物质的载体,提供污染土壤环境的通道。水体中的塑料碎片可能成为入侵物种扩散的载体[7]。当前解决PE废弃塑料问题的方法有焚化,可降解型PE材料和微生物降解,垃圾填埋,回收和再利用[8-9],但是存在处理系统收集效率低、回收类型单一、管理机制不健全等问题,而可降解型PE的成本较高,而且尚未有研究表明在自然环境中可降解型PE可以被完全降解[10]。微生物降解PE的方式成本低,且绿色环保。因此研发出可高效降解PE的微生物对碳资源的再利用和促进生态环境的改善都意义深远。
1 材料与方法
1.1 材料
本实验所用的印度谷螟幼虫购于天津惠裕德生物科技有限公司,生化及分子生物学试剂DL 2000 DNA Marker由TaKaRa提供;27F、1492R和2×Mix试剂盒由中国金唯智生物工程公司提供;HP Fungal DNA Kit(50)试剂盒购自中国生工生物工程有限公司;链霉素选购于Solarbio公司;PE手套选购于海门市扬子医疗器械有限公司。无碳培养基(LCFBM)和LB培养基的配制参考池明眼[11]的方法。
1.2 方法
1.2.1 肠道液的获取 参考池明眼[11]的方法获取肠道液,将肠液加入到盛有40 mL生理盐水的离心管中,置于涡旋仪上振荡5 min,然后用移液管除去多余的肠组织和其他杂质,放置于4℃中备用。
1.2.2 肠道液中降解PE微生物的分离筛选 在超净工作台中将获取的蜡螟幼虫肠道液接种到预先制备的80 mL无碳液体培养基(LCFBM)中,并加入经预处理的PE膜片0.2 g,置于30℃的恒温摇床中,以120 r/min的速度摇动60 d[11]。之后取出剩余的PE片,将其置于LB液体培养基中,在恒温震荡培养箱中以30℃、120 r/min的条件培养。24 h后,吸取0.2 mL培养液接种到LB固体培养基上进行划线分离。
1.2.3 肠道液中降解PE微生物的鉴定 细菌总DNA使用OMAGE Bacterial DNA Kit试剂盒提取,PCR扩增条件与引物设计参考池明眼的方法[11]。PCR扩增产物由上海生物技术工程有限公司(中国上海)进行测序,测序结果与NCBI数据库中的序列进行比较,最后用MEGA7.5构建系统发育树。
1.2.4 LB-1降解PE疏水性的检测 LB-1降解PE 60 d后,从实验组和对照组中取出PE膜,除去其表面的生物膜,并使用视频光学接触角测量仪测量对照组和实验组的PE膜的表面疏水性的变化[4]。对照组不接种LB-1。
1.2.5 LB-1降解PE表面形貌的观察 取经LB-1降解60 d前后的PE膜,将生物膜去除后,使用SEM表征PE膜及其表面形貌。
1.2.6 LB-1降解PE表面化学结构的变化 取经LB-1降解60 d前后的PE膜,去除生物膜。使用FTIR对LB-1降解前后的PE膜的表面化学结构进行分析检测。
1.2.7 PE失重率的检测 LB-1降解10、30、60 d时取出实验组与对照组PE膜,去除生物膜,将去除生物膜的PE片在电热鼓风干燥箱中干燥。经精良天平称取重量以计算失重率。失重率计算公式为:失重率= 损失重量/原始重量
1.2.8 PE的可溶性产物检测 LB-1降解PE 60 d后将培养液回收,10 000 r/mim离心15 min,收集上清液,将其通过0.22 μm膜过滤器过滤后使用乙酸乙酯萃取可溶产物,使用GC-MS对可溶性产物的成分进行分析检测。
以上试验均重复3次。
2 结果
2.1 LB-1的形态学特征及生理生化试验
图1-A为菌株LB-1在LB固体培养基上的形态。培养基上菌株呈现出表面光滑,边缘整齐的乳白色圆形不透明菌落。显微镜下菌体形态为(0.5-0.6)μm×(1.1-2.5)μm的直杆状细菌,无芽孢(图1-B)。

图1 LB-1的菌落形态(A)和显微镜观察结果(B)
菌株LB-1的生理生化试验结果(表1)与《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》描述的霍氏肠杆菌(Enterobacter hormaechei)的生理生化特征基本相同,初步鉴定为霍氏肠杆菌。
2.2 系统进化树分析
从LB-1的系统发育树(图2)中可以看出,LB-1与霍氏肠杆菌(Enterobacter hormaechei)的同源性达到了92%。结合该菌株的形态学特征、生理生化特性和16S rDNA测序分析结果,将LB-1鉴定为Enterobacter hormaechei。

表1 LB-1的生理生化试验
2.3 PE表面疏水性的检测
PE材料表面与水的接触角大小是其亲疏水性能的体现。通常来说,PE材料与水的接触角越小,其亲水性能越高,微生物附着定殖的趋势越大。对LB-1降解 60 d前后PE膜的水接触角进行检测,结果如图3所示,被LB-1降解后的PE接 触 角为77.55°±0.15°,未降解的PE接触角 为100.05°±0.85°,可见降解后的PE的接触角变小。PE的接触角的减小表明PE的疏水性降低、亲水性升高,可初步说明PE表面在LB-1的作用下被氧化产生亲水基团。PE表面亲水基团的产生有利于菌株大量的附着和定殖,使PE抵抗菌株降解的能力下降。
2.4 PE表面形貌的观察

图2 LB-1的系统发育树
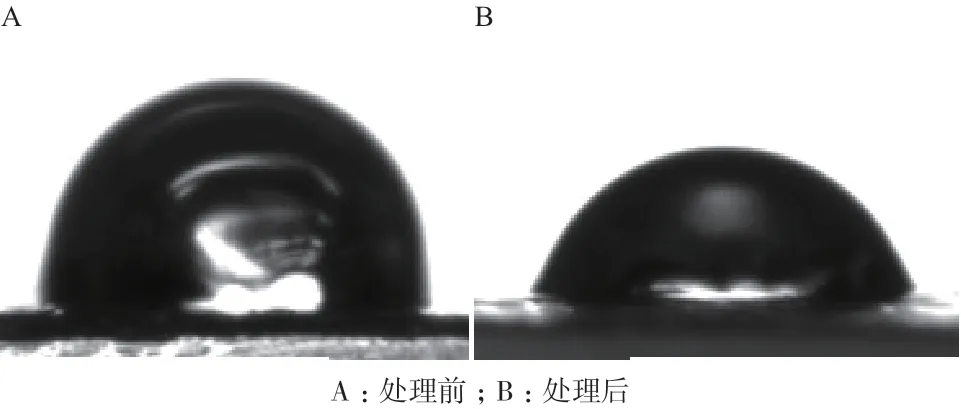
图3 LB-1降解前后的PE的水接触角
PE表面形貌的变化是一项间接证明PE被降解的证据。将LB-1降解前后的PE膜进行清洗去除生物膜后,使用SEM扫描观察,结果见图4。图4-A、图4-B为LB-1降解后的PE表面形貌,图4-C为未经降解的PE表面形貌,可以看到经LB-1降解后的PE膜表面有很多凹坑和孔洞的形成,未经降解的PE膜表面则非常光滑,这表明LB-1菌株作用PE后可以对其表面形貌造成的损伤。
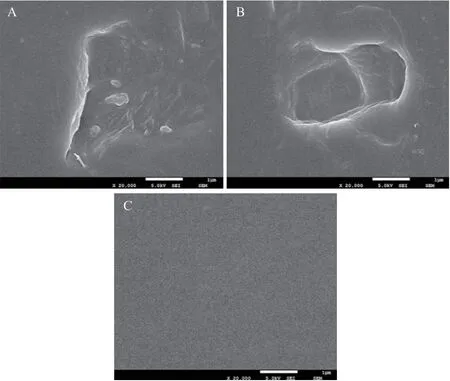
图4 LB-1处理PE之前和之后的SEM图像
2.5 LB-1降解前后PE膜表面化学结构的变化
通过分析PE表面化学结构的变化可以检测PE是否被氧化,一般羰基等基团出现在PE表面证明PE被氧化降解,而没被降解的PE的表面则不会出现这些基团。LB-1降解前后的PE膜的表面化学结构的变化用FTIR检测,采用Origin 8.5对所得数据加以拟,结果见图5。LB-1降解后的PE膜FTIR检测结果在1 734 cm-1处有吸收峰出现,且此处峰值是由羰基(-C=O-)的伸缩振动引起的,而对照组则没有,羰基的出现证明PE表面的官能团被氧化,这进一步证明了LB-1可以降解PE。
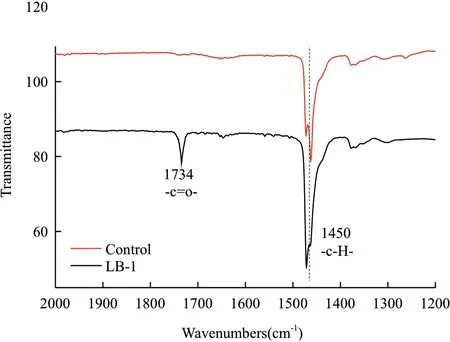
图5 LB-1降解前后的PE的FTIR谱图
2.6 PE失重率的检测
测定PE被降解前后的质量变化可以得知微生物对PE的降解率,结果见图6。PE在LB-1降解10 d、30 d和60 d期间的失重率分别为1.55%、4.24%和12.17%,且失重率随LB-1降解PE时间的增加而逐渐增大,对照组则无重量损失,直观上说明LB-1具有降解PE的作用。

图6 PE片被LB-1降解60 d期间的失重率变化
2.7 可溶性产物的检测
通过气质联用仪的检测 LB-1降解PE膜 60 d后的可溶性降解产物,图7为LB-1降解PE的可溶性产物GC-MS色谱图。根据色谱及质谱图中的特征峰和标准谱图库进行比对,确认每个特征峰对应的物质。结果(表2)显示在保留时为4-7 min的峰值对应的化合物有C7H8、C6H14O3、C6H14O5、C10H20O2、C8H14OS、C4H7NO2和C8H10,这些化合物为小分子烷烃,而在50.318 min、56.014 min的峰值对应的化合物分别为C30H42Cl2N4O3和C19H34O3,C30H42Cl2N4O3。这些化合物中都含有酰胺键和碳碳双键,而C19H34O3中还含有酯键。这表明PE 被LB-1降解的过程中有酰胺类,有机酸等物质的产生,进而说明PE在 LB-1 的处理下被氧化还原为分子量不同大小的物质。

图7 LB-1可溶性产物的GC-MS色谱图

表2 质谱检测分析对应化合物
3 讨论
利用微生物降解聚乙烯是一种潜力极大的方法,具有成本低、环境友好等优点。目前发现的可降解塑料的微生物主要是真菌和细菌,可降解几十到几万分子量的PE[12]。已发现的能够降解聚乙烯的细菌有假单胞菌(Pseudomonas.spp)、蜡样芽孢杆菌(Bacillus cereus)、玫瑰红红球菌(Rhodococcus rhodochrous)、醋 酸 钙 不 动 杆 菌(Acinetobacter calcoaceticus)和微杆菌属(Microbacterium phyllosphaerae)等[12]。Yang等[13]分离得到2株能够降解PE的菌株,并鉴定它们分别是Enterobacter asburiaeYT1和Bacillussp. YP1。YT1和YP1在60 d内能够分别降解PE膜(100 mg)约6.1±0.3%和10.7±0.2%。而本实验中,LB-1在60 d内能够降解PE膜(200 mg)约为12.17%。失重率的变化表明随着塑料被菌株降解时间的增长,其被降解的速度增加,推测原因有3点:(1)SEM分析表明被降解的PE薄膜表面坑洞增多,PE膜表面粗糙程度增大,更利于LB-1附着。(2)PE膜上出现亲水性基团羰基-C=O-,使得PE薄膜表面亲水性增加,使LB-1更容易附着在上面。(3)酰胺基和羧基均可作为表面活性剂的亲水基团,酰胺类和有机酸等可溶性产物的出现,意味着降解产物中可能含有作为表面活性剂促进LB-1附着在PE膜上的物质。而Vimala等[14]在实验中发现在培养基中加入表面活性剂和紫外光照射可以使塑料降解速度加快也佐证了这个猜想。
目前大部分商用塑料制品被认为不可生物降解或者需要数十年才能降解。尽管有些文献报道了通过细菌培养物可以对PE进行生物降解,但PE生物降解的有效证据仍然有限,而本实验为PE的生物降解提供了新的证据。但是微生物降解聚乙烯的机理还未明确[15]。Fujisawa等[16]认为漆酶是降解PE的关键酶;Sowmya等[17]的研究中认为PE降解的关键酶是锰过氧化物酶以及哈茨木霉分泌的漆酶;冯静等[12]利用基因克隆技术证明漆酶是白浅灰链霉菌降解PE的关键酶;姚学峰和宋怡铃利用Auto dock技术对MnP酶进行了功能预测,分析显示此酶仅能催化C56以下的PE,同时碳链越长,酶和底物的结合越不稳定[18]。在LB-1降解塑料中有一系列疑似表面活性剂的产物,其产生机理,对LB-1在薄膜上的附着的作用,以及是否有可能稳定酶与PE的结合都需要后续实验的进一步探讨。综上所述,本实验为PE降解塑料的机理和塑料污染问题的解决都提供了一个新的思路。
4 结论
本研究从Plodia interpunctella的幼虫肠道中分离出了细菌LB-1,经分子生物学鉴定方法鉴定为霍氏肠杆菌(Enterobacter hormaechei)。经LB-1降解后的PE膜的表面疏水性变小、表面形貌发生变化、表面被氧化产生-C=O-官能团、被降解后的 PE膜重量的损失及其可溶性产物的产生证明了LB-1可以降解PE。
