生产禽流感病毒的悬浮MDCK细胞稳定性的研究
2020-11-02白春丽叶倩姬阿美刘旭平2张旭刘志亮朱明龙赵亮
白春丽 叶倩 姬阿美 刘旭平,2张旭 刘志亮 朱明龙 赵亮
谭文松1,2(1. 华东理工大学生物反应器工程国家重点实验室,上海 200237;2. 上海倍谙基生物科技有限公司,上海 201203;3. 山东信得动物疫苗有限公司,潍坊 262204)
犬肾上皮细胞(Madin-Darby canine kidney cells,MDCK)由于其对流感病毒敏感性高,成为流感疫苗生产的最佳宿主之一[1]。自1995年WHO呼吁采用哺乳动物细胞进行流感疫苗生产以来[2],基于MDCK生产流感疫苗的研究不断深入。但连续细胞系在体外长期培养过程中往往会因为操作者习惯或培养基营养成分等因素而累积一些选择性压力,改变细胞的某些特征属性[3-4]。因此,为保证疫苗生产的稳定性和可重复性,不断有学者对贴壁MDCK细胞传代过程中的特性进行研究,包括细胞形态[5]、跨膜电阻[6]、细胞生长[7]、产毒情况[8-9]等,发现不同代次MDCK细胞之间存在不同程度的差异。
然而,贴壁细胞培养模式操作繁琐且需要添加血清,而血清却存在成本较高、批次间质量不稳定、不利于下游纯化等问题。相比之下,不需要添加血清的无血清悬浮培养工艺则更具生产优势,基于悬浮培养体系的疫苗生产工艺也逐渐成为主流。在近年就已有Novartis、Seqirus、SK Chemicals等公司凭借悬浮MDCK细胞所生产的流感疫苗被批准上市[10]。然而,目前对于流感疫苗生产所用的悬浮MDCK细胞传代稳定性的研究却极少。
此外,不同文献报道的驯化MDCK细胞所用培养基也有所不同,驯化成功的悬浮MDCK细胞的生长与产毒能力等也均存在一定差异。Wang等[11]使用悬浮MDCK细胞所产H9N2病毒的产量有210,李自良等[12]的悬浮MDCK细胞所产H1N1病毒滴度可达26-7,吴培培等[13]驯化所得悬浮MDCK细胞生产H9亚型产量为29。而本研究所用悬浮MDCK细胞在特定生产条件下H9N2流感病毒产量最高可达214,是目前生产甲型流感病毒报道中产量最高的宿主细胞[14]。高产的悬浮MDCK细胞在生产中很受欢迎,但细胞的高产特性是否可以稳定维持,需要进一步进行探索。
为此,本研究以实验室保存的一株高产MDCK悬浮细胞为研究对象,采用实验室自主研发的无血清培养基对其进行长达200多天的传代培养,考察不同培养代次细胞在生长和H9N2病毒生产能力方面的差异,并对产毒差异的原因进行探究,以表征悬浮MDCK细胞在长期传代中细胞生长与生产的稳定性,旨为基于悬浮MDCK细胞进行流感疫苗生产的工艺稳定性奠定数据基础。
1 材料与方法
1.1 材料
1.1.1 细胞株与病毒株 MDCK悬浮细胞由购自美国菌种保藏中心的贴壁细胞(CCL-34)驯化所得。甲型流感病毒株A/chicken/Guangxi/SIC6/2013(H9N2)为肇庆大华农生物药品有限公司惠赠,在MDCK悬浮细胞中传代适应,收获后的毒株作为本实验种毒,其半数组织培养感染剂量(50% tissue culture infective dose,TCID50)为8.50 Log10TCID50/mL。
1.1.2 主要试剂与仪器 Driving-M SF002 MDCK无血清悬浮培养基为实验室自主研发,用于悬浮MDCK细胞传代培养以及病毒感染实验。50 mL培养管购自瑞士TPP AG公司,125 mL摇瓶购自美国Corning公司。细胞周期与细胞凋亡检测试剂盒、活性氧检测试剂盒均购自碧云天,借助流式细胞仪(Beckman,USA)检测。酶标仪购自北京普朗;自动细胞计数仪购自Invitrogen公司;离心机购自Beckman Coulter公司。
1.2 方法
1.2.1 悬浮MDCK细胞传代培养 将处于指数生长期的悬浮MDCK细胞以1×106cells/mL左右的密度接种于50 mL的培养管中,装液量20 mL,置于37℃、5% CO2、220 r/min培养箱中培养,每2 d传代一次,即采用新鲜培养基将细胞液稀释至1×106cells/mL。将该悬浮MDCK细胞进行长达200 d以上传代培养,并冻存不同代次细胞(P1、P29、P63、P88、P111)以便于后续细胞生长以及病毒生产能力差异分析。
1.2.2 细胞传代稳定性差异分析 同时复苏1.2.1中各代次细胞,待细胞生长稳定后,进行为期14 d的传代培养,实验方法同1.2.1,对比分析传代过程中各代次细胞的细胞形态、比生长速率以及细胞直径等差异。
1.2.3 批培养过程细胞稳定性研究 取处于指数生长期的P1、P29、P63、P88、P111这5个代次悬浮MDCK细胞,经1 000 r/min离心5 min后弃去上清,再用25 mL新鲜培养基重悬于50 mL培养管中,初始细胞密度为0.5×106cells/mL左右,置于37℃、5%CO2、220 r/min培养箱中进行为期9 d的批培养。
1.2.4 各代次细胞流感病毒生产能力变化 分别取P1、P29、P88、P111悬浮MDCK细胞进行实验。在活细胞密度达到(10-12)×106cells/mL时,按新鲜培养基与细胞液体积比为1∶1稀释细胞液,接种于125 mL摇瓶,装液量30 mL,感染复数(Multiplicity of infection,MOI)为0.01,TPCK-胰酶添加浓度为5 μg/mL,置于37℃、5% CO2培养箱中培养,摇床转速为130 r/min。
1.2.5 培养基稀释比例对高低代次悬浮MDCK细胞产毒差异的影响 P1、P111细胞生长至(10-12)×106cells/mL时,在125 mL摇瓶中使用新鲜培养基对细胞液进行稀释,工作体积为30 mL,其新鲜培养基所占比例分为100%(全离心换液),67%,50%和33%,MOI为0.01,TPCK-胰 酶 添 加 浓 度 为5 μg/mL,置于37℃、5% CO2培养箱中培养,摇床转速为130 r/min。
1.2.6 MOI对高低代次悬浮MDCK细胞产毒差异的影响 取细胞密度为(10-12)×106cells/mL的P1、P111细胞悬液,经1 000 r/min离心5 min后弃去上清,使用新鲜培养基重悬,以(5.5-6)×106cells/mL活细胞密度接种于125 mL摇瓶,装液量30 mL。在感染复数(Multiplicity of infection,MOI)为1、0.1、0.01、0.001,TPCK-胰酶添加浓度为5 μg/mL条件下研究P1、P111产毒能力差异。摇瓶置于37℃、5% CO2培养箱中,摇床转速为130 r/min。
1.2.7 同步病毒感染过程中ROS差异分析 为探究高低代次悬浮MDCK细胞在病毒感染后胞内活性氧(Reactive oxygen species,ROS)的区别,以MOI为10进行病毒感染,在保证大量细胞同时被病毒感染的情况下进行胞内ROS水平检测。具体操作如下:取细胞密度为(10-12)×106cells/mL的P1、P111细胞悬液,1 000 r/min、5 min离心后使用新鲜培养基重悬。初始细胞密度为6×106cells/mL左右,125 mL摇瓶中装液量30 mL,MOI为10,TPCK-胰酶浓度为5 μg/mL,摇瓶置于37℃、5% CO2培养箱中孵育1 h,摇床转速为130 r/min,后离心去上清,使用PBS洗涤去除多余的病毒以及TPCK-胰酶,后离心去上清,并再次使用新鲜培养基重悬,置于37℃培养箱中培养。取0 hpi、6 hpi的细胞液进行胞内ROS水平检测,依据活性氧检测试剂盒的操作方法进行操作。
1.2.8 流感病毒感染前细胞周期检测 待P1、P111细胞生长至(10-12)×106cells/mL,依据细胞周期与细胞凋亡检测试剂盒的操作方法,对P1、P111细胞的周期分布进行检测。
1.2.9 病毒滴度检测 使用鸡红细胞悬液(2×107cells/mL)进行血凝实验测定总病毒颗粒浓度[15],病毒滴度单位为Log2HAU/100 μL。单细胞产毒率(svy)的计算方法参考文献[14],其单位为virions/cell。
1.2.10 统计学分析 实验结果采用t检验进行统计学分析,P<0.05表示实验结果存在显著性差异(*:P<0.05;**:P<0.01;***:P<0.001)。
2 结果
2.1 悬浮MDCK细胞生长稳定性研究
2.1.1 不同代次细胞形态差异 对各代次细胞进行传代培养,其细胞形态如图1所示。结果显示,各代次细胞形态良好,表面光滑圆润,均以大小均一的球形单细胞形式存在,无明显结团。这表明,在实验范围内悬浮MDCK长期传代培养中细胞形态维持不变。
2.1.2 不同代次细胞的传代稳定性 为研究悬浮MDCK细胞长期传代的稳定性,选择P1、P29、P63、P88、P111细胞进行传代实验,考察各代次细胞传代生长差异,结果见图2。结果显示,在多次传代过程中,各代次细胞的细胞密度、细胞直径均维持在稳定水平,比生长速率维持在(0.98-1.10)/d,各代次细胞之间无显著性差异(P>0.05)。这些结果表明,该悬浮MDCK细胞在实验范围内传代稳定性良好。

图1 各代次悬浮MDCK细胞的形态
2.1.3 不同代次细胞的批培养稳定性 为考察各代次细胞在有限营养环境中的生长能力,将各代次细胞进行为期9 d批培养实验,结果见图3。结果显示,在此过程中各代次细胞的活细胞密度、细胞活率、比生长速率变化趋势相似,且均在第5天达到最高活细胞密度(VCDmax),并未出现随细胞代次增加VCDmax增加或降低的趋势,各代次细胞VCDmax平均值为(14.87±0.44)×106cells/mL。这表明,在实验范围内P1至P111悬浮MDCK细胞批培养生长能力相似,MDCK细胞批培养稳定性良好。
2.2 不同代次细胞流感病毒生产能力差异
将各代次细胞以培养基与细胞液体积比为1∶1的常规工艺稀释接毒,考察长时间传代后悬浮MDCK细胞产毒能力的变化情况。结果显示(图4),各代次细胞接种流感病毒后48 hpi内HA滴度不断增加,随后趋于稳定。对比P1、P111病毒产量,24 hpi与48 hpi两代次存在显著性差异(P<0.05),其 中P111最 高 滴 度(HAmax)为(13.02±0.18)Log2HAU/100 μL,较P1细胞(12.52±0.02)Log2HAU/100 μL提高了0.47 Log2HAU/100 μL,其他代次细胞(P29、P88)HAmax处于P1与P111两代次细胞之间。为去除细胞密度的影响,进一步计算了单细胞产毒率(svy),结果显示svy变化趋势与HA滴度相似,在每个取样点P111细胞svy均高于P1细胞。上述结果表明,在实验传代过程中,细胞的病毒生产能力呈提高趋势。
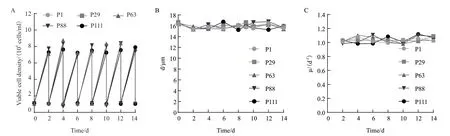
图2 各代次悬浮MDCK细胞传代过程中活细胞密度(A),细胞直径(B)以及比生长速率(C)变化

图3 各代次悬浮MDCK细胞批培养过程中活细胞密度(A),细胞活率(B)以及比生长速率(C)变化
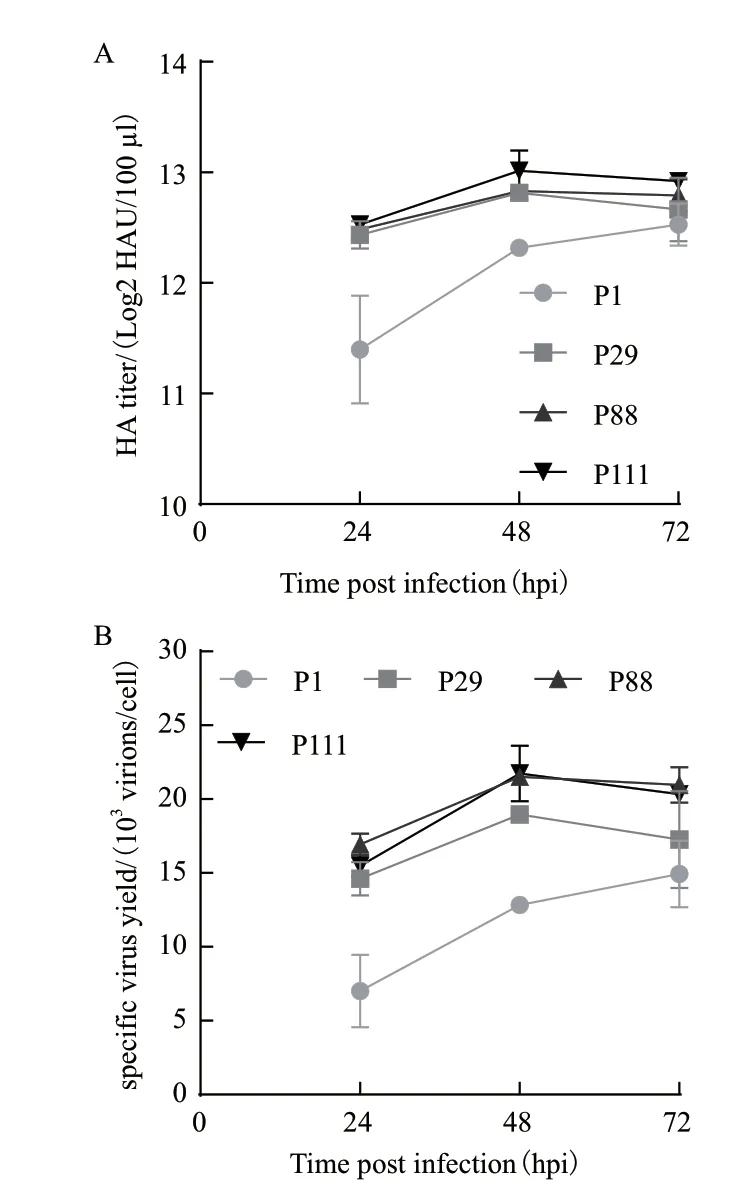
图4 各代次悬浮MDCK细胞流感病毒HA滴度(A)与单细胞产毒率(B)随时间变化
2.3 不同生产工艺下高低代次细胞产毒情况验证
2.3.1 培养基稀释比例对高低代次细胞产毒差异的影响 病毒生产阶段与细胞生长阶段的物质能量需求有所不同,有利的营养物浓度配比更能促进病毒复制,不同新鲜培养基与细胞液的体积比可以改变细胞的物质代谢方向,是病毒生产过程中经常需要考察的工艺条件。
为验证不同代次细胞产毒差异情况是否受细胞液稀释比例的影响,本实验将P1、P111细胞作为研究对象,考察高低代次细胞在不同稀释比例下的最高病毒产量(HAmax与svymax)。由图5可见,新鲜培养基比例越高,HAmax与svymax越高,说明营养物质越充足越有利于此悬浮MDCK细胞的病毒生产。另外,对比P1、P111细胞产量发现,每个稀释比例条件下,P111细胞HAmax与svymax均高于P1细胞,分别高约(0.57-1.09)Log2HAU/100 μL、(5.65-15.78)×103virions/cell。表明在此实验条件中,相同稀释比例条件下细胞代次越高越利于病毒生产。
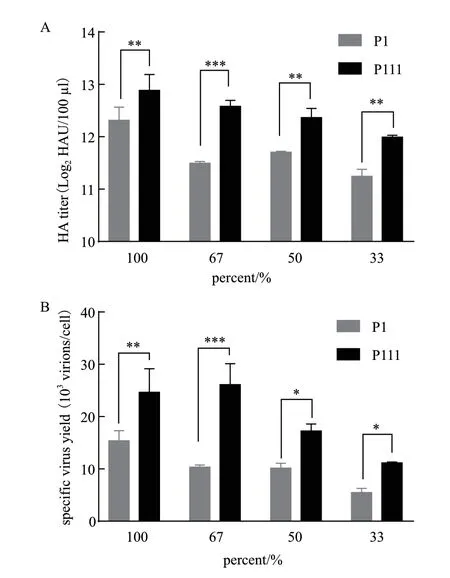
图5 不同稀释比例下高低代次悬浮MDCK细胞所产流感病毒最高HA滴度(A)与最高单细胞产毒率(B)
2.3.2 不同MOI对高低代次细胞产毒差异的影响 MOI指病毒数与细胞数的比值,MOI对病毒的生产有极大的影响,不同细胞在特定产毒环境下最适MOI也有所不同。本研究通过设置不同MOI条件进行病毒感染以探究高低代次细胞的病毒生产情况。结果(图6)发现,不同MOI条件下HA与svy均在48 hpi达到最高,对比各MOI条件下病毒生产情况发现,MOI越低,HAmax与svymax越高。对比P1、P111细胞产量发现,无论在何种MOI条件下,在每个取样点P111细胞HA以及svy依旧普遍高于P1细胞。进一步确定在实验MOI范围内,悬浮MDCK细胞代次越高越利于病毒的生产。
2.4 细胞产毒差异作用机制初探

图6 不同MOI下悬浮MDCK细胞生产流感病毒HA滴度与单细胞产毒率随感染时间的变化
2.4.1 同步感染复制过程中高低代次细胞ROS水平差异 ROS为含氧的化学反应性物质,病毒感染会诱导宿主细胞生成ROS促进病毒RNP出核运输等过程[16],但ROS过高对细胞有毒害作用[17]。为探究ROS对高低代次产毒的影响,本实验检测了同步感染流感病毒条件下P1、P111胞内ROS变化情况,结果见图7。在此条件下P111细胞的HA与svy依然高于P1细胞。以0 hpi的P1所测ROS含量作为对照,发现P111细胞的初始ROS水平低于P1细胞。病毒感染后,0-6 hpi内ROS含量呈现上升趋势,6 hpi 时P1、P111细胞ROS含量分别上升至0 hpi的2.28、4.03倍,虽然P111细胞上升幅度较大,但6 hpi的 P111的ROS含量依然低于P1细胞。说明P111细胞在病毒感染初期始终维持较低水平ROS。
2.4.2 病毒感染前高低代次细胞周期分布 在上述2.3.2中发现24 hpi下P111细胞始终维持高产,为确定是否P111细胞在接毒前处于更利于病毒生产的细胞状态,检测了病毒感染前P1、P111的细胞周期分布情况。结果(表1)显示,P111细胞具有较高比例G0/G1期的细胞群体,约高于P1细胞10%(P<0.01)。
3 讨论

图7 产毒期P1与P111的胞内ROS水平

表1 病毒感染前P1与P111的细胞周期分布
悬浮MDCK细胞凭借着对流感病毒的高敏感性且易于规模放大等优势,已逐渐成为工业上用于流感疫苗生产的主流宿主细胞。在培养过程中各种因素均会导致细胞的特性变化,最终影响病毒增殖效率,但目前关于悬浮MDCK细胞稳定性的研究鲜有报道。本研究主要对不同代次悬浮MDCK细胞的生物学特性进行研究,包括细胞形态、生长特性、产毒情况、ROS以及细胞周期等,为基于悬浮MDCK细胞培养生产流感疫苗的工艺稳定性奠定基础。
初步实验表明,不同代次细胞在传代过程与批培养过程中细胞生长均未表现出显著性差异,与前人贴壁MDCK细胞生长研究结果类似[7],并且细胞形态相似。此外,李自良等[12]将贴壁MDCK细胞驯化成功后,发现相差20代的悬浮MDCK细胞的生长稳定性较好,虽与本研究结果相似,但本文细胞代次差距达110代,更能说明悬浮MDCK细胞生长稳定性。在各代次细胞病毒生产过程中,随着细胞代次的增加病毒产量有增加趋势,与前人贴壁MDCK细胞产毒结果相反[8]。说明长期传代后悬浮MDCK细胞的变化情况并不完全符合贴壁细胞变化规律,故而针对悬浮MDCK细胞进行稳定性研究,在动物细胞悬浮工艺生产流感疫苗中更具应用价值。
随后,在不同稀释比例以及不同MOI工艺参数条件下进行接毒实验,验证病毒产量随细胞代次的变化情况,发现P111细胞的产量始终高于P1细胞,说明改变维持培养基营养物浓度和MOI这两个外部条件均不可改变P111细胞的高产结果,进一步确定P111细胞的某些特性已经发生变化并导致病毒产量提高。为初步探索P111细胞高产原因,在检测ROS水平与细胞周期分布时发现P111细胞与P1细胞存在较大差异,相比于P1细胞,P111细胞的ROS水平较低、G0/G1期分布的细胞比例较高。
ROS是病毒感染复制过程中的一把双刃剑,过高的ROS会导致细胞的凋亡[17],破坏病毒复制的宿主环境;但抑制ROS生成又会阻碍病毒核糖核蛋白(RNP)的出核运输,降低病毒产量[16]。本研究发现病毒感染后,胞内ROS水平会增加,与文献报道相似[18],病毒感染通过促使细胞ROS增多进而引发氧化应激反应,促进病毒增殖。但P111胞内ROS水平在0-6 hpi始终低于P1细胞。有研究发现降低ROS含量,可以缓解线粒体损伤,挽救细胞凋亡[16],保持低水平ROS的P111细胞也许可以更好地维持细胞生理机能,从而为病毒复制提供更多中间代谢物。也有文献报道低水平的ROS会介导细胞进入G0/G1期[19],与本研究现象一致。有文献报道G0/G1期细胞的膜刚性较差[20],提高G0/G1期细胞分布,有利于病毒进入宿主细胞,并且G0/G1期的RNA聚合酶(Pol II)与帽结合蛋白活性较高,有利于病毒基因组的转录以及帽结构依赖性翻译[21]。可见,P111细胞在病毒感染过程中ROS的生成并未受到抑制,但始终保持低水平ROS,为病毒的复制提供良好的宿主环境;同时G0/G1期细胞分布较高,促进了感染前期病毒进入宿主细胞以及病毒基因组的转录与翻译,从而缩短了病毒复制周期,提高病毒产量。
4 结论
本研究使用实验室自主研发培养基对实验室已有悬浮MDCK细胞进行长达200多天的传代培养,该细胞的细胞形态与生长能力并未发生显著变化,但病毒产量有所提高。分析发现高代次悬浮MDCK细胞中ROS低水平、G0/G1期高分布的细胞群体含量有所提高,该细胞经过长期传代后很可能是通过提供病毒良好的复制环境并缩短病毒复制周期,最终使流感病毒产量增加。
