钠-葡萄糖协同转运蛋白2抑制剂治疗2型糖尿病合并非酒精性脂肪性肝病有效性和安全性的Meta分析
2020-11-02李晓静孙元隆张彬彬梅祖兵胡义扬
李晓静, 孙元隆, 张彬彬, 梅祖兵, 冯 琴, 胡义扬
上海中医药大学附属曙光医院 a.肝病研究所; b.肛肠科, 上海 201203
非酒精性脂肪性肝病(NAFLD)是以肝脏脂肪变性、炎症和不同程度肝纤维化为特征的一系列肝脏疾病,包含非酒精性单纯性肝脂肪变、非酒精性脂肪性肝炎、肝硬化和相关性肝细胞癌。NAFLD在2型糖尿病(type 2 diabetes mellitus,T2DM)患者中的发病率是普通人群的3倍,可高达50%[1]。T2DM增加了NAFLD患者肝病相关病死率和全因死亡率的危险,同时,NAFLD也加重了T2DM患者的血糖血脂异常,增加心脑血管及外周血管事件。因此,预防和治疗T2DM合并NAFLD已成为健康管理中新的目标。
目前尚缺乏治疗NAFLD的特效药,有动物实验[2]发现,钠-葡萄糖协同转运蛋白2(sodium-glucose co-transporter 2,SGLT2)抑制剂不仅能通过减少近端肾小管对葡萄糖的重吸收增加尿糖排泄,从而降低血糖;还有改善胰岛素抵抗、抗炎、降低肝脏脂肪合成和促进脂肪分解的作用。一些临床研究虽评估了SGLT2抑制剂对T2DM合并NAFLD的疗效,但目前尚无循证医学证据。因此,本研究对SGLT2抑制剂治疗T2DM合并NAFLD的有效性和安全性进行了系统评价,为临床治疗T2DM合并NAFLD的治疗用药提供循证医学依据。
1 资料与方法
1.1 检索策略 计算机检索外文数据库PubMed、Cohrane Library、Embase;中文数据库中国知网、维普数据库、万方数据库。文献发表类型与语种不限。中文检索词为:钠-葡萄糖协同转运蛋白2抑制、SGLT2抑制剂、坎格列净、达格列净、恩格列净、伊格列净、非酒精性脂肪性肝病、非酒精性脂肪性肝炎、脂肪肝、2型糖尿病。英文检索词为: SGLT-2 inhibitors、Sodium glucose cotransporter-2 inhibitors、Canagliflozin、Dapagliflozin、Empagliflozin、Ipragliflozin、Diabetes type 2、Diabetes mellitus type 2、Type 2 diabetes、NAFLD、Nonalcoholic fatty liver disease、NASH、Nonalcoholic steatohepatitis。检索时间截至2020年3月。
1.2 文献纳入标准 (1)临床随机对照试验(RCT)、前瞻性队列研究、回顾性队列研究。(2)T2DM诊断标准参照2006年WHO诊断标准:空腹血糖(FBG)≥7.0 mmol/L和/或餐后2 h血糖≥11.1 mmol/L;NAFLD诊断标准:参照《非酒精性脂肪肝病诊疗指南(2010年修订版)》,有基线数据;(3)观察指标为:血清ALT、糖化血红蛋白(HbA1c)水平。次要观察指标为:BMI、脂肪重量(FM)、FBG、血清AST和GGT、血清铁蛋白(Ferritin)、肝脏脂肪分数(HFF)、Fibrosis4指数、血清Ⅳ型胶原蛋白7S以及SGLT2抑制剂不良反应。
1.3 文献排除标准 研究对象伴随使用治疗NAFLD药物如吡格列酮、维生素E、GLP-1受体激动剂、奥贝胆酸、cenicriviroc、索利霉素、奥利司他等;患有除NAFLD外的慢性肝脏疾病如酒精性脂肪性肝病、慢性乙型肝炎、慢性丙型肝炎、肝硬化、原发性肝癌等;孕妇及哺乳期妇女;恶性肿瘤患者;试验设计不合理、统计方法不恰当;重复发表或数据不详的文献。
1.4 文献筛选与文献质量评估 由两名独立研究者检索所需文献并进行筛选,排除不相关文献,剩余文献进行全文阅读并进一步排除不符合纳入标准的文献。如筛选意见不统一,需第三位研究者共同商议并达成共识。文献描述不明确或缺失数据,与原作者联系后予以补充,若最终数据不能完善,则予以排除。采用Cochrane Handbook 5.0风险评估表和非随机对照实验方法学评价指标(Methodological Index for Non-randomized Studies, MINORS)量表分别对纳入RCT研究文献及队列研究文献的质量和真实性进行评价。若文献质量低劣,则予以排除。
1.5 统计学方法 运用RevMan 5.3和Stata 15.0软件进行Meta分析。计量资料选择均数差(MD)和标准化均数差(SMD)及其95%CI表示。计数资料以风险比(RR)及其95%CI表示。研究结果之间的异质性采用χ2检验和I2检验进行评估。若I2<50%,P≥0.1认为各研究间异质性可接受,使用固定效应模型进行分析;反之则认为各研究间有显著异质性,使用随机效应模型进行分析。对异质性显著的研究应用RevMan 5.3软件进行亚组分析予以消除;若异质性原因不明,不能进行合并分析时,采用敏感性分析。发表偏倚的风险通过漏斗图进行判断。
2 结果
2.1 文献检索 共检索得136篇文献,经过逐层筛选,最终纳入14篇文献,其中队列研究9篇(表1),RCT研究5篇(表2)。文献筛选流程结果见图1。
2.2 纳入文献的质量评价
2.2.1 队列研究文献的方法学质量评价 采用MINORS量表进行风险偏倚评估,质量评价结果见表3,文献质量中等偏上。

表1 纳入队列研究文献的基本特征
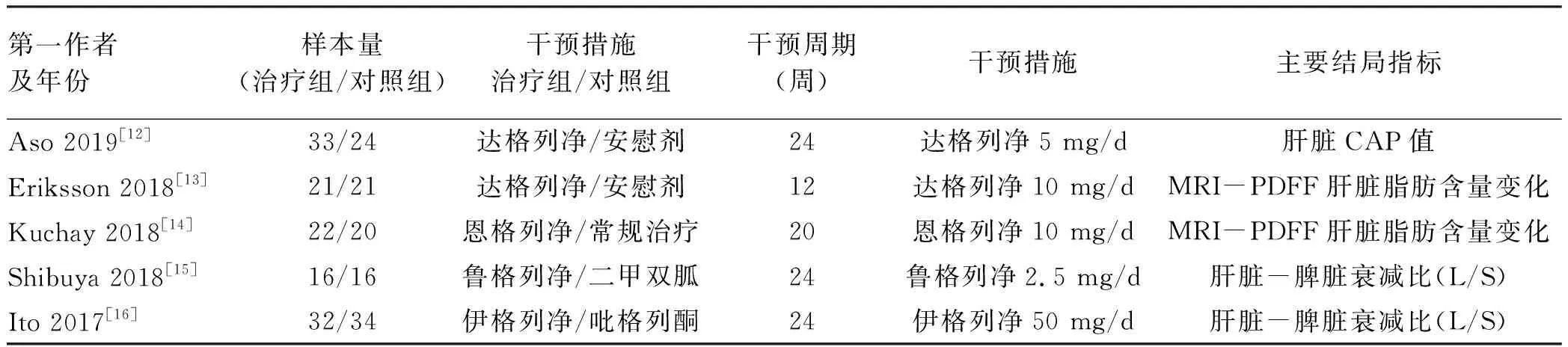
表2 纳入的RCT研究文献的基本特征

表3 纳入的队列研究文献的方法学质量评价
2.2.2 RCT文献质量评价 采用Cochrane Handbook 5.0进行风险偏倚的评估,并绘制如下偏倚风险比例图(图2)。其中4篇文献[12-15]采取随机分组,3篇文献[12-14]运用计算机生成的随机数字分组,1篇文献[15]运用抽签法。所有研究均未提及采用分配隐藏。1项研究[13]采用双盲安慰剂对照研究。2项研究[12-13]有受试者因不良反应退出情况。未见有不完全数据和选择性报道。2项研究[13,15]未见其他偏倚,3项研究[11-12,14]不清楚是否存在偏倚。纳入文献质量中上。
2.3 主要观察指标Meta分析结果
2.3.1 队列研究ALT 共纳入11项研究[3-11]进行患者ALT水平评价,各研究间存在明显异质性(P=0.006,I2=60%),故采用随机效应模型进行Meta分析。结果显示合并后MD=-24.22,95%CI:-29.54~-18.89,P<0.001,差异有统计学意义,表明SGLT2抑制剂可降低T2DM合并NAFLD 的患者ALT水平。
根据研究类型的不同,将11项研究分为前瞻性队列研究和回顾性队列研究进行亚组分析,结果显示,前瞻性队列7项研究[3-8],各研究间存在明显异质性(P=0.009,I2=65%),敏感性分析去掉异质性较大的两项研究[5,7]后,各研究间不存在异质性(P=0.69,I2=0),采用固定效应模型分析,合并后MD=-30.19,95%CI:-33.47~-26.90,P<0.001。4项回顾性队列研究[9-11]不存在异质性(P=0.43,I2=0),采用固定效应模型分析,结果显示MD=-22.23,95%CI:-25.96~-18.50,P<0.001,两组差异均有统计学意义。经敏感性分析排除的两项研究对于整体异质性并无明显影响,仅对前瞻性队列研究结果的异质性有明显影响。鉴于敏感性分析后两亚组内无明显异质性,但两个亚组间差异显著(P=0.002,I2=89.8%),且前瞻性队列研究偏倚比回顾性队列研究的偏倚小,因此认为研究方法导致的结果偏倚可能是异质性的主要来源(图3)。
2.3.2 队列研究HbA1c 共纳入11项研究[3-11],11项研究间存在明显异质性(P<0.001,I2=84%),队列研究经研究方法的亚组分析(P=0.14,I2=54.5%)、敏感性分析均未能发现引起异质性来源的原因,考虑到受试对象通常在试验前服用其他降糖药进行血糖控制,其异质性可能与HbA1c基线水平的差异有关,故采用随机效应模型进行Meta分析。结果显示合并MD=-0.54,95%CI:-0.76~-0.33,P<0.001,差异有统计学意义,表明SGLT2抑制剂可降低T2DM合并NAFLD患者的HbA1c水平(图4)。
2.3.3 RCT研究ALT 共纳入4项研究[12,14-16],4项研究间存在明显异质性(P<0.001,I2=90%),敏感性分析将以吡格列酮作为对照用药的Ito等[16]研究排除后,各研究间不存在异质性(P=0.82,I2=0),采用固定效应模型进行Meta分析。结果显示合并后MD=-12.51,95%CI:-15.61~-9.41,P<0.001,差异具有统计学意义,表明SGLT2抑制剂可降低T2DM合并NAFLD 的患者ALT(图5)。
2.3.4 RCT研究HbA1c 共纳入5项研究[12-16],5项研究间存在异质性(P<0.001,I2=99%),排除对照组为分别接受吡格列酮[13]、2型糖尿病标准治疗[14]、二甲双胍[15]的3项研究后,各研究间不存在异质性(P=0.97,I2=0),采用固定效应模型进行。结果显示合并MD=-0.54,95%CI:-0.80~-0.27,P<0.001,差异有统计学意义,认为SGLT2抑制剂可降低T2DM合并NAFLD 的患者的HbA1c水平。但是鉴于纳入研究数量较少,结果可能存在偏倚(图6)。
2.4 次要观察指标Meta分析结果 次要观察指标BMI、AST、GGT、FM、FBG、Ferritin、HFF、血清Ⅳ型胶原蛋白7S及 Fibrosis4指数的Meta分析具体结果见表4。
2.5 安全性评价
2.5.1 SGLT2抑制剂的不良反应 其中有10篇文献描述了药物的不良反应,详见表5。最常见的不良反应是泌尿生殖器感染以及由于排尿量增加引起的口渴、低血压、脱水等体液量减少事件。
2.5.2 不良事件发生率 纳入Meta分析的不良事件在各项研究间均无异质性(I2值均<50%,P值均≥0.1),故均采用了固定效应模型。结果显示:(1)体液量减少事件:SGLT2抑制剂明显增加患者夜尿、口渴、脱水的发生率(P<0.05);(2)尿路感染事件:SGLT2抑制剂明显增加患者尿路感染事件发生率(P<0.05);(3)生殖系统感染事件:SGLT2抑制剂明显增加患者生殖系统感染事件发生率(P<0.05)。

表4 次要观察指标Meta分析结果

表5 SGLT2抑制剂的不良反应

表6 不良事件发生率
2.6 发表偏倚 针对ALT这一结局指标绘制漏斗图进行发表偏倚检验,显示各研究点左右对称(图7),结合前瞻性队列研究Egger’s检验结果(95%CI:-11.73~1.71,P=0.114),认为纳入的前瞻性研究可能不存在发表偏倚。鉴于回顾性队列研究和RCT纳入的文献数量较少,故逐个剔除纳入文献观察结果的变化,发现重新分析的结果不变,认为研究结果具有较高稳定性。
3 讨论
SGLT2是一种分布在近端肾小管上的具有低亲和力、高容量特征的跨膜转运蛋白,将约90%滤过的葡萄糖重新吸收。SGLT2抑制剂作为治疗T2DM较为成熟的药物,通过抑制葡萄糖重吸收,增加尿糖排泄从而降低血糖[2]。有研究[17]报道SGLT2抑制剂对NAFLD有一定改善作用,有望成为治疗NAFLD的新选择。其可能的机制有:SGLT2抑制剂可以改善肝脏脂质堆积,直接改善肝脏脂肪变性[18];降低血清可溶性二肽基肽酶-4,改善肝脏中脂肪组织的炎症和胰岛素抵抗[12];降低肝细胞内促炎因子、抗氧化应激[19]及降低与纤维化水平密切相关的铁组织储存蛋白含量,抑制肝星状细胞活化的mRNA表达[20]等。如今SGLT2抑制剂在临床广泛使用,坎格列净、恩格列净及达格列净分别通过美国、欧洲和日本的药监局上市,在中国已经上市的有达格列净和恩格列净[21]。
血清转氨酶是评价肝细胞损伤的敏感指标,且ALT主要存在于肝细胞中,故本研究以ALT作为评价SGLT2抑制剂药效的主要观察指标之一。队列研究和RCT研究的Meta分析结果显示SGLT2抑制剂可以明显降低T2DM合并NAFLD患者的ALT水平,可见SGLT2抑制剂对NAFLD患者肝细胞保护的确切作用。但是队列研究和RCT研究的系统评价ALT结果MD存在一定差异,这可能与队列研究使用的不同SGLT2抑制剂、纳入的RCT数量和样本量较少有关。
HbA1c是糖尿病患者评价长期血糖控制水平的指标,也是指导临床用药方案的重要参考依据。故将其作为评价SGLT2抑制剂药效的另一个主要观察指标。本Meta分析结果表明SGLT2抑制剂较基线期相比可显著降低患者HbA1c水平。鉴于纳入的研究数量仅为两篇,故可能存在偏倚。但对照组分别为接受吡格列酮[13]、T2DM标准治疗[14]、二甲双胍[15]的3项RCT研究的Meta分析显示SGLT2抑制剂与其他降糖药的降低HbA1c效果相同(P=0.65)。这与既往研究[22]结果一致,SGLT2抑制剂、二肽基肽酶4抑制剂及二甲双胍的降糖效果相近。
次要观察指标HFF的Meta分析结果显示:SGLT2抑制剂可明显地降低患者HFF。减少肝脏脂肪堆积是阻止NAFLD发生的根本治疗措施,可产生直接保护肝细胞脂质代谢的作用。需要注意的是NAFLD的治疗目标不能仅关注肝脏本身,其根源在于减少体脂[23],改善胰岛素抗。与有增加体质量副作用的降糖药物如磺酰脲类、胰岛素及噻唑烷二酮类[24]相比,应用SGLT2抑制剂患者有低BMI、FM水平的独特优势。另外SLT2抑制剂可降低Ferritin、血清Ⅳ型胶原蛋白7S水平。有研究[25]显示NAFLD常伴不同程度铁超载现象,该现象可促进NAFLD进展,是非酒精性脂肪性肝炎和进展性纤维化的独立预测因子。血清Ⅳ型胶原蛋白7S含量的变化也能较好反映肝纤维化程度。从上述两项指标可看出SGLT2抑制剂对肝纤维化也有益处。关于AST的Meta分析结果,队列研究和RCT研究分析结果不同,这可能与纳入RCT研究较少有关,但也不排除SGLT2抑制剂不能改善AST水平的可能。
SGLT2抑制剂常见的不良反应为体液量减少和尿路生殖器感染,这可能与其增加尿液中葡萄糖含量作用机制有关。在临床试验中甚至有1例因反复的尿路感染和生殖器念珠菌病退出试验[3]。提示临床应用SGLT2抑制剂时应注意泌尿及生殖系统感染,及时采取治疗措施。还有少量患者出现眩晕、低血压、低血糖等不良反应,这可能与糖尿病患者联合用药有关,应合理调整用药方案。
本研究仍存在一些不足:(1)可能缺失少量已经发表会议论文或者灰色文献的纳入,由于COVID-19疫情期间资源有限未进行手动检索。(2)纳入研究数量较少,样本量较小,以队列研究为主。(3)大部分研究在日本进行,国内仅检索到1篇关于SGLT2抑制治疗T2DM合并NAFLD的试验报道[26],但由于缺少基线资料且未能与作者取得联系,故未纳入。(4)纳入研究中部分使用SGLT2抑制剂的药物方案、用药时间不同,但是由于研究数目较少未能进行亚组分析排除异质性的来源。
综上所述,SGLT2抑制剂可以有效改善T2DM合并NAFLD患者的血糖、肝脏酶学水平,并对体质量、体脂、肝脂肪变性和纤维化产生有益的效果。鉴于SGLT2抑制剂同时会增加患者体液量减少事件、泌尿生殖器感染事件的发生率,建议患有生殖泌尿系统感染基础病变的患者避免使用SGLT2抑制剂。由于纳入的文献数量不多,因此需要更多样本量、多种族和长时间的临床RCT进一步证实上述结论。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:李晓静负责研究设计,资料分析,撰写论文;孙元隆参与纳入文献研究筛查;张彬彬参与纳入文献筛选第三方确认工作;梅祖兵指导撰写文章,论文修改;冯琴拟定写作思路;胡义扬修改论文并最后定稿。
