超高磁场下大鼠脑血管成像技术应用
2020-11-02雷建锋赵媛媛王战京武文琦
雷建锋 赵媛媛 王战京 武文琦
(首都医科大学中心实验室,北京 100069)
磁共振脑血管成像(magnetic resonance angiography,MRA)在脑血管疾病的检查方法上相比于其他检查方法具有无辐射、无创伤等优势,已广泛应用于临床。脑血管成像主要依靠于流动的血在MRI 图像上可表现为亮信号和暗信号,这两种信号的表现是由血的流动速度和所用的成像序列决定的。核磁共振脑血管成像[1-3]上主要有TOF_MRA 成像方法、PC_MRA 相位成像方法,CE_MRA[4-5]成像方法。
随着超导技术的发展,磁共振的磁场强度越来越高,市场上已经有7.0T、9.4T、11.7T 等高磁场磁共振,目前7.0T 及以上超高磁场核磁共振主要是小动物核磁共振,小动物核磁共振在使用过程中和用于临床的核磁共振有很大区别,小动物核磁共振的序列没有进行序列参数的优化,只能通过实验员不断优化序列的参数,获得理想的磁共振图像,而用于临床的核磁共振都做了序列参数优化,后期操作中几乎不用考虑参数修改问题。基于此种情况,开展以下实验研究。
由于超高磁场能够使核磁共振成像的信噪比更高、磁场梯度更高,梯度切换率更快。所以能够对微小组织结构及功能的改变提供更加快速精确的显示,为科学研究提供一种无创的、快速的、精确的研究方法。所以小动物核磁在科学研究应用方面日趋广泛,如动物实验中对药物研究、纳米材料研究、脑科学研究等都使用到小动物核磁。在脑科学的研究中动物脑功能、脑血管、脑肿瘤方面的研究已经成为非常热的方向。动物脑血管研究主要是通过建立疾病动物模型,比如脑缺血疾病模型、脑出血疾病模型、微小脑血管疾病模型等,利用超高磁场的动物核磁共振对疾病动物模型做核磁扫描,然后对核磁图像数据进行分析以及与病理数据相比较,判断与所研究课题的目的是否一致。超高场小动物核磁共振的线圈一般配备三种线圈:表面线圈、头线圈(鸟笼线圈)、体线圈。这三个线圈中能够做小动物头部磁共振成像的是表面线圈和头线圈,目前在研究小动物头部核磁结构图像及脑功能图像,一般都是使用表面线圈成像的,但是对于这两个线圈哪一个更适合做小动物脑血管成像,是实验研究的主要目的。使用TOF_MRA[6-9]成像方法对正常大鼠的脑部血管成像,主要从二个方面进行研究论证:①线圈对血管信号的影响,即单通道的表面线圈和头线圈对图像信噪比和对比度的影响;②序列中其他参数不变的情况下翻转角对图像的信噪比和对比度的影响。对采集到大鼠脑血管图像进行数据分析,利用SNR 和CNR 两个图像质量评价参数,为小动物脑血管成像在线圈选择、序列选择、参数设定方面提供很好的应用。
1 材料及方法
1.1 实验动物及仪器选择
动物选用正常SD 大鼠5 只,体重在330±20 g 左右,仪器选择的成像系统为Bruker PharmaScan7.0 T的小动物核磁,口径为16 cm,线圈选用①单通道的发射线圈[10]及用于接收信号的表面线圈;②单通道的发射和接收一体的头线圈。
1.2 成像方法及参数设定
成像方法选用3D-TOF 序列和2D-TOF 序列对大鼠脑血管成像。成像序列具体参数如下表1 所示。
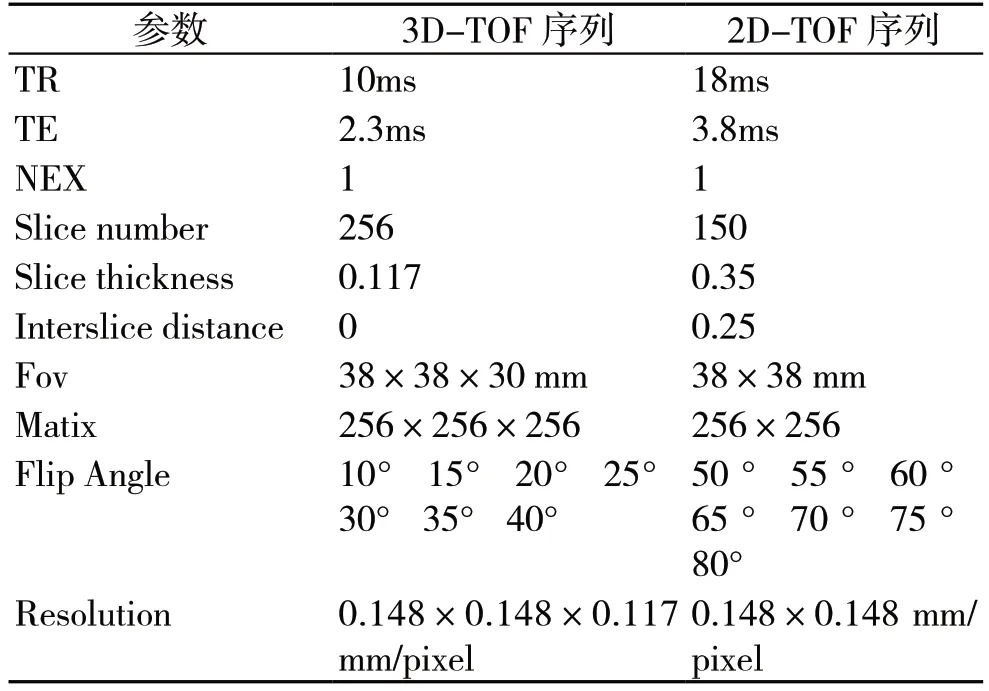
表1 大鼠脑血管成像参数表
1.3 动物麻醉方法及生理监控
麻醉方法采用气体麻醉,麻醉剂选取医用异氟烷,麻醉仪器选用美国JD Medical 的麻醉机,诱导麻醉时采用异氟烷与氧气混合4%的剂量,维持麻醉采用异氟烷与氧气混合1.5%的剂量,麻醉过程中动物的生理监控采用的是美国的Small Animal Monitoring and Gating System,麻醉中动物呼吸控制到35±5 次/分钟左右,血氧控制在98%左右。麻醉过程动物生理监控系统如图1 所示。
图1 动物生理监控系统
2 图像感兴区域选择及数据分析
为了保证数据准确性,必须对感兴区域[11](ROI)的选取达到一致性,根据成像序列建立统一感兴区域的选取方法。根据成像方法的不同分别建立一套标准的感兴区域划取方法。从感兴区域中可以得到血管的信号强度、血管周围信号强度、背景噪声信号标准差这些数据。
2.1 SNR 及CNR 的测定方法及分析
根据SNR 及CNR 算法原理,实验SNR 及CNR计算公式[12]如(1)(2)所示。

通过核磁共振仪器上的软件测得感兴区域灰度值,利用公式(1)(2)计算出血管的SNR 和CNR,根据成像序列制定3D-TOF 和2D-TOF 大鼠脑血管SNR 和CNR 表,表中内容记录了使用某种线圈成像和不同的翻转角对大鼠脑血管平均SNR 和CNR。具体表中内容如表2 和表3 所示。
从表2 中的数据可分析出:①同一翻转角情况下使用头线圈成像的图像平均SNR 和CNR 比表面线圈成像的图像平均SNR 和CNR 高出2~3 倍;②翻转角在10°到20°时图像的平均SNR 和CNR最高;③平均CNR 会出现的负值的情况,这是由于血管信号低于周围组织信号,原因由于表面线圈对流入血管信号灵敏度下降或翻转角增大使血管信号强度低于周围组织信号强度。
从表3 中的数据分析出:①在同一翻转角情况下使用头线圈成像的图像平均SNR 和CNR 比表面线圈成像的图像平均SNR 和CNR 的高大约1.1 到1.5 倍左右;②翻转角在70°到80°时图像的平均SNR 和CNR 最高。
2.2 分析大鼠脑血管MIP 图像
大鼠脑血管MIP 像使用软件RadiAnt DICOM Viewer 重建,窗位和窗宽设定为12200 和24400。为了直观反映图像质量只截取部分大鼠脑血管MIP[13-14]像,大鼠脑血管MIP 像如图2 所示。
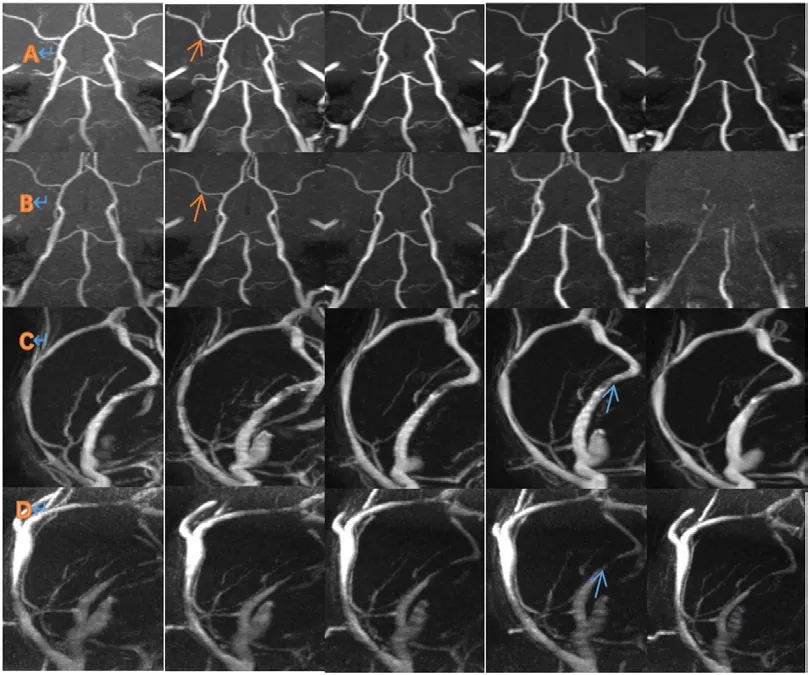
图2 大鼠脑血管MIP 图像
图3 中A 行的图像:成像线圈为头线圈,成像方法为3D-TOF 序列,翻转角从左到右依次为10°15°20°30°40°;B 除了线圈为表面线圈,其他与A 行一致;C 行的图像:成像线圈为头线圈,成像方法为2D-TOF 序列,翻转角从左到右依次为50°60°70°75°80°;D 除了线圈为表面线圈,其他与C 行一致。从图3 可以直观得到以下几种情况:①A 行和C 行血管信号明显好于B 行和D 行血管信号;②从A 行和B 行红色箭头所指血管位置依次从左向右可以看到翻转角在10°到20°时图像的脑血管信号好于其他翻转角的脑血管信号,③从C 行和D 行蓝色箭头所指血管位置依次从左到右可以看到翻转角在70°到80°脑血管信号好于其他翻转角的脑血管信号,并且C 行血管是完整的只在蓝色箭头处信号减弱,而在D 行蓝色箭头所指血管都是不完整。
从表2、表3 和图3 中的分析的结果得到以下结论:①大鼠脑血管成像时在线圈选择上首选头线圈;②脑血管动脉成像选择3D-TOF 序列[15-17]作为成像方法,翻转角参数设定在10°到20°时,图像质量最好。脑血管静脉成像选择2D-TOF序列[18-19]作为成像方法,翻转角参数设定在70°到80°时,图像质量最好。
3 讨论
近年来缺血、出血、血管狭窄、脑血管瘤[20-22]等脑血管疾病的发生越来越多,对于这些疾病基础研究往往通过动物模型来实现,近10 多年来超高磁场的小动物核磁共振的出现,使得这些研究可以通过小动物核磁共振作为研究手段,小动物脑血管成像和临床脑血管的成像原理一致,即TOF 成像方法、PC 成像方法、CE 成像方法。其中非对比剂[23]血管成像方法有TOF 和PC 法,两者都属于短TR梯度回波序列,CE 是通过注射对比剂来改变血管和周围组织弛豫时间而达到血管成像。对于动物脑血管成像是一个很复杂的过程,①动物呼吸的控制,这是至关重要的一个方面,直接影响到图像是否有伪影从而影响到图像质量;②动物摆位和翻转角设定,由于TOF 方法是属于流入敏感技术,它利用的效应由流动相关增强(FRE)决定。为了使FRE 最大化,在设定层厚参数应使层厚尽量薄,以提高对慢流动的灵敏度和选层方向分辨率,翻转角设定根据动物摆放位置使射频激发的层面与血管垂直。所以在用TOF 序列为动物血管成像时在参数设定上需要做很多改变,根据实验的目的改变参数,而不是一成不变。
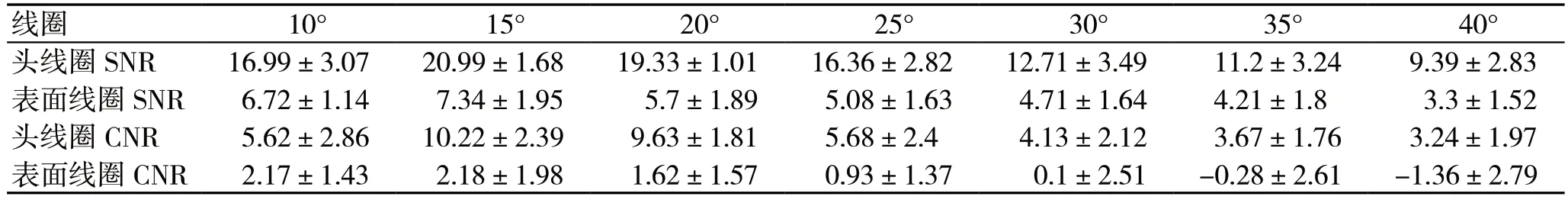
表2 3D-TOF 大鼠脑血管SNR 和CNR 表
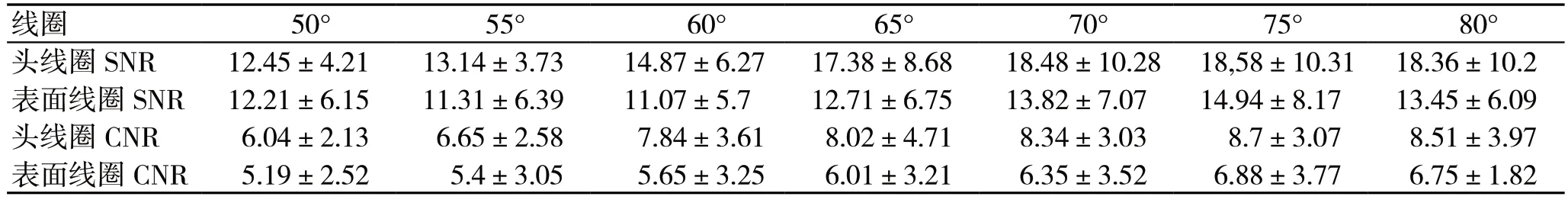
表3 2D-TOF 脑血管图像SNR 和CNR
使用TOF 序列为大鼠脑血管成像,首先是选择适当的线圈,因为线圈对脑血管信号的影响占了很大比重;然后是动物生理控制,只有动物生理控制好才使得图像不会出现伪影;最后是参数的设定,使用TOF 成像方法中翻转角是一个重要的参数,因为它直接影响了FRE 的最大化。不足之处为没有做动物模型的成像与正常动物成像的比较以及没有能够对单通道线圈和多通道线圈成像效果进行比较。
