猪圆环病毒3 型TaqMan 实时荧光定量PCR 检测方法的建立
2020-10-31陈如敬吴学敏陈秋勇车勇良王隆柏周伦江
陈如敬,吴学敏,陈秋勇,车勇良,王隆柏,严 山,周伦江
(福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程中心,福建 福州 350013)
0 引言
【研究意义】截至目前,猪群中发现存在3 种圆环病毒:猪圆环病毒1 型(Porcine circovirus 1, PCV 1)[1]、猪圆环病毒2 型(Porcine circovirus 2, PCV2)[2]和近年来新发的猪圆环病毒3 型(Porcine circovirus 3, PCV3)[3-4]。根据国际病毒分类委员会的最新分类,PCV1、PCV2 和PCV3 均属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus)成员。PCV3在美国、中国、日本、韩国、瑞典、俄罗斯、泰国、巴西、丹麦、意大利、西班牙等猪群中均有报道[5]。此外,流行病学调查还发现猪群中存在多种其他病原和PCV3 混合感染,且PCV3 在野猪中也广泛流行[6-7]。一般认为,PCV1 对猪群不致病,而PCV2是当前猪群中最为重要的致病病原之一;但是关于PCV3 是否存在致病性,目前还存在一定的争议,这主要和当前缺乏对PCV3 的有效培养有关[8-10]。因此,亟待开发一种特异、敏感、快速的检测方法用于开展PCV3 流行病学调查和致病机制研究。【前人研究进展】目前,PCV3 的检测已见有SYBR I 实时荧光定量PCR 方法[11]、重组酶扩增方法(Recombinase polymerase amplification, RPA)[12]、环介导等温扩增(Loop-mediated isothermal amplification, LAMP)[13-14]和酶联免疫吸附测定法(Indirect enzyme-linked immunosorbent assay, ELISA)[15]、 数 字 PCR 方 法(Droplet Digital PCR)[16]等。对GenBank 中PCV3 序列进行分析发现,PCV3 基因组全长在1 999~2 001 bp,编码有两个大的开放阅读框(Open reading frame,ORF):位于基因组左侧的ORF1 编码病毒复制相关蛋白(Rep)和位于病毒基因组右侧的ORF2 编码病毒抗原相关蛋白(Cap)[17-18]。序列分析比较发现,不同PCV3 来源Rep 蛋白和圆环病毒属其他病原该基因同源性均较低,和蝙蝠源圆环病毒(Bat circovirus)最高,约为54%~55%,和PCV2 的氨基酸同源性仅为48%左右。研究还进一步发现,PCV3的Rep 蛋白上有3 个和病毒滚环复制相关的结构域:FTINN、HLQG 和YCKK[3-4]。【本研究切入点】以PCV3 中的Rep 基因建立特异性检测方法具有一定实用性和可行性。【拟解决的关键问题】本研究通过分析PCV3 福建株Rep 基因特征,建立特异性检测PCV3核酸感染的TaqMan 实时荧光定量PCR 方法,为后续开展Rep 基因在PCV3 复制和感染过程中的作用机制提供研究手段。
1 材料与方法
1.1 试验毒株
PCV1、PCV2、猪细小病毒(Porcine parvovirus,PPV)、猪伪狂犬病毒(Porcine pseudorabies virus,PRV)、变异型猪伪狂犬病毒(Porcine pseudorabies virus variants, v-PRV)[19]、猪巨细胞病毒(Porcine cytomegalovirus, PCMV)[20]由福建省农业科学院畜牧兽医研究所猪病研究室分离、鉴定和保存。
PCV3(FJ2017 株)、猪博卡病毒(Porcine bocavirus,PBoV)[21]、猪细环病毒1a 型(Porcine Torque teno sus virus type 1a, PTTSuV 1a)和猪细环病毒1b 型(Porcine Torque teno sus virus type 1b, PTTSuV 1b)[22-23]阳性病料均由福建省农业科学院畜牧兽医研究所猪病研究室鉴定和保存。
1.2 主要仪器和试剂
实时荧光定量试剂FastFire qPCR PreMix(Probe)(FP208)、 PCR 扩 增 试 剂2×Taq PCR MasterMixⅡ、病毒基因组DNA/RNA 提取试剂盒、普通琼脂糖凝胶DNA 回收试剂盒、快速质粒小提试剂盒均购自天根生化科技(北京)有限公司;pMD 18-T、DL2000 Marker 均购自宝生物工程大连有限公司;其他试剂均为商业公司购买的分析纯。
1.3 PCV3 Rep 基因的克隆和阳性标准品的建立
按照病毒基因组DNA/RNA 提取试剂盒说明书操作,提取PCV3(FJ2017 株)的核酸DNA,利用针对Rep 基因的特异性引物进行扩增获得PCV3 完整的Rep基因全长。上游引物PCV3-Rep-F1:5′-GTCCGGA、GGGAAAGCCCGAAAC-3′和下游引物PCV3-Rep-R1:5′- TCAATAGTTTATTGGATACACTGT-3′,预期扩增长度为891 bp。PCR 扩增体系配置如下(40 μL反应体系):2×Taq PCR MasterMix Ⅱ反应液20 μL、上游引物(PCV3-Rep-F1,10 μmol·mL-1)和下游引物(PCV3-Rep-R1,10 μm·mL-1)均1 μL、提取的核酸DNA 模板2 μL,补充灭菌去离子水至终体积40 μL。PCR 扩增反应条件:94 ℃ 3 min 后进行PCR 循环(共进行35 个循环),条件为94 ℃ 30 s、56 ℃ 30 s、72 ℃ 55 s。PCR 循环结束后,72 ℃延伸10 min。对目的片段使用普通琼脂糖凝胶DNA 回收试剂盒切胶回收后克隆到pMD18-T 克隆载体上,转化感受态细胞后,随机选取8 个克隆利用快速质粒小提试剂盒提取相应的质粒进行鉴定。经序列测定验证BLAST 分析后,将符合预期的质粒作为本试验的阳性标准品质粒(记为PCV3-Rep)。将获得的阳性标准品用超微量紫外可见分光光度计对阳性质粒进行定量,计算拷贝数并进行10 倍连续稀释(浓度分别为4.22×107~4.22×100拷贝·μL-1),置于-20 ℃备用。
1.4 基于TaqMan 探针检测PCV3 实时荧光定量PCR 方法的建立
1.4.1 特异性引物和探针的设计 将PCV3(FJ2017株)的Rep 基因序列和GenBank 中登录的PCV3 其他毒株的相关基因序列分析比较,选取保守区作为特异性的引物和探针的设计区域。利用引物设计软件Oligo v7.37 进行引物和探针设计,上游引物TaqMan-PCV3-F:5′-GGTGGGATGGTTATAATG-3′、下游引物TaqMan-PCV3-R:5′-TAGCCACAAAATTAAC AAAC-3′、探针引物TaqMan-PCV3-P:5′-CACCCTTAACAGGAACCCTCAGA-3′,其中5′端以FAM 标记,3′端Eclipse 标记。预期扩增长度为141 bp,上述引物和探针均在宝生物工程大连有限公司合成。
1.4.2 反应体系的建立和条件优化 采用FastFire qPCR PreMix(Probe)推 荐 的25 μL 配 置TaqMan 实时荧光定量PCR 方法的反应液。以出现最高的荧光值(ΔRn)、最小的Ct 值为指标,对退火温度(54~64 ℃)、不同引物终浓度(0.1、0.2、0.4、0.6、0.8、1.0 μmol·L-1)和不同探针终浓度(0.05、0.1、0.25、0.50 μmol·L-1)进 行 条 件 优 化,同 时 设NTC(No template control)对照。
1.4.3 标准曲线建立 以连续10 倍系列稀释(浓度分别为4.22×107~4.22×100拷贝·μL-1)的标准品质粒(PCV3-Rep)为模板,以1.4.2 优化条件进行扩增,获得扩增动力学曲线。以阳性标准品(PCV3-Rep)拷贝数的常用对数为横坐标,以循环阈值(Ct 值)为纵坐标,计算出建立的TaqMan 实时荧光定量PCR方法的标准曲线,获得本方法的标准线性回归方程。
1.4.4 特异性检测 用病毒基因组DNA/RNA 提取试剂盒提取PCV1、PCV2、PPV、PRV、v-PRV、PCMV、PBoV、PTTSuV 1a 和PTTSuV 1b 的基因组DNA,经超微量紫外可见分光光度计进行定量后作为特异性检测试验对照。以1.4.2 优化条件分别检测PCV1、PCV2、PPV、PRV、v-PRV、PCMV、PBoV、PTTSuV 1a 和PTTSuV 1b 提取的核酸DNA,以标准品质粒(PCV3-Rep)为阳性对照,以灭菌去离子水为阴性对照,评价建立的TaqMan 实时荧光定量PCR 方法的特异性。
1.4.5 变异系数测定 将阳性标准品质粒(PCV3-Rep)设3 个重复(含量分别为4.22×105、4.22×103和4.22×101拷贝·μL-1),用建立的基于TaqMan 实时荧光定量PCR 方法进行特异性检测,计算组内(Intra-group)变异系数。将该标准阳性标准质粒置于-20 ℃冰箱保存,每隔两周重检一次,连续检测3 次,计算其组间(Inter-group)变异系数。
1.5 临床样品检测
对本研究室保存于-70 ℃冰箱的193 份2014-2018 年收集的来自福建省多地市的猪临床组织样品,经病毒基因组DNA/RNA 提取试剂盒提取相应的核酸DNA 后,利用建立的基于TaqMan 实时荧光定量PCR 方法进行PCV3 感染的特异性检测。为明确相关样品中PCV2 的感染情况,本研究同时对这193份样品,利用前期建立的PCV2 特异性TaqMan 实时荧光定量PCR 方法进行平行检测[24]。
2 结果与分析
2.1 Rep 基因的序列分析
本研究克隆获得的PCV3(FJ2017 株)Rep 基因全长为891 bp,编码完整的296 个氨基酸(aa),其等电点(Isolectric point)为8.752,GenBank 登录号为MF072716。核苷酸同源性分析发现,不同PCV3来源Rep 基因同源性均较高,在99.6%~100%。将其和GenBank 中的PCV3 其他代表株进行遗传进化分析,采用MEGA7 软件,绘制遗传进化树采用NJ 法(Neighbor-Joining Methods),计算1 000 次重复(Bootstrap=1 000)。结果可见,不同地区、不同来源和不同分离时间PCV3 代表株Rep 基因相互之间较保守(图1)。
2.2 实时荧光定量PCR 检测方法的反应条件和反应体系
优化的TaqMan 实时荧光定量PCR 检测条件:98 ℃ 30 s 后进行循环,95 ℃ 5 s、 60 ℃ 15 s,进行40 个循环。优化出的25 μL 最佳反应体系为体系:2×FastFire qPCR PreMix(2×)12.5 μL、 上/下 游引物(10 μmol·L-1)各0.75 μL、探针(10 μmol·L-1)0.5 μL、阳性标准品稀释液2 μL、补水至终体积25 μL。
2.3 实时荧光定量PCR 检测方法的扩增曲线和标准曲线
TaqMan 实时荧光定量PCR 方法检测Rep 基因为4.22×101~4.22×106拷贝·μL-1有很好的线性关系,检测的最低值为42.2 拷贝·μL-1(图2)。所获得标准曲线斜率(slope)为-3.413,Y 轴截距(Yintercept)为38.39,相关系数(R2)为0.999(图3)。
2.4 实时荧光定量PCR 检测方法的特异性
本研究建立的TaqMan 实时荧光定量PCR 仅对PCV3 检测出现阳性扩增信号,对猪群其他常见病原(例如PCV1、PCV2、PPV、PRV、v-PRV、PCMV、PBoV、PTTSuV 1a 和PTTSuV 1b)检测均为阴性(图4)。
2.5 实时荧光定量PCR 检测方法的变异系数
本研究建立的基于TaqMan 实时荧光定量PCR方法检测PCV3 组内变异系数为0.58%~1.10%;建立的方法的组间变异系数0.82%~1.48%(表1)。
2.6 临床样品检测结果
对193 份样品进行PCV3 和PCV2 感染的实时荧光定量PCR 检测(表2),其中PCV3 阳性样品127份,阳性率为65.80%;PCV2 阳性样品161 份,阳性率为83.42%;PCV3 和PCV2 混合感染样品102 份,阳性率为52.85%。

图1 PCV3 不同代表株Rep 基因遗传进化分析Fig.1 Phylogenetic analysis based on Rep of PCV 3

图2 实时荧光定量PCR 检测方法的扩增曲线Fig.2 Amplification curve of RT-PCR

图3 实时荧光定量PCR 检测方法的标准曲线Fig.3 Standard curve of RT-PCR
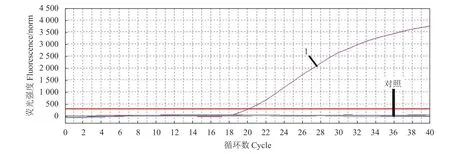
图4 实时荧光定量PCR 检测方法的特异性Fig.4 Specificity of TaqMan RT-PCR method
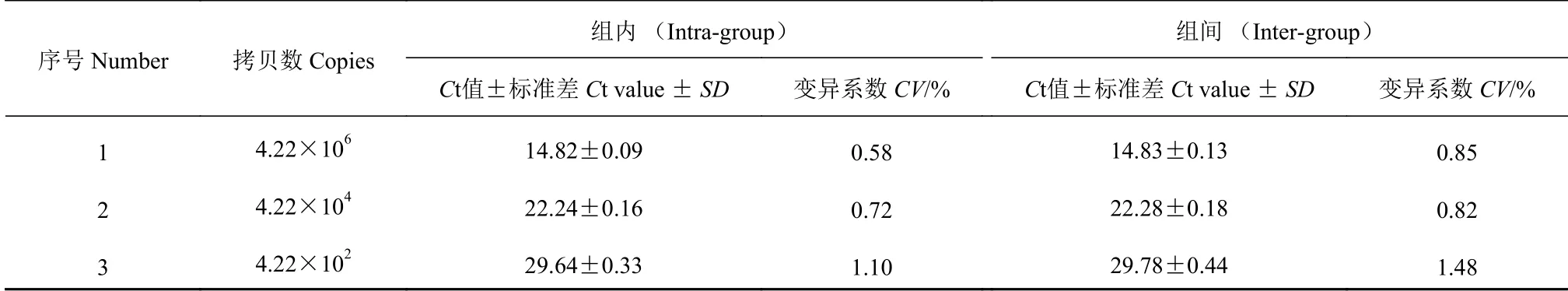
表1 实时荧光定量PCR 方法的变异系数Table 1 Coefficients of variation (CV) of TaqMan RT-PCR between inter- and intra-groups

表2 临床样品的检测Table 2 Detection on clinical samples by TaqMan RT-PCR method
3 讨论
截至目前,PCV3 还未见成功分离培养的相关研究报道,这为研究PCV3 的致病机理带来困扰。前期研究发现,在患有多种临床症状的猪(包括野猪)群多脏器中均可检测到较高的PCV3 核酸阳性率[25-27]。但是近期研究也证实在健康猪群中也可检测到PCV3 阳性,这导致PCV3 对猪群的致病力和机制还存在一定争议[28]。此外,研究还发现PCV3 还可在死胎、精液和初乳中均可检测到核酸阳性,上述证据表明PCV3 可以垂直传播[29-30],给PCV3 的科学防控带来极大挑战。
研究发现,虽然PCV3 最早于2015 年在美国发现,但是对早期保存的猪组织样品进行检测发现,瑞典猪群中1993 年、西班牙和中国猪群中1996 年组织样品中均可检测到PCV3 阳性,表明PCV3 在猪群中存在较长时间[31-32],本研究在保存的2014 年组织样品中也检测到PCV3 感染阳性,进一步丰富了PCV3在我国的流行病学信息。对于PCV3 基因组进行分析发现,PCV3 不同时空各毒株相互之间核苷酸同源性较高(98.0%以上),表明PCV3 在遗传进化上较为保守。
前期Han 等[33]建立的可同时检测PDEV 和PCV3的SYBR I 实时荧光定量PCR 方法,其最低检测限分别为34.6 拷贝·μL-1(检测PDEV)和61.2 拷贝·μL-1(检测PCV3)。Kim 等[34]建立的可同时检测PCV2和PCV3 的SYBR I 实时荧光定量PCR 方法,其最低检测限均为50 拷贝·μL-1。本研究利用GenBank 数据库PCV3 基因特点,选取其复制相关蛋白Rep 基因为候选基因靶区来设计特异性的引物和探针,建立检测PCV3 感染的TaqMan 实时荧光定量PCR 方法,该方法敏感性好,最低检测限为42.2 拷贝·μL-1,比Chen 等[27]建立实时荧光定量PCR 方法高,与Han等[33]和Kim 等[34]等建立的方法灵敏度相当;特异性强,对常见猪群传染病均无交叉反应;建立的方法组内变异系数和组间变异系数均在1.48%以内。对福建2014-2018 年保存的193 份组织样品进行检测发现,PCV3 在福建省猪群中存在较高的阳性感染率(65.80%)。进一步对相关样品进行PCV2 检测发现,福建省猪群中存在极高的PCV3 和PCV2 混合感染,这提示我们需进一步开展PCV3 和PCV2 混合感染的致病机制和协调感染相关研究。
