叠氮化钠诱变对不同大豆种质低温耐受性的影响
2020-10-31李性苑
田 鑫,钟 程,李性苑
(凯里学院 大健康学院,贵州 凯里 556011)
0 引言
【研究意义】大豆是全球最重要的油料作物和粮食作物[1],属喜温作物,而我国南方春大豆在早春常常会遭受低温胁迫,抑制其出芽和幼苗生长发育[2-3],生长后期遭遇低温胁迫将影响到大豆的产量和品质[4-5]。此外,我国大豆产业的发展还面临着美国大豆产业的冲击和挑战[6]。为了提高我国大豆产业竞争力,有必要积极推进大豆育种工作。叠氮化钠(NaN3)作为作物育种中最常用的化学诱变剂之一,优势在于使用方便、费用低廉[7]。将叠氮化钠应用于大豆诱变并对诱导后增殖的丛生芽进行低温耐受性鉴定,可为大豆耐低温育种积累原始材料。耐低温大豆种质可更好地适应低温天气,对提高我国大豆产业竞争力具有重要意义。【前人研究进展】因叠氮化钠的毒性易被次氯酸钠所消解,在诱变处理中能达到相对安全的目标而被广泛应用[8],已在玉米[9]、大豆[10]、小麦[11]、柑橘[12]、香蕉[13]等作物的研究与应用中取得较好的诱变效果。姜振峰[10]利用叠氮化钠处理大豆种子进行诱变,得到矮化、晚熟性状。李波等[14-15]用叠氮化钠诱变豆科植物苜蓿的幼茎愈伤组织后,经-7℃低温筛选,并通过生理生化指标验证了3 个苜蓿种质获得的抗寒性均显著高于对照愈伤组织。【本研究切入点】叠氮化钠已成功应用于多种作物农艺性状改良和基因功能验证[16],但目前应用于大豆耐低温诱变育种的研究尚属空白。【拟解决的关键问题】本研究利用不同质量浓度的叠氮化钠对不同种质大豆叶芽进行离体诱变,从中筛选出最佳处理进行低温胁迫后,进行生理生化指标的测定与分析,鉴定不同种质材料诱变后丛生芽的低温耐受性,为后继的大豆耐低温诱变育种积累原始资料。
1 材料与方法
1.1 材料与试剂
供试品种:常蔬特大王、台湾292、剑河大豆,分别来自江苏常州、上海、贵州剑河的主栽品种。
培养基1(接种/继代培养基):MS+6-BA(0.7 mg·L-1)+ IAA(0.2 mg·L-1)+ Cef(400 mg·L-1)+蔗糖(40 g·L-1)+琼脂(7 g·L-1),pH值6.0。
培养基2(生根培养基):MS+ NAA(0.3 mg·L-1)+Cef(400 mg·L-1)+蔗糖(40 g·L-1)+琼脂(7 g·L-1),pH 值6.0。
1.2 试验方法
1.2.1 丛生芽诱导 选择无病虫害、机械损伤的种子进行浸种催芽,4 d 后种植于凯里学院试验基地,常规管理,苗龄2 周,第1 片真叶叶芽长至约0.5 cm时取样并用单蒸水冲洗10 min,在超净工作台上用0.1%升汞消毒10 min,用无菌水冲洗5~6 次,将消毒好的叶芽放在无菌滤纸上备用。
将叶芽接种于培养基1 中进行培养,每个组培盒接9 个外植体,每个配方分别接50 盒。置于20~25℃培养室中,光照强度800~1 200 lx,18 h/6 h(昼/夜)进行培养,至叶芽分化后形成的丛生芽长至0.5~1.0 cm(30~40 d)时备用。
1.2.2 叠氮化钠诱变 取生长至0.5~1.0 cm 的丛生芽作为多倍体诱导材料,转入培养基1 中进行继代培养,NaN3采用过滤灭菌(33 mm×0.22 μm 无菌滤膜),脱脂棉采用高压蒸汽灭菌锅灭菌(121℃,20 min)。将经NaN3浸透的脱脂棉放置于丛生芽上,3 个处理质量浓度分别为0.4、0.8、1.0 mmol·L-1,每个处理30 盒,以无菌水浸透脱脂棉为对照,处理48 h,移除脱脂棉,用无菌水清洗残余NaN3。继续培养30~50 d(培养条件同上),观察、记录、统计和计算各处理的污染数、污染率、死亡数、死亡率、丛生芽数。污染率=(污染数/芽数)×100%,死亡率=[死亡数/(芽数-褐化数)]×100%
1.2.3 低温处理诱变大豆的生理生化指标测定 经诱变试验筛选出0.8 mmol·L-1NaN3、48 h 为最佳处理(表1)。取经0.8 mmol·L-1NaN3处理48 h 的丛生芽植株与未经NaN3处理的植株(对照),置于4℃低温培养箱,在光照800~1 200 lx(18 h·d-1)条件下进行培养,4 d 后取鲜样测定蛋白质、可溶性蛋白、可溶性糖、叶绿素a/b、类胡萝卜素等营养指标;低温处理0、1、2、3、4 d(其中0 处理是指低温处理前的时间点)时分别取鲜样测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)等生化指标。每个处理重复3 次,每处理4 株为1 个重复。营养及生理指标测定方法:蛋白质采用紫外分光光度计法,可溶性蛋白采用考马斯亮蓝-G250 法,可溶性糖采用苯酚法,叶绿素采用丙酮法,SOD 采用氮蓝四唑光还原法,POD 采用愈创木酚比色法,CAT 采用高锰酸钾滴定法,MDA 采用硫代巴比妥酸法[17]。试验数据采用SPSS 22 中的General Linear Model-Univariate 进行方差分析。
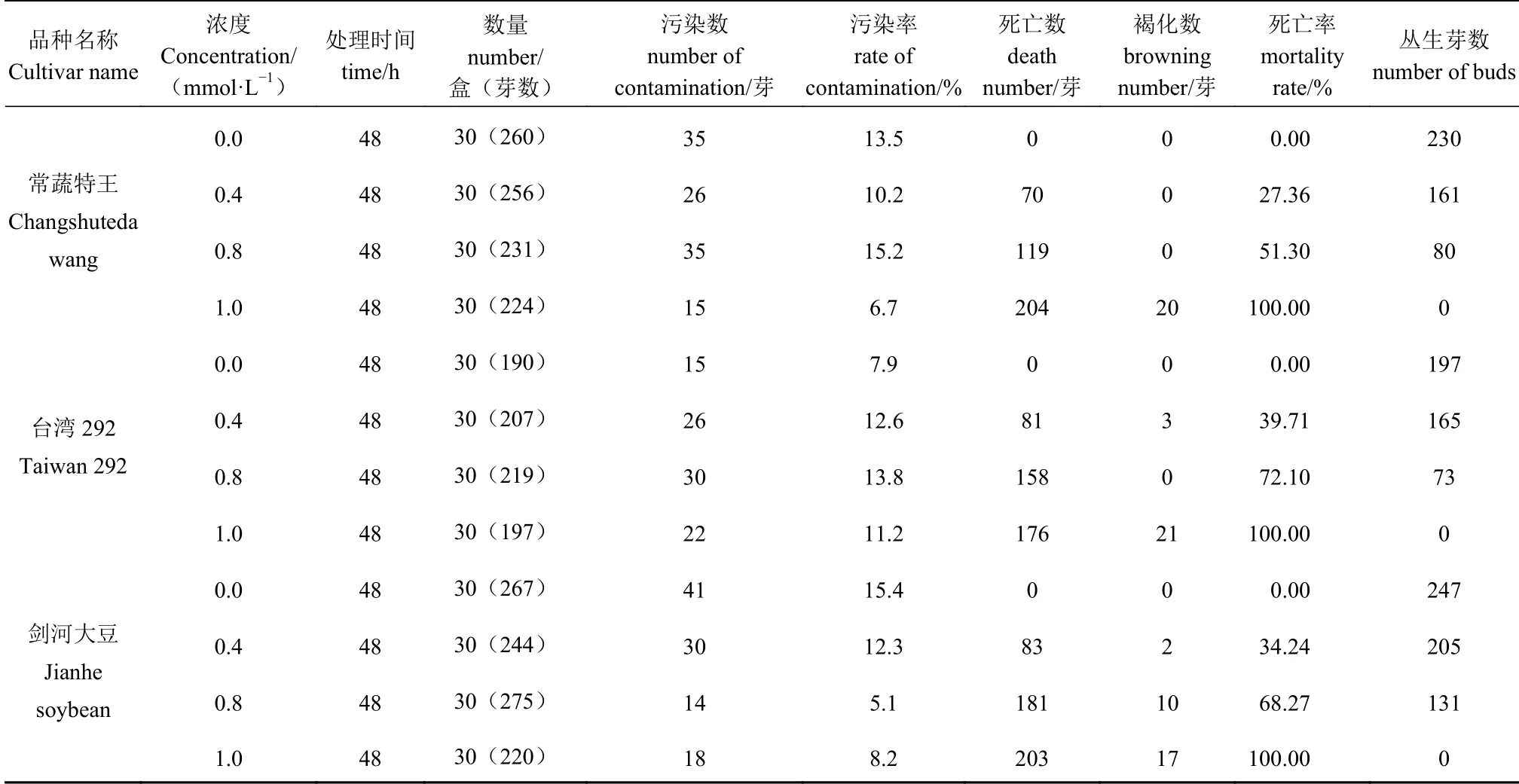
表1 叠氮化钠处理对大豆芽诱变的影响Table 1 Effect of immersing buds in sodium azide solutions on induced mutagenesis of soybean germplasms
2 结果与分析
2.1 不同NaN3 浓度对大豆丛生芽生长的影响
由表1 可知,经NaN3处理48 h 后,大部分丛生芽能够正常生长,单株丛生芽数量多,但与对照相比显示生长受抑制,部分出现畸形死亡、叶片发黄及腐烂现象。随着处理浓度增加,死亡率增加,丛生芽存活总数减少,种质间趋势基本一致。0.8 mmol·L-1NaN3、48 h 处理的丛生芽存活总数相对较少,剑河大豆丛生芽数较其他两个种质稍多,生长至20 d 左右半数丛生芽出现黄化现象,黄化部位位于组织嫩梢,黄化后期逐渐死亡;常蔬特大王叶芽基部出现不 同 程 度 的 白 化。1.0 mmol·L-1NaN3、48 h 处 理 的3 个种质丛生芽全部死亡。
综合考虑污染率、死亡率、丛生芽数等指标,选择适当浓度处理的材料进行后继低温胁迫的生理指标测定。一般情况下,多以处理后植株存活一半的剂量即半致死剂量(LD50)作为诱变敏感性的指标[18],但鉴于本试验后期进入低温(4℃)处理的特殊性,即:0~4℃低温条件下可使植物代谢活动延缓下来,从而不增加生理损伤,降低诱变处理后效[19]。因此,选取略高于LD50的剂量并保持处理浓度一致,即选取0.8 mmol·L-1NaN3、48 h 处理的植株进行后继的低温胁迫试验。
2.2 不同种质不同处理的主要生理指标
由图1-A、图1-B、图1-C 可知,3 个种质经4℃处理4 d 后,诱变植株的蛋白质、可溶性蛋白、可溶性糖含量均极显著高于未诱变的对照(CK)植株。不同种质间差异显著,台湾292 诱变植株的蛋白质含量显著高于剑河大豆诱变植株(图1-A);常蔬特大王、台湾292 诱变植株的可溶性蛋白含量分别显著、极显著高于剑河大豆诱变植株,台湾292 对照植株的可溶性蛋白含量显著高于剑河大豆对照植株(图1-B);诱变植株中台湾292 可溶性糖含量极显著高于其他2 个种质,正常植株中则台292 极显著高于常蔬特大王。综上所述,3 个种质在诱变及未诱变条件下,4℃低温胁迫后渗透调节物质含量存在差异,其渗透调节物质含量的排序为:台湾292>常蔬特大王>剑河大豆;每个种质的渗透调节物质含量均表现为诱变植株大于对照植株。

图1 3 个大豆种质诱变植株与对照植株在低温胁迫下的生理指标CSTDW:常蔬特大王,TW292:台湾292,JHS:剑河大豆。Fig.1 Physiological indices on mutant and control soybean germplasms under low-temp stress
由图1-D、图1-E、图1-F 可知,3 个种质经低温处理4 d 后,诱变植株的叶绿素a、叶绿素b、类胡萝卜素含量均极显著高于对照。在不同种质间,常蔬特大王和台湾292 诱变植株叶绿素a 含量分别显著和极显著高于剑河大豆,而台湾292 对照植株显著高于剑河大豆对照植株(图1-D);对于叶绿素b 而言,诱变植株及对照植株均为台湾292 极显著高于常蔬特大王和剑河大豆,剑河大豆的叶绿素b 含量为3 个种质中最低(图1-E);3 个种质在类胡萝卜素含量上仅在各自诱变植株及对照植株间存在极显著差异,而种质间无显著差异(图1-F)。由此可见,3 个种质在诱变及未诱变条件下,4℃低温处理后光合色素合成能力存在差异,总体表现为:台湾292>常蔬特大王>剑河大豆,且每个种质诱变植株的光合色素含量均极显著大于对照植株。
2.3 不同种质不同处理的SOD 活性
如图2-A、图2-B、图2-C 所示,在0 d,常蔬特大王的诱变植株与对照植株的SOD 活性无显著差异,而台湾292、剑河大豆的诱变植株与对照(CK)植株的SOD 活性均存在极显著差异。而常蔬特大王在低温处理的0~4 d,诱变及对照植株变化趋势一致且不存在显著差异,第4 d 与0 d 相比亦无显著差异。说明诱变和低温处理对常蔬特大王的SOD 活性没有显著影响。
台湾292 低温胁迫之前的诱变处理显著提高了SOD 活性,短期低温处理(2 d 内)诱变植株的SOD活性急剧降低,随着处理时间的延长,又有所回升,最终诱变处理与对照间的SOD 活性趋于一致。
剑河大豆在低温胁迫之前的诱变处理提高了SOD活性,短期低温处理(2 d 内)诱变植株的SOD 活性还能维持高于对照水平,第3 d 两者已无显著差异,第4 d 诱变植株的SOD 活性极显著低于对照。
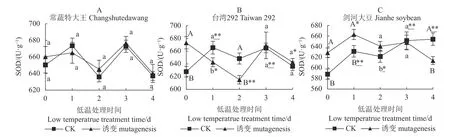
图2 3 个大豆种质诱变与对照(CK)植株在4℃低温胁迫下的SOD 活性Fig.2 Differences on SOD activity between mutant and control soybean germplasms under 4 ℃ low-temp stress
综上所述,低温胁迫前,诱变处理能显著提高台湾292 和剑河大豆的SOD 活性,但对常蔬特大王的SOD 活性无显著影响。低温胁迫后,常蔬特大王诱变及对照的SOD 活性并无显著差异;台湾292 在短期内诱变植株的SOD 活性下降,最后与对照趋于一致;而剑河大豆诱变植株的SOD 活性短期内能够保持较高水平,但随着低温胁迫时间延长,SOD 活性降低,直至低于对照。说明常温条件下,叠氮化钠对3 个种质的SOD 活性提升效果为:台湾292、剑河大豆>常蔬特大王;低温条件下3 个种质对照植株的SOD 活性提升效果为:剑河大豆>台湾292>常蔬特大王;低温条件下3 个种质诱变植株的SOD 活性提升效果为:常蔬特大王>台湾292>剑河大豆。
2.4 不同种质不同处理的POD 活性
如图3-A、图3-B、图3-C 所示,第0 d 时3 个种质诱变及对照(CK)间均无显著差异。常蔬特大王在低温处理后,诱变植株和对照植株均表现为先升后降的变化趋势且不存在显著差异,在第4 d 均与第0 d 存在极显著差异,因此诱变对常蔬特大王POD活性无显著影响,而低温处理能够显著提高诱变植株和对照植株的POD 活性。
诱变对台湾292 的POD 活性亦无显著影响,但短时间低温处理(1 d)导致诱变植株的SOD 活性极显著低于对照,但随着处理时间的延长,诱变植株的SOD 活性持续上升,最终极显著高于对照。而第4 d诱变及对照植株的POD 活性分别极显著、显著高于处理前,表明低温处理能够显著提高台湾292 的POD活性,且对诱变植株的提高幅度高于对照植株。
低温处理前,诱变对剑河大豆的POD 活性同样无显著影响,低温处理后3 d 内诱变植株的POD 活性能够提升至极显著高于0 d,但在第4 d 回归至低温处理前水平。而对照植株的POD 活性在第2 d 提升至较高水平,极显著高于0 d 并维持至第4 d,最终对照植株的POD 活性极显著高于诱变植株。
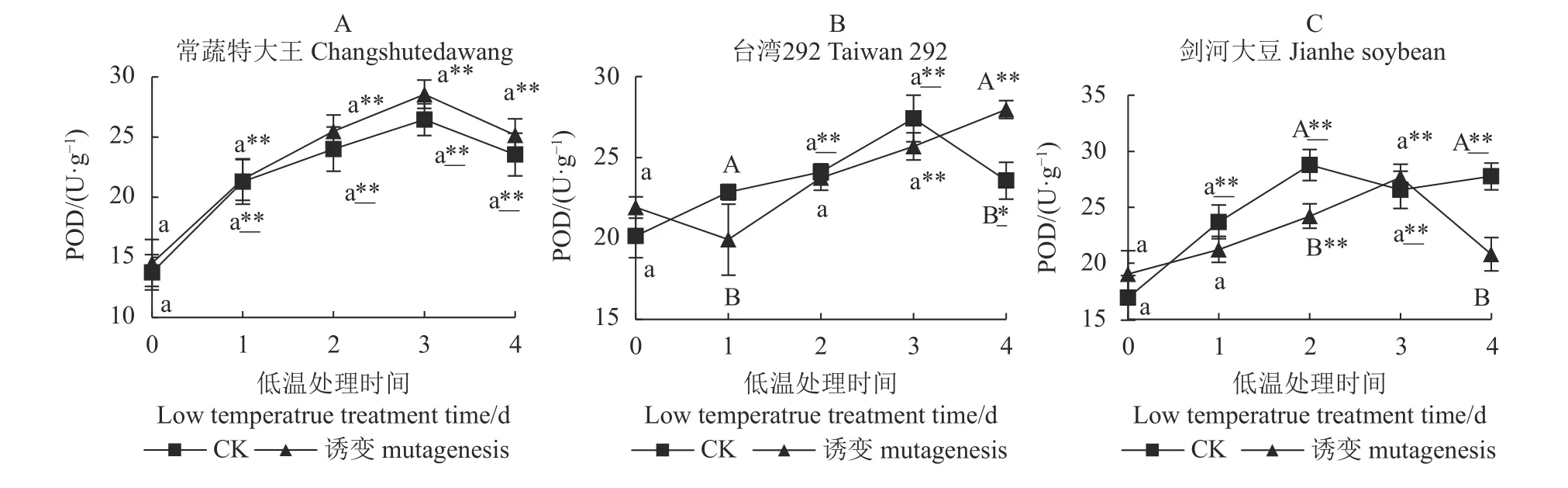
图3 3 个大豆种质诱变植株与对照植株在低温胁迫下的POD 活性Fig.3 POD activities of mutant and control soybean germplasms under low-temp stress
综上所述,对3 个种质而言,常温条件下诱变均不能显著提升其POD 活性,但经低温处理后3 个种质诱变植株和对照植株表现出不同的变化趋势,常蔬特大王的诱变植株和对照植株的POD 活性均有提升,且二者无显著差异;台湾292 诱变植株和对照植株的POD 活性均有提升,但诱变植株提升较大;而剑河大豆对照植株的POD 活性前中期提升速度显著快于诱变植株,诱变植株前中期也有提升,但最后回到低温处理前的水平,并极显著低于对照植株。说明常温条件下,叠氮化钠对3 个种质的POD活性均无提升作用;低温条件下3 个种质对照植株的POD 活性提升效果为:剑河大豆、常蔬特大王>台湾292;低温条件下3 个种质诱变植株的POD 活性提升效果为:台湾292>常蔬特大王>剑河大豆。
2.5 不同种质不同处理的CAT 活性
如图4-A 所示,第0 d 时,常蔬特大王诱变植株和对照植株无显著差异,诱变植株和对照植株的CAT 活性分别在第1 d、第2 d 极显著、显著高于0 d,但在第3 d 两者均下降至极显著低于0 d,最后(第4 d)回归至与低温处理前无差异的水平。
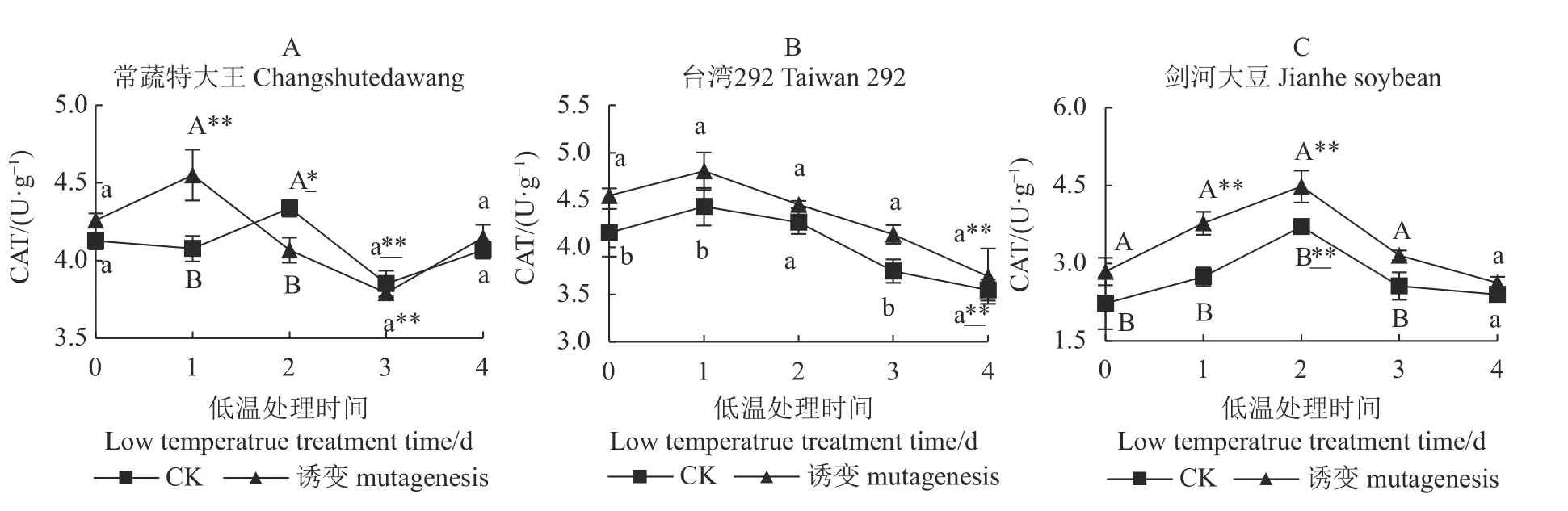
图4 3 个大豆种质诱变植株与对照植株在低温胁迫下的CAT 活性Fig.4 CAT activities of mutant and control soybean germplasms under low-temp stress
如图4-B 所示,诱变处理能显著提高台湾292的CAT 活性,低温处理后诱变植株和对照植株的CAT 活性均持续下降,最后两者均极显著低于0 d时的CAT 活性水平,诱变植株与对照植株间无显著差异。
如图4-C 所示,诱变处理极显著提高剑河大豆的CAT 活性,在低温处理后,诱变及对照植株短期内(2 d)相对0 d 有极显著提升,但在后期持续下降,最终下降至与0 d 对比无显著差异的水平,而诱变及对照处理之间的CAT 活性在低温处理4 d 后趋于一致,无显著差异。
综上所述,常温条件下,诱变处理能够分别显著、极显著提高台湾292、剑河大豆的CAT 活性,对常蔬特大王的CAT 活性无显著影响,但在长时间(4 d)低温处理后,诱变所引起的差异被消除,最终诱变植株与对照植株之间均呈无显著差异状态,常蔬特大王及剑河大豆低温处理后短期内的CAT 活性呈现波动变化,但最终回归处理前的水平,而台湾292 的诱变植株和对照植株的CAT 活性变化趋势保持一致,均极显著低于低温处理前。说明常温条件下,叠氮化钠对3 个种质的CAT 活性提升效果为:剑河大豆>台湾292>常蔬特大王;低温条件下3 个种质正常植株的CAT 活性提升效果为:常蔬特大王、剑河大豆>台湾292;低温条件下3 个种质诱变植株的CAT 活性与对照植株相比均无显著差异。
2.6 不同种质不同处理的MDA 活性
如图5-A、图5-B、图5-C 所示,低温处理前,诱变对3 个种质的MDA 含量影响不显著。常蔬特大王在第3 d 诱变植株极显著高于对照(CK)植株,且均极显著高于0 d 的MDA 含量,最终诱变植株和对照植株的MDA 含量均回降,分别显著、极显著高于0 d 水平,但两者间无显著差异,表明低温胁迫下两者的细胞膜受损均加重。
低温处理后,台湾292 诱变植株和对照植株在短期内(2 d 内)的MDA 含量升高,后期对照降至低温处理前的水平,而诱变植株依然显著高于0 d 时的MDA 水平,但诱变植株与对照植株间无显著差异。
剑河大豆诱变植株和对照植株的MDA 含量变化趋势基本一致,均随着低温胁迫时间的延长而上升,短期内(1 d 内)诱变植株MDA 含量显著提升,且极显著高于对照植株;而在中后期诱变植株和对照植株提升的量趋于接近,且均极显著高于0 d的MDA 含量。
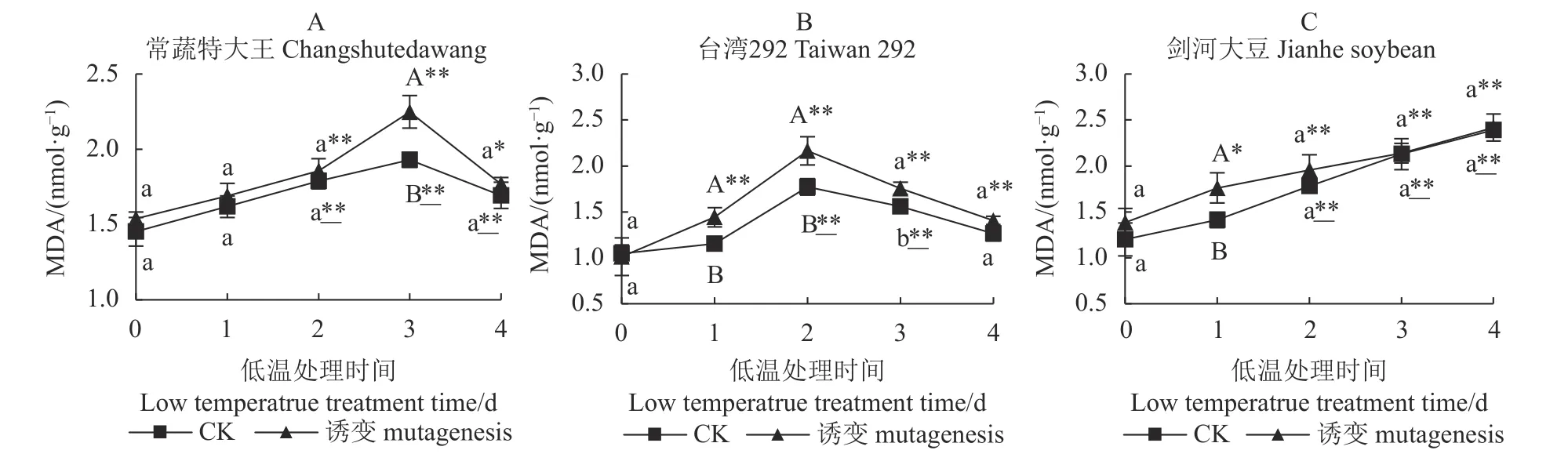
图5 3 个大豆种质诱变植株与对照植株在低温胁迫下的MDA 含量Fig.5 MDA contents of mutant and control soybean germplasms under low-temp stress
综上所述,常温条件下,诱变与对照植株的MDA含量无显著差异,低温胁迫后,除了台湾292 的对照植株在低温胁迫下膜受损不显著外,常蔬特大王和剑河大豆的诱变植株及其对照植株、台湾292 的诱变植株受低温胁迫的影响细胞膜受损均加剧,但常蔬特大王最后呈下降趋势,而剑河大豆呈直线上升趋势。说明常温条件下,叠氮化钠诱变对3 个种质膜脂过氧化损伤均无显著影响;低温条件下3 个种质正常植株膜脂过氧化损伤程度差异表现为:剑河大豆>常蔬特大王>台湾292;低温条件下3 个种质诱变植株膜脂过氧化损伤程度差异表现为:台湾292>常蔬特大王>剑河大豆。
3 讨论
前人在对NaN3诱变条件的研究中,得出不一样的结果。喻晓[20]对大百合鳞片进行离体处理试验,结果表明:3 mmol·L-1处理3 h 效果最佳;马玉涵等[21]以不同浓度叠氮化钠浸泡蝴蝶兰类原球茎后进行组织培养,发现4 mmol·L-1处理6 h 为较合理的浓度及时间;温日宇等[22]测定叠氮化钠对绿豆种子和幼苗生长的诱变效应发现,16 mmol·L-1NaN3处理6 h 绿豆幼苗效果最佳;张兰[23]用NaN3加入培养基处理2 种苹果砧木离体叶片,最佳处理组合分别为0.02 mmol·L-1、3 d 及0.05 mmol·L-1、2 d;苑平[8]用NaN3诱变处理纽荷尔脐橙腋芽3、12、24 h 的半致死浓度分别为12.75、10.48 和9.05 mmol·L-1。由此可见,NaN3处理部位和植物间抗药差异性导致最佳处理浓度不同,对于组培苗及实生苗处理条件差异尤其显著。组培苗较为脆弱,可采取低浓度长时间处理方式;实生苗则宜采取高浓度短时间处理方式。在本研究中,以大豆组培丛生芽为研究对象,因此宜采用低浓度长时间处理方式,并考虑后继低温处理对后效的影响,通过预试验选定略高于半致死处理浓度及时间为最佳处理条件,即0.8 mmol·L-1叠氮化钠处理48 h为适宜处理条件。
叠氮化钠是一种剧毒的细胞呼吸抑制剂[24],可阻断组培苗的能量供给,导致营养缺失[25],使诱导植株产生黄化现象。本研究采用低浓度弱化毒害,延长处理时间有利于组织成活率和诱变丛生芽数提高。姜振峰[10]用0.04 %NaN3处理大豆种子,发现NaN3可抑制过氧化氢酶活性,使细胞代谢迟缓,幼苗生长延滞,出现植株矮化和植株基部弯曲现象,本研究中诱变处理后出现生长受抑制现象与其结果一致。
NaN3诱导处理能够提高胁迫抗性,张兰[23]通过用NaN3诱变提高苹果耐盐性,短期内提高其侧芽萌发率,以及酶活性、蛋白质含量;李波等[26]用经NaN3诱变的苜蓿愈伤组织进行盐碱胁迫,其可溶性蛋白和可溶性糖含量显著增加,本研究的结果与其相似,但种质间存在差异,通过育种改良的种质常蔬特大王和台湾292 的抗胁迫性显著高于地方种质剑河大豆。
NaN3处理纽荷尔脐橙幼芽能提高SOD 和POD活性[8],NaN3处理晋藜种子短时间(2.5 h)内CAT和SOD 随着浓度升高而升高,长时间(7.5 h)CAT活性随着处理浓度的升高而升高,而SOD 活性在高浓度处理时出现下降,NaN3毒害作用超出其自身抗氧化系统的清除范围[27],通常逆境胁迫初期植物体内的活性氧清除系统被激活,其产生的作用超过了活性氧对植物的损伤作用,但是随着胁迫时间的延长,保护酶系统逐渐被抑制,抗氧化酶系统内多种酶之间的活性比不平衡[28]。本研究结合3 个种质大豆抗氧化酶在常温下及低温胁迫下的活性改变及变化趋势可知,NaN3诱变显著提高了台湾292、剑河大豆SOD、POD 活性,常蔬特大王表现无显著变化,表明NaN3对不同的种质效果不同;诱变植株与对照植株低温处理后的抗氧化酶活性表现出不同的变化趋势,低温抗氧化能力以台湾292 表现最佳,POD活性有较大提升,常蔬特大王在诱变前后及低温处理前后其抗氧化性表现稳定,剑河大豆相对于对照SOD、POD 降低较多,表明NaN3加强了台湾292、剑河大豆2 个种质的常温抗氧化性,而低温处理会降低剑河大豆中诱变所带来抗氧化酶活性的提升,甚至低于对照,常蔬特大王抗氧化酶活性对NaN3诱变不敏感。
MDA 通常作为脂质过氧化指标,表示细胞膜脂过氧化程度和植物对逆境条件反应的强弱[17]。其含量越高表明细胞膜脂过氧化程度越高,受到的伤害越严重。由MDA 可知,常蔬特大王整体表现良好,在中后期诱变植株膜脂过氧化程度暂时较高,但其抗氧化系统能很快调整,降至与对照同等水平。低温胁迫下,台湾292 诱变植株膜脂过氧化水平提高,在低温胁迫的第1~2 d 不断上升,对应于初期的SOD活性下降,第3~4 d 的MDA 含量下降,可能与后期POD 活性上升有关。剑河大豆诱变及对照植株的膜脂过氧化程度持续上升,而剑河大豆对照植株的抗氧化酶活性高,很可能是其膜脂氧化程度高导致的,前期诱变植株的MDA 含量显著高于对照,很可能是底物浓度的提升导致SOD、CAT 活性显著提升,后期的SOD、POD 活性低于对照,膜脂过氧化水平与对照持平。而3 个种质的MDA 含量增加的趋势与抗氧化酶活性提升趋势一致则是由于膜脂过氧化造成底物浓度增加,抗氧化酶活性表达相应提升,两者之间存在一定的相关性。
作为人工育种改良种质的台湾292 表现较好,诱变可提升其常温抗氧化能力,诱变后虽然低温胁迫下其膜脂过氧化程度有所提升,SOD 活性降低,但POD 活性得到较大提升,相应的抗氧化能力较高;同为人工育种改良种质的常蔬特大王综合表现中等,其低温抗氧化能力在诱变前后及低温处理前后均无显著差异,表现稳定,表明诱变对其性状改良潜力较小;而地方种质的剑河大豆,在常温条件下诱变显著提高了部分抗氧化酶活性,诱变及正常植株低温下膜脂过氧化损伤程度均较严重,正常植株低温胁迫下SOD、POD 活性提升显著,而诱变植株SOD、POD 活性低于对照植株,表明诱变对地方品种抗氧化酶活性影响较大,但在不同的温度条件下,抗氧化酶活性表现差异显著,常温条件下诱变有利于其抗氧化酶活性的提升;但在低温胁迫条件下,最初诱变所带来的抗氧化酶活性的提升效果不但没有保留或加强,与正常植株相比,抗氧化酶活性反而下降。说明对于未经改良的地方种质诱变产生的变异效果较强,易产生有利变异,也易产生不利变异,而在不同的环境条件下变异是有利还是不利的也是相对的,需结合其他育种措施对其性状进行改良。
4 结论
Bhagwat 等[29]认为,通过半致死剂量确定适宜的诱变浓度并不是绝对合适的,还要综合考虑处理后材料的恢复、增殖、再生和变异情况。本试验中由于低温降低诱变处理后效,对于4℃低温胁迫NaN3诱变的适宜浓度及处理时间为0.8 mmol·L-1处理48 h。
低温胁迫下3 个种质在渗透调节物质含量及光合色素合成上,诱变植株均高于对照植株,种质差异表现为:台湾292>常蔬特大王>剑河大豆。常蔬特大王、台湾292 为育种措施改良的品种,剑河大豆为地方种质,可见前人的改良效果显著。
常温条件下诱变能显著提高台湾292、剑河大豆的SOD、CAT 活性,其他指标无明显差异,表明诱变对于这2 个种质的常温条件下抗氧化性的提升作用高于对常蔬特大王的作用。
3 个种质的对照(正常植株)在低温处理后(4 d),与0 d 对比:剑河大豆的SOD 活性提升较大,POD活性3 个种质均有提升,CAT 活性在台湾292 中出现下降,此结果表明:在正常植株中,低温胁迫下剑河大豆抗氧化能力提升较其他2 个种质强,其次为常蔬特大王,台湾292 表现最弱。在诱变植株中,剑河大豆SOD、POD、CAT 活性虽然与0 d 相比无显著差异,但其SOD、POD 活性显著低于对照植株,表明诱变对剑河大豆在低温胁迫下的抗氧化能力有不利影响;常蔬特大王表现为诱变植株与对照植株无显著差异,表明诱变对其抗氧化活性影响不明显;台湾292 的诱变植株表现为低温胁迫降低了诱变所带来的SOD 活性的提升水平,但诱变植株相对于对照植株提升了低温胁迫下的POD 活性。因此,诱变对于3 个种质的低温抗氧化能力影响程度不一样,与对照植株相比,台湾292 表现较好,SOD活性降低,POD 活性提升、CAT 活性差异不明显;常蔬特大王表现稳定,无明显差异;剑河大豆表现较差,SOD、POD 活性降低,CAT 活性差异不明显。
常蔬特大王MDA 含量在第3 d 诱变植株与对照植株出现极显著差异,表明在后期短时间膜脂过氧化程度较高,台湾292 诱变植株的膜脂过氧化高于对照的延续时间较长,在第4 d 回到两者无差异水平,但诱变植株的MDA 含量显著高于低温处理前;而剑河大豆前期(1 d)诱变植株膜脂过氧化显著高于对照,后期诱变及对照植株的MDA 含量无显著差异。此外,在整体变化趋势上,常蔬特大王和台湾292 的MDA 含量表现为先升高后降低;诱变植株相对于对照植株,台湾292 膜脂过氧化提升水平高于常蔬特大王及剑河大豆,剑河大豆一直保持升高趋势,其膜脂过氧化并未得到缓解,但其水平基本与对照一致。低温条件下3 个种质的膜脂过氧化提升趋势与抗氧化酶活性提升趋势一致。
综上所述,在渗透调节物质含量及光合色素合成上,诱变植株均高于对照植株,种质差异表现为:台湾292>常蔬特大王>剑河大豆,常温条件下叠氮化钠诱变能显著提高台湾292、剑河大豆的SOD、CAT 活性,但对常蔬特大王的3 种酶活性影响均不显著;正常植株低温抗氧化能力种质间差异表现为:剑河大豆>常蔬特大王>台湾292;诱变后低温抗氧化能力的种质间差异表现为:台湾292>常蔬特大王>剑河大豆。膜脂过氧化提升水平的种质间差异表现为:台湾292>常蔬特大王>剑河大豆。可见:对大豆丛生芽用0.8 mmol·L-1叠氮化钠处理48 h,可以有效提高不同大豆种质的低温耐受性,不同种质诱变效果存在差异,总体上表现为:台湾292>常蔬特大王>剑河大豆。
