洁白胶囊生产过程中不同灭菌工艺对产品质量的影响
2020-10-30杨琪琪董建斌王兰霞朱旭江李士博
杨琪琪,董建斌,王兰霞,朱旭江,李士博
(1.甘肃中医药大学,甘肃 兰州730000;2.兰州和盛堂制药股份有限公司,甘肃 兰州 730000;3.甘肃省药品检验研究院,甘肃 兰州 730000)
洁白胶囊为藏族验方,是2015版《中国药典》一部中收载的“洁白丸”的改进剂型,处方中包含14味药材,除五灵脂膏外,诃子等十三味药材均以原粉入药[1]。在生产过程中,以药材原粉入药的中药制剂要求控制微生物水平[2]。实验研究发现,市售洁白胶囊和进入生产车间灭菌前的洁白胶囊原粉的HPLC图谱有较大差异,主要表现在图谱中某些色谱峰的升高或降低。查阅相关文献[3-8]发现,洁白胶囊处方中药材多含挥发性成分,实验组推测可能是在灭菌过程中由于灭菌温度控制不当,造成药品中某些成分的损失。为进一步较好地控制生产过程,细化工艺参数,课题组提出“中药制剂生产过程中微生物质量管理和质量保证”的研究内容,尝试优化洁白胶囊等含挥发性成分的中药制剂生产过程中的低温灭菌工艺,既能保证微生物限度合格,也能使产品质量有所保障。
1 仪器与试药
1.1 仪器
高效液相色谱仪:HITACHI Chromaster(日本日立);色谱柱:资生堂CAPCELL PAK MG C18(250 mm×4.6 mm,5 μm);超声波清洗器(昆山市超声波仪器,KQ-500DE);电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂,GZX-9146MBE);十万分之一电子天平(MS205DU)、万分之一电子天平(ME204)均购自瑞士梅特勒公司。
1.2 试药
对照品:没食子酸(110831-200803,90.1%)购于中国食品药品检定研究院,鞣花酸(72340010,99.9%)购于上海安谱实验科技股份有限公司;磷酸(分析纯);实验水(超纯水);乙腈(进口色谱纯)。洁白胶囊原粉由甘肃某药企提供。
2 方法和结果
2.1 灭菌工艺
参考2015年版《中国药典》,若药品中的相关物质对热不敏感,可首选过度杀灭法进行灭菌,若药品中相关物质对热敏感,其灭菌方法的选择取决于在一定的时间内,一定的生产批次的被灭菌物品微生物污染的水平及其耐热性[9],且结合相关文献,一般药物灭菌时温度不高于80 ℃为宜[10],实验组选定6个灭菌工艺(见表1),经过灭菌后,比较6种灭菌工艺的微生物水平。

表1 洁白胶囊灭菌工艺
将混合均匀的洁白胶囊原粉称取约50 g,每个编号2份平行样品,共12份样品(1份做微生物水平实验,1份做HPLC图谱实验),装入清洗干净灭过菌(防止外源性污染造成实验数据的不可靠)的玻璃容器中,按表1编号对试验样品进行编号,准备工作完成后,将准备好的样品置于电热鼓风干燥箱中按上述灭菌条件对样品进行灭菌,比较微生物水平,结果见表2。
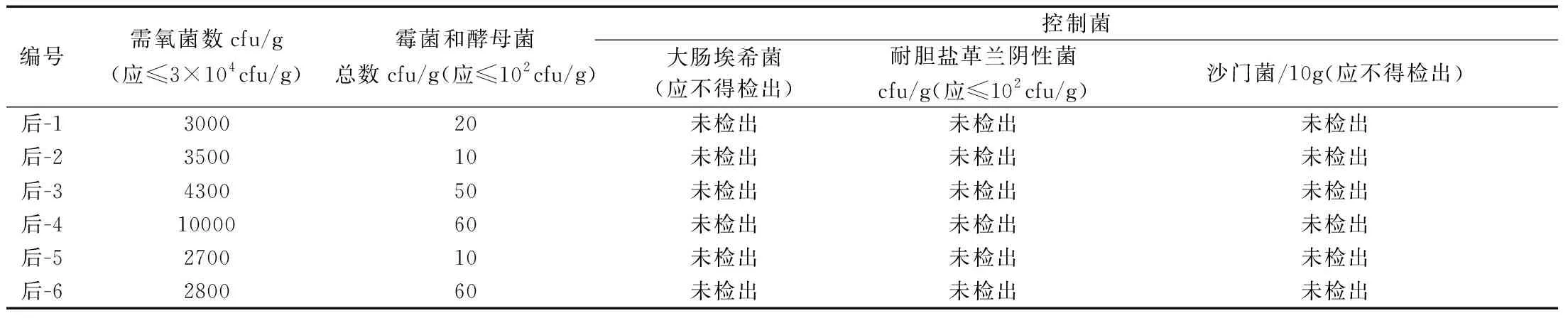
表2 不同灭菌工艺微生物水平实验结果
由表2可以看出,6种灭菌工艺均符合2015年版《中国药典》对含药材原粉的中药制剂的微生物限度的要求,因此,对热敏感成分的中药制剂可采用低温灭菌,但具体采用哪一种灭菌工艺,还需要进行HPLC图谱的比较,灭菌前后无明显变化则为最佳灭菌工艺。
2.2 HPLC图谱
2.2.1 色谱条件 色谱柱:资生堂CAPCELL PAK MG C18色谱柱;流动相:乙腈-0.05%磷酸水溶液梯度洗脱(见表3);流速:1.0 mL/min;进样量:10 μL;波长:254 nm;柱温:30 ℃。

表3 梯度洗脱程序
2.2.2 对照品溶液配制 采用称量盘精密称取鞣花酸16.53 mg,用80%甲醇溶解并定容至50 mL容量瓶中,作为储备液Ⅰ;另同法称取没食子酸对照品21.35 mg,用80%甲醇溶解并定容至25 mL容量瓶中,作为储备液Ⅱ;从储备液Ⅰ中精密量取8 mL,储备液Ⅱ中精密量取1 mL,定容至10 mL容量瓶中,即得浓度分别为0.264 215 52 mg/mL的鞣花酸和0.076 945 4 mg/mL的没食子酸混合对照品溶液。
2.2.3 样品溶液制备 精密称定6个编号洁白胶囊原粉0.2 g(见表4),置于锥形瓶中,精密加甲醇20 mL,称重后超声处理30 min,冷却后用甲醇补足失重,混合均匀后静置,取续滤液,即得。

表4 洁白胶囊不同灭菌工艺的取样量
2.2.4 测定方法 分别精密吸取上述两种溶液各10 μL,注入液相色谱仪,按“2.2.1”项下色谱条件进样测定,以鞣花酸色谱峰的保留时间和峰面积为1,计算其他各峰的相对保留时间和相对峰面积,结果见图1和表5、表6。

图1 HPLC色谱
由图1、表5、表6可以看出,样品在灭菌前后色谱峰的个数并未增加或减少,只是原有色谱峰的相对峰面积发生变化,表6所示,灭菌工艺2和5两者相对峰面积更接近于灭菌前的相对峰面积,考虑到节约成本等实际生产情况,选择灭菌工艺2(灭菌温度60 ℃,灭菌时间12 h)为最佳灭菌工艺。
2.2.5 方法学考察 (1)专属性考察。取灭菌工艺2的供试品溶液10 μL、混合对照品溶液,按上述色谱条件进样分析,记录色谱,结果见图1。通过专属性实验结果表明该分析方法能正确检测所指认的特征峰,该方法可行。
(2)精密度考察。取灭菌工艺2的洁白胶囊原粉约0.2 g,精密称定,按照“2.2.3”项下处理,连续进样6次测定,以鞣花酸色谱峰为参照峰,计算峰1~峰11的相对保留时间和相对峰面积,并计算RSD值,实验结果见表7和表8。实验结果显示,在精密度考察中,连续6次进样的色谱峰相对保留时间RSD在0.001%~0.002%范围内,相对峰面积RSD在0.001%~0.022%范围内,表明仪器精密度良好。
(3)重复性考察。取灭菌工艺2的洁白胶囊原粉,约0.2 g,平行6份,精密称定,按照“2.2.3”项下方法处理,以8号峰鞣花酸色谱峰为参照峰,计算峰1~峰11的相对保留时间和相对峰面积,并计算RSD值,实验结果见表9和表10。
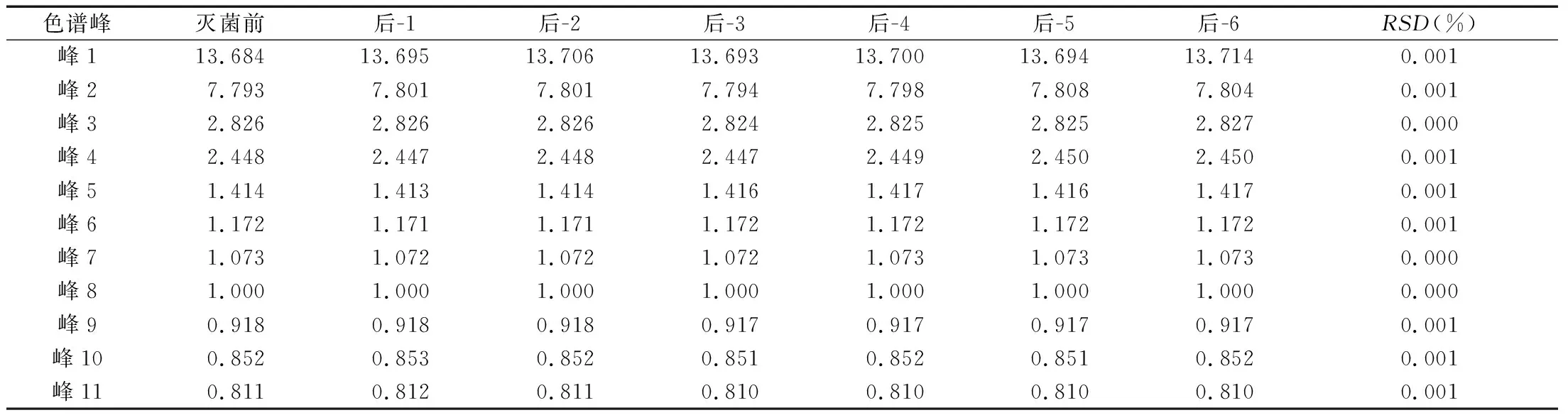
表5 灭菌前后相对保留时间数据对比

表6 灭菌前后相对峰面积数据对比
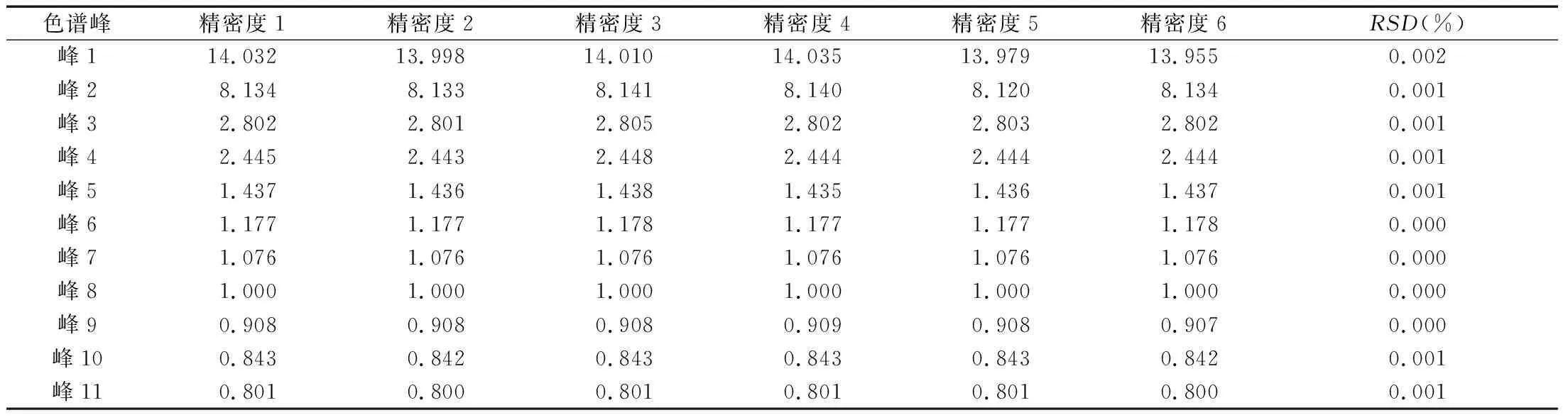
表7 洁白胶囊样品精密度考察结果(相对保留时间)

表8 洁白胶囊样品精密度考察结果(相对峰面积)

表9 洁白胶囊样品相对保留时间重复性考察结果

表10 洁白胶囊样品相对峰面积重复性考察结果
实验结果显示,6份供试品溶液中11个特征峰相对保留时间RSD在0.001%之内,相对峰面积RSD在0.002%~0.042%范围内,表明该方法重复性良好。
(4)稳定性考察。取灭菌工艺2的洁白胶囊原粉,取约0.2g,精密称定,按“2.2.3”项下处理,分别在0、4、8、12、24 h进样分析,以8号峰鞣花酸色谱峰为参照峰,计算峰1~峰11的相对保留时间和相对峰面积,并计算RSD值,实验结果见表11和表12。
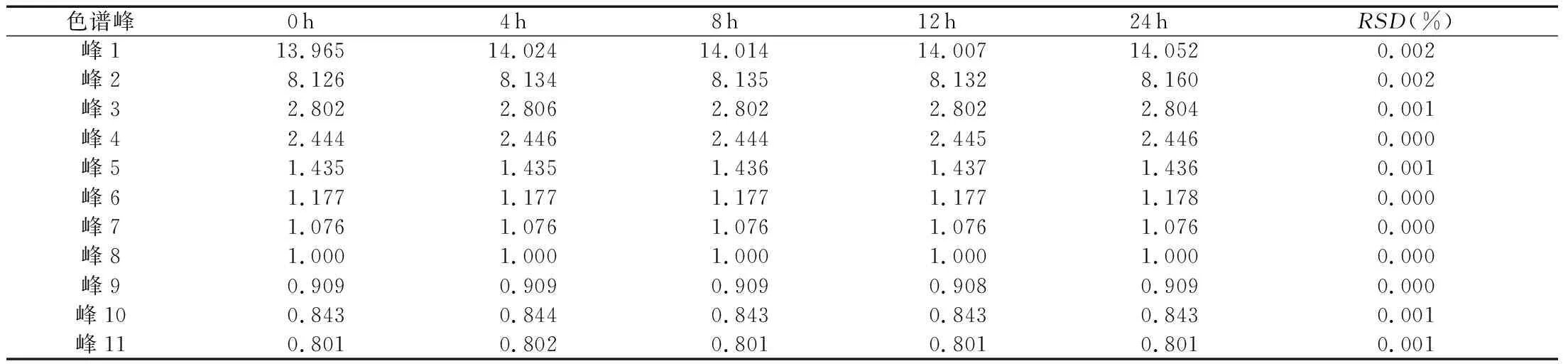
表11 洁白胶囊样品相对保留时间稳定性考察结果 (min)
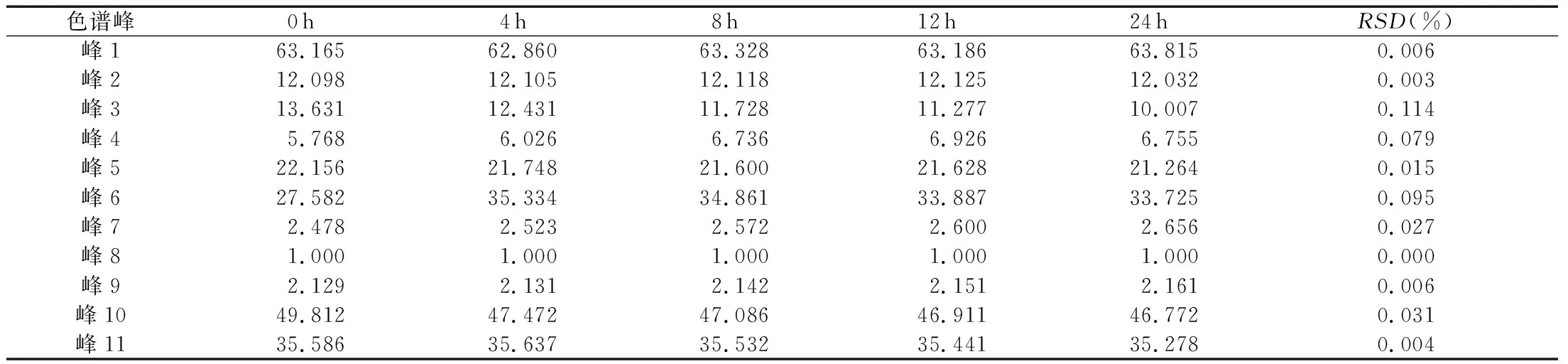
表12 洁白胶囊样品相对峰面积稳定性考察结果
实验结果显示,供试品溶液在24 h内11个特征峰相对保留时间RSD在0.001%~0.002%之内,相对峰面积RSD在0.003%~0.114%范围内,表明供试品溶液在24 h内相对稳定。
3 讨论
微生物灭菌过程中,样品材料需粉碎成粗粉,过二号筛,以保证样品的均一性,同时实验过程中为了确保样品在灭菌结束后不受外源性污染物的影响,本研究采用阻止微生物通过的橡胶塞,确保实验结果的可靠。相关文献[11]提到,灭菌要求须使F0≥8,对于含挥发性成分的中药制剂,可使F0=8,因受实验条件限制,未能对灭菌工艺进行更细化的研究,期望在后续实验过程中完善这一环节。
经计算,灭菌温度60 ℃,灭菌时间12 h时,灭菌前后没食子酸和鞣花酸含量基本不发生变化,其他灭菌条件下微生物限度虽然也达标,但二者含量与灭菌前相差较大,故不作为最佳灭菌条件考虑。同时HPLC图谱实验过程中,还对样品的提取方式(如提取溶剂、提取时间等)和耐用性(如不同柱温、不同流速等)进行了相应的考察,考察结果显示提取溶剂为甲醇,超声处理30 min时样品峰形较好,且在一定的范围内,不同柱温、不同流速对样品峰形峰面积并无太大影响,说明该方法耐用性好,可作为HPLC图谱过程控制方法。
通过以上研究发现,6种不同的灭菌工艺对洁白胶囊原粉的产品质量有不同程度的影响,考虑到实际生产,选取灭菌工艺2(灭菌温度60 ℃,灭菌时间12 h)为最佳灭菌工艺,既能保证微生物限度合格,又能控制洁白胶囊的产品质量。
以原粉入药的中药制剂在生产过程中都存在微生物控制这一环节,本试验研究了洁白胶囊的灭菌工艺对产品质量的影响,课题组也对大蜜丸做过类似的比较研究,发现灭菌工艺与制剂类型有一定的相关性,限于时间因素,并未对剂型和灭菌工艺的相关性做进一步研究,后续实验会以此为出发点,选取同一种剂型的多种中成药进行详细研究,从特殊中找到一般规律,为企业生产过程中微生物的控制提供技术指导。
