丹参、泽泻对非酒精性脂肪肝大鼠氧化应激和血管内皮的影响
2020-10-30郭建利彪雅宁张一昕
路 帅,郭建利,彪雅宁,张一昕,3,石 铖,刘 晨,韩 雪,3*
(1.石家庄医学高等专科学校 药学系,河北 石家庄 050599;2.河北中医学院 药学院,河北 石家庄 050200;3.河北省高校中药组方制剂应用技术研究中心,河北 石家庄 050091)
非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)以广泛性肝细胞呈现较大空泡性脂肪变性和脂肪大量蓄积为主要表现,且无过量饮酒史的代谢性疾病[1-2]。由于生活水平提高,不良饮食习惯,日益增加的工作压力,网络信息环境的冲击等,NAFLD发病率逐年升高[3],患者出现内皮功能失调,进而引发动脉粥样硬化[4-5]。
中医基本理论将非酒精性脂肪肝归属于“痰浊”“血瘀”“症瘕”“积聚”等范畴。本研究认为,痰湿、瘀血为NAFLD主要病理基础,以活血消痰为根本治法。丹参功效为活血祛瘀、凉血消痈、养血安神,丹参所含脂溶性成分如丹参酮能改善血液循环、抗菌消炎,水溶性成分具有抗氧化、抗凝血、抗血栓、调节血脂等作用[6]。泽泻能够利水湿、消痰浊,以萜类为主要化学成分,具有降血糖、抗血栓和抑制斑块等作用[7]。本课题主要探究丹参、泽泻及丹参配伍泽泻对NAFLD大鼠的保护作用是否与改善氧化应激水平和血管内皮功能有关,现报告如下。
1 材料
1.1 动物
雄性SD大鼠60只,体质量:(200±20)g,购于河北医科大学动物实验中心(合格证号:1603048)。
1.2 药物
丹参、泽泻购于河北省石家庄市乐仁堂药店,水煎至所需浓度;东宝甘泰片购于通化东宝药业股份有限公司(批号:151204)。
1.3 试剂
游离脂肪酸(FFA)、甘油三酯(TG)、胆固醇(TC)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)试剂盒购于北京中生生物工程技术公司(批号分别为201611、201615、201605、201609、201602);超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒购于南京建成生物工程研究所(批号:201611、201605);内皮素(ET-1)、6-酮-前列腺素F1α(6-Keto-PGF1α)、血栓烷B2(TXB2)放射免疫试剂盒购于北京普尔伟业生物科技有限公司(批号分别为201601、201612、201615)。
2 方法
2.1 分组
60只大鼠随机分为6组:正常组(C)、模型对照组(M)、丹参水煎剂组(S,5 g·kg-1)、泽泻水煎剂组(R,3.33 g·kg-1)、丹泽水煎剂组(SR,8.33 g·kg-1)、阳性药(东宝甘泰)对照组(D,1.25 g·kg-1),每组10只。
2.2 造模
正常组喂饲普通饲料,其余各组均给予高脂饲料[8](配方:1.5%胆固醇+0.5%胆盐+10%猪油+88%基础饲料),连续9周。
2.3 给药
从造模第1天开始,正常组和模型对照组灌服蒸馏水,丹参水煎剂组、泽泻水煎剂组、丹泽水煎剂组、东宝甘泰组灌服相应药物,每日1次,用药体积为1 mL/100 g,连续8周。
2.4 取材
8周末,4%乌拉坦麻醉,股动脉取血,分离血清待检,同时迅速剖取适宜大小的肝组织于4%多聚甲醛液中固定。
2.5 指标检测
酶法测定血清TC、TG、FFA含量;赖氏法测定 AST、ALT的活性;采用黄嘌呤氧化酶法测定SOD活性;MDA含量测定采用硫代巴比妥酸比色分析法;放射免疫分析法测定大鼠血浆ET-1、6-Keto-PGF1α和TXB2含量。
2.6 统计分析

3 结果
3.1 丹参、泽泻对NAFLD大鼠血清TC、TG、FFA含量的影响
NAFLD大鼠血清TC、TG、FFA的含量较正常组明显升高(P<0.01),证明造模成功,丹参、泽泻、丹泽及东宝甘泰组大鼠血清TC、TG、FFA的含量较模型组均明显降低(P<0.01)。其中,丹泽组TC含量明显低于丹参组和泽泻组(P<0.01)。见表1。

表1 各组大鼠血清TC、TG、FFA的含量
3.2 丹参、泽泻对NAFLD大鼠血清ALT和AST活性的影响
NAFLD大鼠血清ALT、AST的活性较正常组明显升高(P<0.01),丹参、泽泻、丹泽及东宝甘泰组大鼠血清ALT、AST的活性较模型组均明显降低(P<0.01)。其中,丹参组、泽泻组及丹泽组血清ALT的活性均低于东宝甘泰对照组(P<0.01或P<0.05),丹泽组ALT活性明显低于丹参组和泽泻组(P<0.01);丹泽组AST活性低于对照组(P<0.05),丹泽组AST活性明显低于丹参组(P<0.01)。见表 2。
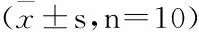
表2 各组大鼠ALT和AST的活性
3.3 丹参、泽泻对NAFLD大鼠血清SOD和MDA活性或含量的影响
NAFLD大鼠SOD的活性较正常组明显降低,MDA的含量较正常组明显升高(P<0.01),丹参、泽泻、丹泽及东宝甘泰组SOD的活性均明显升高(P<0.01),MDA的含量明显降低(P<0.01)。丹参和泽泻组血清SOD的活性均低于东宝甘泰对照组(P<0.01);丹泽组在升高SOD的活性、降低MDA含量方面的作用明显优于丹参组和泽泻组(P<0.01)。见表3。
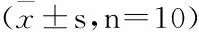
表3 各组大鼠SOD和MDA的活性或含量
3.4 丹参、泽泻对NAFLD大鼠肝组织形态学的影响
结果显示(如图1所示):正常组大鼠肝细胞为多边形,排列呈放射状,较为整齐,无肿胀及脂肪变性。模型组大鼠肝细胞显现中度水肿,发生明显的脂肪变性,部分肝细胞中脂滴融合成大的脂肪空泡。各给药组肝细胞脂肪变性程度均有所减轻。

注:A.正常组;B.模型组;C.东宝甘泰组;D.丹参组;E.泽泻组;F.丹泽组。
3.5 丹参、泽泻对NAFLD大鼠血浆ET、6-Keto-PGF1α和TXB2含量的变化
NAFLD大鼠血浆ET含量较正常组明显升高(P<0.01)。丹参、泽泻、丹泽及东宝甘泰组大鼠血浆ET含量较模型组明显降低(P<0.01)。其中,丹参组、泽泻组和丹泽组的血浆ET含量均低于东宝甘泰对照组(P<0.01或P<0.05),而丹泽组血浆ET含量明显低于丹参组和泽泻组(P<0.01)。见表4。
NAFLD大鼠血浆6-Keto-PGF1α含量较正常组明显降低(P<0.01),TXB2含量明显升高(P<0.01)。丹参、泽泻、丹泽及东宝甘泰组大鼠血浆6-Keto-PGF1α含量明显升高(P<0.01或P<0.05),血浆TXB2含量明显降低(P<0.01)。其中,丹泽组血浆TXB2含量明显低于东宝甘泰对照组(P<0.01),而丹泽组血浆TXB2含量低于丹参组和泽泻组(P<0.05)。见表4。
3 讨论
中医基本理论将非酒精性脂肪肝归属于“痰浊”“血瘀”“症瘕”“积聚”等范畴。本研究认为,现代生活水平较高,人们往往嗜食肥甘,又久坐少动,使脾胃运化失调,痰浊内生,气血阻滞,致肝失条达而发为本病,故痰湿瘀血为非酒精性脂肪肝的主要病理基础,故以活血化痰为基本治法[9]。本研究筛选出临床常用的治疗非酒精性脂肪肝的中药丹参和泽泻,丹参活血祛瘀、凉血消痈、养血安神,现代研究证实其具有改善血液循环、抗菌消炎、抗氧化、抗凝血、抗血栓、调节血脂、降低脂质过氧化反应的作用[4-5]。泽泻能够利水湿、消痰浊,具有抗血栓、抗血小板聚集和抑制斑块的作用[7]。

表4 各组大鼠ET-1、6-Keto-PGF1α and TXB2的变化
本实验结果发现丹参、泽泻及丹参配伍泽泻能明显降低NAFLD模型大鼠血清TC、TG、FFA含量,降低ALT和AST的活性,呈现出良好的降脂和保肝作用。FFA可能是氧化应激的根源,高脂饮食,血清FFA大量增加,TG大量蓄积在肝细胞内,使线粒体氧化速度代偿性加快,大量FFA氧化生成 ROS,超过机体抗氧化机制清除能力将引起氧化应激。SOD是体内酶类自由基清除剂,过氧化的产物MDA的大量增加证明机体内脂质过氧化反应增多,导致肝脏炎症、纤维化和肝细胞死亡,从而加重脂肪肝[10]。本实验结果提示丹参、泽泻及丹参配伍泽泻能增强NAFLD大鼠血清SOD活性,降低MDA含量,证明其良好的抗氧化作用。正常情况下ALT和AST存在于肝细胞内,肝脏损伤时,其从肝细胞中释放入血,因而通过检测血清中ALT和AST的活性能够反映丹参、泽泻对NAFLD大鼠肝细胞损伤的保护作用[10]。本实验中丹参、泽泻及丹参配伍泽泻能降低NAFLD大鼠血清ALT和AST活性,提示其对肝脏具有保护作用。
内皮细胞功能异常会引起血管舒缩失衡、内皮渗透性增加、血小板聚集等。有研究证实:NAFLD患者普遍存在超重、血脂高、肝功异常、空腹血糖偏高及血管内皮细胞功能障碍等[11]。内皮素(ET)、一氧化氮( NO)、血栓素(TXA)、前列环素(PGF)为具有强烈促进血管收缩和舒张作用的血管活性物质,其中,ET与TXA为血管收缩因子,NO与PGF为血管舒张因子,相互协调,维持血管正常的收缩和舒张。非酒精性脂肪肝会引起血管内皮功能异常,如血管舒张因子分泌相对减少,血管收缩因子分泌相对增多[12]。ET在肝脏合成,有3种异构体,其中,在肝脏合成的ET-1是作用最强的一种,其含量增加会引起肝血窦收缩,肝循环障碍及肝细胞缺氧,加重脂质过氧化,直接损伤肝细胞,促进肝纤维化[13-14]。TXB2、6-Keto-PGF1α是人体内微循环调节系统的一部分,二者相互拮抗并协调,防止血栓形成。TXB2增多,6-Keto-PGF1α减少会影响肝脏微循环,导致肝细胞功能障碍,变性坏死及纤维化[15]。
本研究结果显示,丹参、泽泻及丹参配伍泽泻水煎剂能明显改善血中6-Keto-PGF1α、ET、TXB2含量的异常变化,提示丹参、泽泻及丹参配伍泽泻水煎剂可能通过调节ET和6-Keto-PGF1α、TXB2的分泌和释放,达到保护血管内皮功能、降低脂质过氧化的作用,这可能是其防治NAFLD的分子机制之一。
