夏天无醇提物对实验性脑出血大鼠的干预作用及机制研究
2020-10-30潘荣斌占惠唯邹进发
潘荣斌,占惠唯,邹进发,张 迪,陈 乔
(江西中医药大学,江西 南昌 330004)
脑出血(Intracerebral hemorrhage,ICH)是指非外伤性所致的脑实质自发性出血,常见病因有高血压、颅内血管畸形、脑动脉硬化等,其主要症状表现为突然昏迷、半身不遂、口舌歪斜、言语不利或失语、偏麻等[1]。在国内一项流行病学调查统计发现,ICH发病率高达85.4/10万,其病死率更高达41.3%,且患者慢性伤残率为39.1%[2]。可见,ICH已成为目前世界范围内一个危害人类健康的社会问题,研究其发病机制及干预治疗手段具有重要的现实意义。
研究证实ICH最重要病理改变是血肿本身及其继发性周围脑缺血、脑水肿和细胞毒性等损伤[3],其中最常见的是炎性介质和凝血酶变化,参与损伤机制的过程相互作用。由此,保护ICH性脑组织损伤关键在于抗炎及消肿[4]。但目前ICH发生、发展病理机制尚不清楚,且目前治疗方法缺乏循证医学证据及明确病理机制支撑,更缺乏特异性靶向性治疗。在诸多中药材中,夏天无有活血化瘀、消炎止痛的功效,临床实验证实复方夏天无治疗类风湿关节炎疗效好[5],其对炎症反应各个环节,如炎性渗出、炎性介质释放以及炎症后期肉芽组织增生均具有抗炎作用[6]。本课题组运用夏天无醇提物干预ICH模型大鼠,通过神经行为学、病理变化及NF-κB、GFAP、CD34蛋白免疫组化检测,旨在探讨夏天无对ICH大鼠的干预作用及其可能作用机制。
1 材料
1.1 实验动物
实验选用SPF级2月龄健康雄性SD大鼠70只,体重(200±20)g,合格证号为SCXK(湘)2016-0002,购于湖南斯莱克景达实验动物有限公司。环境温度(25±2)℃,相对湿度55%~65%,自由饮水。本实验通过动物伦理委员会审核。
1.2 药品
药品均购于江西省中医院药房。夏天无饮片生药(批号:20150715);脑血康胶囊(山东昊福药业集团有限公司,批号:Z10960009)。
1.3 主要仪器设备
OLYMPUS显微镜系统(日本OLYMPUS公司);石蜡切片机(RM2135型,德国Leica公司);石蜡包埋机(德国Leica公司);真空旋转蒸发仪(上海亚荣生化仪器有限公司);培养性/干燥箱两用箱(上海一恒科技有限公司)。
1.4 主要试剂
DAB显示剂(博士德生物科技有限公司,批号:CW0125M);SABC免疫组化染色试剂盒(博士德生物科技有限公司,批号:12G20B);兔抗鼠NF-κB多克隆抗体(Abcam公司,批号:ab16502);兔抗鼠CD34多克隆抗体(北京博奥森生物技术有限公司,批号:bs-0646R);兔抗鼠GFAP单克隆抗体(北京博奥森生物技术有限公司,批号:bs-0199R)。
2 实验方法
2.1 药液制备
称取夏天无饮片500 g加入500 mL的95%乙醇浸泡过夜后,冷凝回流水浴80 ℃提取30 min,倒出药液,再加入300 mL的95%乙醇提取15 min后倒出,合并药液,转移至旋转蒸发仪浓缩至50 mL,转移至蒸发皿内,烘干形成胶状提取物;后用双蒸水及适量吐温-80溶解,配成相对生药浓度为2、1、0.5 g/mL的药液,于冰箱4 ℃保存备用。用生理盐水将脑血康胶囊配制成浓度为30 mg/mL药液备用。
2.2 动物分组
大鼠适应性饲养1周后,随机分为假手术组、模型组、阳性对照组、用药高、中、低浓度组及术前用药组,每组10只。
2.3 造模
麻醉、备皮、消毒。正中切开颅顶皮肤约1.5 cm,轻轻刮除颅骨表面腱膜及颅骨外膜。参照大鼠脑图谱,在颅顶前囟前0.96 mm,正中矢状线右侧3 mm处切开一个1 mm×1 mm 左右小孔,暴露硬脑膜(注意保护硬脑膜完整)。用37 ℃温水加温鼠尾,待其充血后酒精消毒,断尾取血,迅速用微量注射器吸取新鲜血液50 μL。脑立体定位仪固定微量注射器,调整针尖移至开孔处,以轻微接触硬脑膜为宜,设置Z轴原点,调整Z轴向下移动6 mm[7]。采用二次注血二次退针法进行造模,即先注入10 μL,停针2 min,继续缓慢匀速注入40 μL,留针约4 min,退针2 mm,再停针约4 min,缓慢将注射器完全退出[8]。停针期间,对鼠尾伤口进行消毒止血处理。术后用骨蜡封闭颅骨创口,缝合头皮并用碘伏消毒,防止伤口感染。假手术组大鼠前期操作一致,注血步骤时,仅将针插入,不注射血液。
2.4 给药
所有动物按1次/d、1 mL/100 g量给药。术前用药组于造模前灌胃30 d,夏天无醇提物量相对生药浓度为1 g/mL,高、中、低浓度组生药浓度分别为2、1、0.5 g/mL,阳性对照组脑血康浓度30 mg/mL,模型组及假手术组以等体积生理盐水灌胃即可。以上大鼠均在麻醉清醒后(约术后3 h)开始给药,直至7 d后处死取材。
2.5 神经行为学检测
按Longa法进行大鼠神经行为学评分[9],标准见表1。自造模后第2天开始,对各组大鼠进行神经性行为评价。将大鼠轻置于空旷平坦的地面,不对其行动进行干扰,只观察并记录其运动情况,根据评分标准进行评分。
2.6 HE染色
给药结束后,将大鼠灌注固定并取材[10],取大鼠注血中心点前后2 mm区组织块,包埋后连续冠状位切片,片厚4 μm,修片后,每隔3片取1张,每样本相邻切片分为四套,每套6张,选取一套做常规HE染色,光学显微镜观察。

表1 大鼠神经行为学评分标准
2.7 免疫组化检测
剩余切片用于免疫组化染色,兔抗鼠NF-κB多克隆抗体稀释浓度为1∶200,兔抗鼠GFAP单克隆抗体稀释浓度为1∶400,兔抗鼠CD34多克隆抗体稀释浓度为1∶400。显微镜下(10×40倍)观察注血周围区NF-κB、GFAP及CD34阳性表达情况,每张切片随机选取3个相邻视野,采集图像后,软件Image J2x,计算相应的平均光密度值,以3个视野平均光密度值之和平均数作为一个标本计数值,再以该值对各组大鼠注血尾壳核周边区平均光密度值总数作统计学分析。
2.8 统计学处理
实验数据用(平均数±标准差)表示,采用SPSS 19.0软件进行统计分析,先将数据做正态分布检验以及方差齐性检验,各组间免疫组化结果采用单因素方差分析,方差分析具有显著性时,组间两两比较进行配对t检验,P<0.05为差异有统计学意义。
3 结果
3.1 longa评分结果
参照评分标准,对各实验组大鼠进行各时间段神经行为学评分,因剔除死亡或造模失败原因减员,每组剩余6只进行后续实验,观察预防及治疗效果。

表2 大鼠神经行为学评分
通过大鼠神经行为学评分结果可见,所有实验组与假手术组相比较均具有显著性差异(P<0.01),在药物治疗7 d后,术前用药组及用药低浓度组与假手术组有统计学差异(P<0.05);用药组与模型组相比,阳性对照组、用药高浓度组、用药中浓度组、用药低浓度组在用药前5 d几乎无差别,无统计学意义;用药第6天,阳性对照组、用药高浓度组、用药中浓度组、用药低浓度组与模型组均有统计学差异(P<0.05);用药第7天,阳性对照组、用药高浓度组、用药低浓度组与模型组均有统计学差异(P<0.05);术前用药组与模型组相比,第1、2、4天时,与模型组均有统计学差异(P<0.05),第7天时,与模型组有显著性差异(P<0.01)。
3.2 夏天无醇提物对组织实验性ICH注血周围区脑组织病理形态学影响结果(HE染色)
假手术组注血区周围组织紧密,细胞形态完整,染色均匀,脑白质完整,边界清晰,核仁清晰明显,胞质均匀;模型组注血区周围组织较为松散,坏死细胞较多,细胞核浓缩,胞质淡染,脑白质受损严重,边界模糊,出现水肿现象;各给药组注血区周围组织紧密程度不一,但均较模型组更为紧密,细胞坏死程度不一,但均较模型组少;伊红染色较为均匀,均没有出现浓染,脑白质均受到一定程度的损伤,但没有模型组严重,部分边界清晰。
不同浓度给药组差异明显,用药高浓度组注血区周围组织最为紧密,用药中浓度组次之,用药低浓度组最为松散;用药高浓度组形态完好的细胞最多、坏死细胞最少,用药低浓度组形态完好细胞最少、坏死细胞最多;三组伊红染色都较为均匀,未出现伊红浓染情况,用药高浓度组脑白质受损最轻,部分边界清晰,用药中浓度组脑白质受损程度居中,边界较为模糊,用药低浓度组脑白质受损较为严重,边界模糊,详见图1。
3.3 夏天无醇提物对大鼠尾壳核周边区NF-κB蛋白表达的影响(免疫组化)
在药物治疗7 d后,所有大鼠处死取材尾壳核手术区周围NF-κB蛋白表达随着炎症程度的升高而增加,与假手术组相比,实验组均有统计学差异(P<0.05),其中与模型组、术前用药组、用药中浓度组、用药低浓度组有显著性差异(P<0.01);与模型组相比,阳性对照组、术前用药组均有显著性差异(P<0.01),用药高浓度组、用药低浓度组有显性差异(P<0.05),而用药中浓度组差异无统计差异(P>0.05)。详见表3。
3.4 夏天无醇提物对大鼠尾壳核周边区GFAP蛋白表达的影响(免疫组化)
假手术组脑组织GFAP阳性表达细胞较少,染色浅,细胞规则,轮廓清晰,分布较为规律。模型组脑组织GFAP阳性细胞表达最多,表达量最高,同时在形态上,细胞胞体增大,突起明显且不规则,部分呈簇状分布,与用药组及假手术组相比,均有显著性差异(P<0.01),具统计学意义。数据显示,GFAP表达量与用药浓度成反比,详见表3。
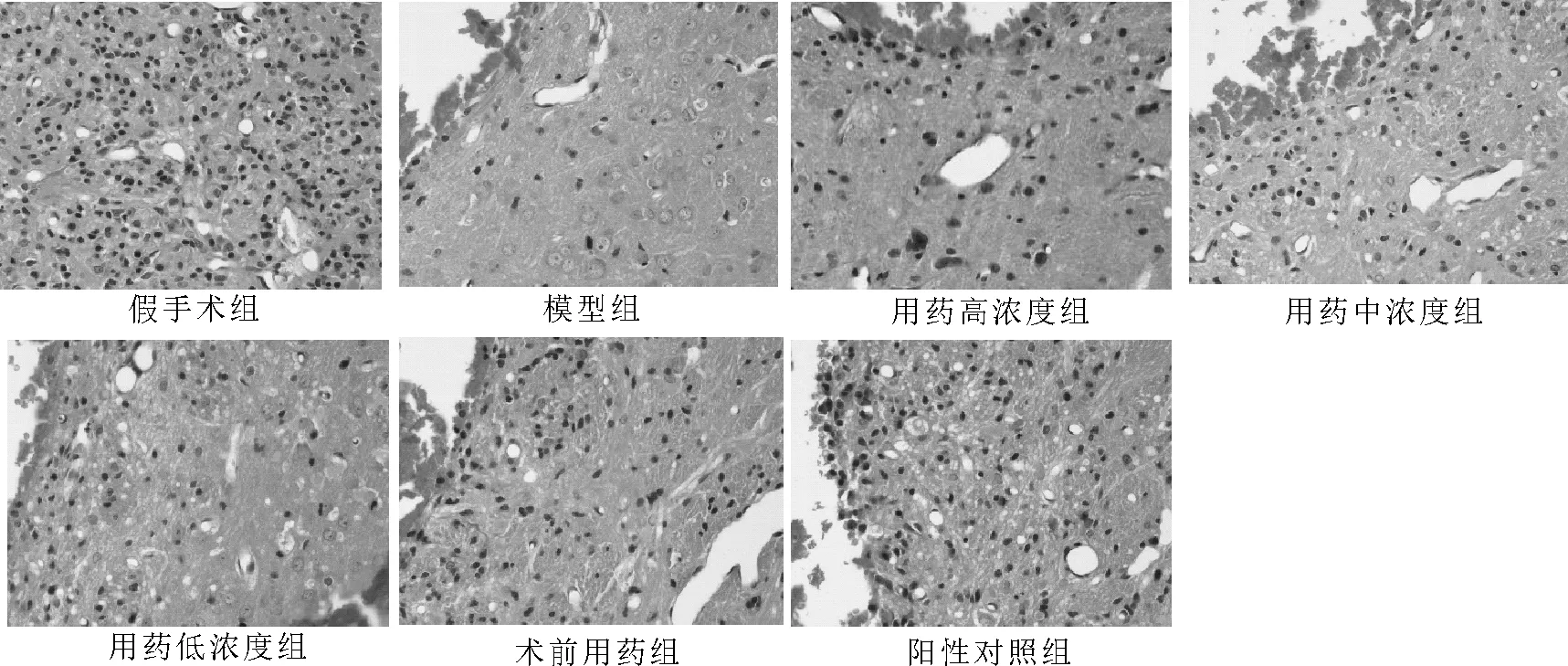
图1 夏天无醇提物对组织实验性ICH注血周围区脑组织病理形态学影响(HE染色10×40)
3.5 夏天无醇提物对大鼠尾壳核周边区CD34蛋白表达的影响(免疫组化)
各组间比较差别有统计学意义,其中假手术组CD34阳性微血管数较少,模型中表达量最高,用药干预组与阳性用药对照组均低于模型组,在用药组织CD34的表达与浓度呈一定的反比关系,见表3。
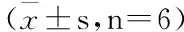
表3 夏天无对大鼠尾壳核周边区NF-κB、GFAP、CD34蛋白表达的影响
4 讨论
ICH作为致死率与致残率极高的一类疾病,在全球发病率为10~30人/10万[11],占脑卒中总数的10%~15%。Flaherty ML等[12]对ICH患者进行了2个队列研究,统计发现,1周的病死率为30%,1年内病死率为50%以上,该研究组随后对183名患者进行10年随访,其病死率高达82%。ICH导致如此高死亡率最重要的病理改变是血肿本身及其引发的继发性周围脑缺血和脑水肿及细胞毒性等损伤[1]。Hua等[13]认为出血后的血肿占位并不是引起ICH损伤的关键因素,而出血后脑水肿所引起的继发性伤害及释放的活性物质是造成ICH损伤的主要因素,其中最常见的是炎性介质和凝血酶的变化,而参与损伤机制的过程又相互作用,由此,保护ICH性脑组织损伤的关键在于抗炎及消肿。核转录因子(NF-κB)作为一个重要介质激活和释放多种炎症介质参与ICH后的炎症反应,造成脑损伤[14]。一方面可以促进炎性因子IL-1β、ICAM-1等的表达[15],另一方面,上调MMP-9的表达,破坏血脑屏障,加重血管源性脑水肿[16]并促进细胞凋亡的发生[17]。胶质纤维酸性蛋白(GFAP)作为星形胶质细胞的特异性标志物,检测GFAP蛋白表达变化,可以有效反映星形胶质细胞反应性增生情况及神经系统损伤程度[18]。在出现脑出血情况时,出血区周围组织水肿、缺血缺氧,刺激星形胶质细胞对GFAP的合成,并增加神经营养因子的分泌[19],以提升神经元短期内的耐受性;随着后期炎症的加剧,星形胶质细胞受损GFAP向周围弥散,形成片区分布。CD34分子是一类高度糖基化的i型跨膜糖蛋白,在众多炎症反应中异常出现表达,介导白细胞的聚集,启动炎症反应,同时协同趋化因子作用增强炎症反应[20]。
大鼠脑血管解剖结构与人类相似,尾壳核是脑内最大核团,易于定位且位于基底节,是人类高血压ICH的好发部位[21]。采用自体血注入尾壳核法制作的ICH模型进行的研究发现,ICH后的继发性脑损害和水肿形成的机制是多方面的,同时,大鼠未肝素化模型产生的水肿比肝素化模型严重[22]。因该模型产生效果与临床病症相似,自体血注入尾壳核法用于制作ICH模型,相比其他方法而言,实验结果将更加可靠,具有稳定性以及可复制性[23-25],已被大多数研究所采用。
传统中药夏天无临床常用于治疗脑梗死,周围神经损害性瘫痪、腰椎间盘突出症、痴呆、坐骨神经痛、关节腰腿等疼痛等[26-30]。将夏天无应用于大鼠实验性脑血栓模型中发现,夏天无能够抑制血栓的形成,减轻脑血栓引起的脑水肿及脑损伤[31],并有相关研究表明夏天无对喹啉酸损毁海马所致大鼠学习记忆障碍具有明显的改善作用[32]。
本实验设置术前用药组,术后高、中、低用药干预组,阳性对照组等不同组别,采用神经行为学评价、HE染色形态学观察及免疫组化检测进行效果评价。结果显示,夏天无术前给药30 d后,能够较大程度缓解自体血注射对大鼠行为学变化及降低注血周围区NF-κB、GFAP及CD34蛋白的表达,即表明夏天无醇提物具有一定程度的ICH预防作用。从不同时间段各组大鼠神经行为学变化可以发现,随着给药时间的延长,恢复速度逐渐增强,分析原因可能与用药干预及大鼠自体恢复共同作用的结果。最后,不同浓度夏天无给药干预后,NF-κB、GFAP、CD34蛋白表达存在明显差异,初步结果显示,NF-κB、GFAP、CD34蛋白表达与给药浓度呈负相关性,即给药浓度越高,NF-κB、GFAP、CD34蛋白越少,反之亦然。此现象表明,夏天无醇提物对实验性ICH具有治疗作用,能够改善实验性脑出血大鼠行为学作用,用药后ICU区病变程度降低,NF-κB、GFAP、CD34蛋白表达减少。由此得出结论:夏天无醇提物对脑出血大鼠具有预防和治疗作用,推测其神经保护作用机制可能与抑制脑出血处血栓形成及消除炎症反应相关。
