表没食子儿茶素没食子酸酯的辐射防护作用及其机制研究进展
2020-10-30刘丽波
薛 琦 王 曼 刘丽波
(吉林大学公共卫生学院 国家卫生健康委员会放射生物学重点实验室 长春130021)
肿瘤是严重威胁人类生命及健康的常见病、多发病。癌症统计数据显示,2018 年全球新增肿瘤病例1 810 万,死亡病例960 万。根据世界卫生组织的估计,在多个国家中恶性肿瘤是70 岁前死亡的首要原因[1]。放射治疗是恶性肿瘤的主要治疗手段之一,也是目前恶性肿瘤重要的局部治疗方法。射线在杀死肿瘤细胞的同时,对机体的正常组织细胞也造成了不同程度的损伤。因此,寻找低毒、安全、有效的辐射防护剂来减轻放射治疗引起的毒副反应,成为了辐射防护药物研究的热点。 表没食子儿茶素没食子酸酯(Epigallocatechin-3-gallate,EGCG)是从天然茶叶中提取的单体,也是绿茶茶多酚的主要成分及活性成分,具有抗肿瘤、抗病毒、抗炎和抗氧化损伤等作用。本文将对EGCG 的辐射防护作用及其机制进行综述。
1 EGCG的辐射防护作用
1.1 EGCG对造血系统的辐射防护作用
造血系统中的骨髓、胸腺、脾脏和淋巴组织均属于高度辐射敏感器官,被辐照后造血系统的功能会明显受到抑制。电离辐射可引起SD大鼠外周血红细胞(RBC)、白细胞(WBC)和血小板(PLT)等血象指标显著降低[2]。Tiwari等[3]对C57小鼠进行了5 Gy 亚致死剂量照射,然后对小鼠进行腹腔注射EGCG,在照后不同时间(1 d、7 d、14 d、21 d 和28 d)观察EGCG 对C57 小鼠WBC、RBC、血红蛋白(Hb)及淋巴细胞百分比的影响。该研究结果表明:与单纯照射组相比,EGCG组小鼠的WBC 数、RBC 数、PLT 数以及淋巴细胞百分比均明显增加,其中WBC 数(p<0.05)与淋巴细胞百分比(p<0.01)的增加均具有统计学意义,并且淋巴细胞百分比恢复的时间较其他指标更早。郭绍来等[4]采用60Co γ射线照射小鼠,构造了小鼠亚急性辐射损伤模型。分别在给予不同剂量EGCG后的1 d、3 d、7 d、14 d、21 d 和28 d 检测了小鼠外周血象指标。检测结果显示:单纯照射组小鼠的WBC数、RBC数和PLT数均明显降低;而EGCG处理可明显缓解小鼠由于辐射损伤所造成的全血象指标下降。Monzen等[5]研究了EGCG对人胎盘/脐带血中粒细胞生成和红细胞生成的辐射防护作用,采用1 Gy/min剂量率的X射线(0.5~5.0 Gy)照射细胞,在照射之前或之后,将EGCG 添加到培养物中。研究人员观察到:与单纯照射组结果相比,照射之前或之后添加EGCG 对红细胞集落形成以及粒系祖细胞具有增殖作用。上述动物实验及体外细胞实验均表明EGCG 对造血系统具有辐射防护作用。但现有文献多以造血系统中的血细胞作为衡量辐射防护作用的指标,其他如EGCG对骨髓造血干细胞以及造血微环境的影响尚不明确,EGCG 恢复血细胞的具体作用机制尚不清楚等,还有待进一步研究。
1.2 EGCG对免疫系统的辐射防护作用
电离辐射可抑制胸腺细胞和淋巴细胞的生长,能够阻碍淋巴细胞的成熟,减少淋巴细胞分泌细胞因子等,从而导致机体免疫系统损伤[6]。Richi等[7]研究了EGCG对小鼠脾细胞的辐射防护作用。与单纯照射组的结果相比,EGCG预处理增加了脾细胞活力(MTT法检测),减少了辐照导致的细胞死亡,同时EGCG 预处理降低了硫代巴比妥酸反应物质(TBARS)的水平,抑制了细胞的脂质过氧化反应。以上结果表明:EGCG对正常小鼠脾细胞具有辐射防护作用。Yi 等[8]在6 Gy60Co γ 射线照射小鼠之前对小鼠进行EGCG 处理。与单纯照射组结果相比,EGCG处理可明显提高小鼠的肝脏指数、脾脏指数和胸腺指数,并且能够增加小鼠的脾细胞转化率和单核细胞吞噬指数。该研究表明:EGCG可通过提高免疫器官指数、诱导脾细胞转化为T淋巴细胞和B淋巴细胞以及增强巨噬细胞吞噬功能来预防辐照引起的免疫系统损伤。上述研究表明:EGCG 对免疫系统具有辐射防护作用。但有关EGCG对T淋巴细胞、B淋巴细胞和免疫分子辐射防护作用的研究还未见报道。
1.3 EGCG对放射性肺损伤的辐射防护作用
在临床上,肺癌、乳腺癌等胸部恶性疾病接受放射治疗后,会导致放射性肺损伤的发生率较高。孙万良[9]利用22 Gy的60Co γ射线单次照射大鼠全肺,并在照后2 h 内分别给予大鼠地塞米松和EGCG进行干预治疗,以此研究EGCG对大鼠放射性肺损伤的保护作用及其机制。结果发现,与地塞米松相比,EGCG处理明显改善了大鼠受照部位脱毛和皮肤溃疡的情况,降低了大鼠的肺系数,减轻了大鼠肺部充血、水肿的症状,显著减少了大鼠肺组织羟脯氨酸的含量。EGCG能够减轻放射性肺损伤的早期炎症反应和晚期肺纤维化。进一步研究发现:EGCG能够降低肺损伤大鼠的血清炎症细胞因子―血清白介素-6(IL-6)、白介素-10(IL-10)、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)的水平;EGCG还能够保护肺泡Ⅱ型细胞并抑制其异常转化增生,阻滞肺组织及成纤维细胞的转化和增殖,并以此减轻肺纤维化病变,且其在抗炎和抗纤维化方面的效果优于地塞米松。另外,该作者还以大鼠血清转化生长因子-β1(TGF-β1)含量、血清总超氧化物歧化酶(TSOD)活力和丙二醛(MDA)含量作为抗氧化指标,评价了EGCG 对放射性肺损伤大鼠氧化应激的改善情况。结果表明:与单纯照射组的结果相比,EGCG处理降低了大鼠血清中TGF-β1和MDA的含量,同时增加了T-SOD 的活力,明显改善了大鼠的氧化应激。该研究还指出EGCG 可以增加NF-κb的表达,但没有进行相关的实验。You等[10]的研究结果再次证明了EGCG 能够减轻放射性肺损伤的早期炎症反应和晚期肺纤维化。
1.4 其他
131I核素治疗是治疗甲状腺功能亢进症(甲亢)的重要方法之一。131I 衰变放出β 射线,使甲状腺组织发生炎症、萎缩、直至功能丧失等,从而达到治疗甲亢的目的,但同时会引起甲状腺功能减退(放射性甲减)。有研究表明[11]:与甲减大鼠模型组相比,131I 造成甲减的大鼠在接受EGCG 处理后,大鼠血清中游离三碘甲状腺原氨酸、游离甲状腺囊、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)和过氧化氢酶的含量明显增加,而促甲状腺激素(TSH)的含量减少。该研究结果显示:EGCG 能够减轻131I 辐照对大鼠甲状腺组织的氧化损伤,可以保护大鼠的抗氧化体系。这表明EGCG 对于131I 核素治疗导致的辐射损伤具有防护作用。
在放射线诱发皮炎的临床单臂(无对照)实验中[12],患者接受乳房切除术后接受辅助放疗,每天局部应用EGCG。患者从出现I 级皮炎开始应用EGCG,到放疗后两周结束。在EGCG治疗期间研究人员观察到患者皮炎的情况如下:1 级毒性,71.4%;2级毒性,28.6%;没有3或4级毒性反应。EGCG减轻了患者的疼痛、灼热感、瘙痒、拉痛和压痛。说明对于接受放射治疗的乳腺癌患者,局部应用EGCG 可有效抵抗放射线诱发的皮炎。由于该临床实验研究没有设置对照,其实验结果有待进一步研究印证。
睾丸作为辐射敏感的器官之一,其功能会因电离辐射作用而明显受损。Ding 等[13]研究了EGCG对C57小鼠睾丸的辐射防护作用。该研究人员在照射前,连续3 d 给小鼠腹腔注射EGCG。与单纯照射组的结果比较,EGCG处理改善了辐射导致的睾丸组织萎缩,减轻了生精细胞(Germ cell-s,GC)脱皮,降低了GC的凋亡率,并显著提高了精子的数量。细胞凋亡ELISA 分析实验进一步证实了EGCG 对电离辐射导致GC 的死亡具有防护作用。该研究结果表明:EGCG可显著减轻电离辐射导致的睾丸损伤。
徐亚雄等[14]研究了EGCG 对豚鼠听功能和耳毛细胞的辐射防护作用,该研究人员在豚鼠接受照射前3 d 开始对豚鼠进行腹腔注射EGCG,2 次/d。照射后检测听性脑干反应阈值(ABR)、耳蜗铺片及耳蜗毛细胞计数。与单纯辐照组结果相比,预防性注射EGCG 降低了ABR,改善了耳蜗铺片形态结构,增加了耳蜗毛细胞计数。该实验结果说明EGCG 能够有效降低电离辐射对豚鼠听功能和耳蜗毛细胞的损伤,EGCG对电离辐射所致的听力损伤具有一定的防护作用。但并未进行EGCG对听力功能辐射防护作用机制的研究。
El-Missiry等[15]研究EGCG对大鼠海马细胞的辐射防护作用,在4 Gy γ 射线照射Wister大鼠之前对大鼠进行EGCG 灌胃。与单纯照射组结果比较,EGCG 预处理可以明显降低大鼠血浆同型半胱氨酸、淀粉样蛋白β、炎性因子TNF-α 和IL-6 的水平;同时,EGCG预处理还可以降低大鼠海马中四羟基壬烯(4-HNE)和蛋白质羰基的水平,增加大鼠血浆中多巴胺和血清素的含量以及大鼠海马中GSH-Px和谷胱甘肽还原酶(Glutathione reductase,GR)的活性。以上结果表明:EGCG 可以减轻辐射导致的海马损伤。但关于EGCG 对神经系统的辐射防护作用还有待研究。
2 EGCG的辐射防护作用机制
2.1 清除自由基
电离辐射对生物大分子有两种作用方式:直接作用与间接作用。其中间接作用在电离辐射生物学效应的发生上占有十分重要的地位。自由基并非电离辐射间接作用的特有产物,机体的正常代谢或药物代谢过程中都能够产生自由基,正常情况下,机体会不断产生多种内源性的抗自由基活性物质。这些活性物质能不断地清除自由基,使机体免受自由基损害。当电离辐射作用于机体时,体内自由基含量会突然增加,过多的自由基无法被机体自身抗自由基物质清除,从而对机体产生明显的有害作用[16]。EGCG 因其化学结构中含有多个酚羟基(图1),可清除机体内过多的自由基而起到辐射防护作用。
在对EGCG 性质的研究中发现,羟基自由基·OH 与EGCG 的反应速率为1.5×1010L/(mol·s),而·OH 与 细 胞 靶 的 反 应 速 率 为107~109L/(mol·s)。这说明EGCG可以有效地清除·OH,减少·OH对细胞中生物靶的损伤;同时,其他有关EGCG 的电子脉冲辐解结果显示,EGCG 也可有效清除O2-、CO2·、NO2·以及ROO·,而这些自由基都可以造成细胞染色体、酶和细胞膜的损伤[17]。杨志辉等[18]利用鸡血血清研究EGCG 对羟基自由基的清除作用,按鸡血血清体积的0.1%加入H2O2作为损伤处理,加入不同浓度的EGCG 作为保护处理,测定羟基自由基的清除率。结果表明:EGCG对羟基自由基清除率随浓度的增加而增大,当ECCG浓度达到400 μg/mL 时,其对羟自由基的清除率接近100%。另有研究表明[8]:单独使用100 μmol/L 的EGCG 处理正常小鼠脾细胞,不会引起DNA 损伤参数的显著性改变;EGCG预处理小鼠脾细胞能够减少细胞DNA 链断裂。该研究推测:EGCG 可能通过直接嵌入DNA 捕获自由基或者修复自由基造成的损伤,发挥其DNA辐射防护的作用。

图1 EGCG分子结构Fig.1 EGCG molecular structure
综上所述,EGCG可以清除自由基,从而减轻机体由于辐射导致的损伤。本文从EGCG 化学结构的角度推测,清除自由基是其发挥辐射防护作用的主要机制。
2.2 激活内源性抗氧化应激通路,增加抗氧化酶活性
氧作为生命机体能量的来源之一,其经过机体代谢过程会产生一些代谢产物以及衍生的含氧物质,这些物质统称为活性氧(ROS)。正常情况下ROS 不会造成机体损伤,但当电离辐射作用于机体时,ROS 的含量会由于体内水分子产生大量自由基而暴增,从而导致机体氧化应激[19]。EGCG可以激活内源性抗氧化应激转导通路―转录因子红细胞系-2 相关因子-抗氧化应激反应元件(Nrf2-ARE),从而增加机体的抗氧化能力[20]。EGCG还可提高体内多种抗氧化酶的表达,包括血红素氧合酶-1(HO-1)、GSH-Px、超氧化物岐化酶(SOD)和锰超氧化物岐化酶(Manganese superoxide dismutase/superoxide dismutase,MnSOD/SOD2)等抗氧化酶,从而增加机体抗氧化酶的活性[21]。
2.2.1 通过Nrf2-ARE信号通路激活抗氧化酶
Kundu等[22]研究发现,Nrf2-ARE信号通路是迄今发现的最重要的抗氧化应激相关信号传导通路。核转录因子Nrf2 在氧化应激的应答中起核心调控作用,其属于CNC(Cap-n-Collar)碱性亮氨酸拉链蛋白家族,在生理状态下Nrf2 与包浆蛋白伴侣分子(Keap-1)结合,并被锚定于胞浆中的细胞骨架上,无法入核发挥转录因子的作用[23]。当细胞遭到ROS 或亲电子物质攻击时,ROS 或亲电子物质一方面可对Keap-1 分子的半胱氨酸残基进行化学修饰,引起Keap-1 构象改变,导致Nrf2-Keap-1 复合体解离,Nrf2 入核;另一方面,可导致Nrf2 的丝氨酸/苏氨酸残基被促分裂原活化蛋白激酶(MAPKs)、蛋白激酶C(PKC)和磷脂酰肌醇-3-激酶(PI3K)磷酸化,从而使Nrf2 的核积累增强。这种磷酸化作用已被证明有助于Keap-1 释放Nrf2[9,20]。被活化的Nrf2 通过识别ARE 元件启动体内Ⅱ相解毒酶和抗氧化酶基因的转录。受Nrf2-ARE 信号通路调控的抗氧化酶主要有血红素氧合酶-1(HO-1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)、腺嘌呤二核苷酸醌氧化还原酶-1(NAD(P) H: Quinone oxidoreductase-1, NQO-1) 和SOD[9]。Sriram等[20]研究发现:在博来霉素诱导的肺纤维化动物模型中,EGCG对肺纤维化具有保护作用。同时免疫印迹实验表明,EGCG 可调控Nrf2-Keap-1 信号途径,提高机体内源性抗氧化应激的能力。该作者推测EGCG 可能通过与Keap-1的相互硫醇作用,使Nrf2对Keap-1的亲和力降低,从而导致Nrf2 与Keap-1 解离并释放出某些用于核转运的物质。孙万良[9]研究还发现:在放射性肺损伤大鼠模型中,与单纯照射组结果相比,EGCG处理明显增加了Nrf2 的表达,提高了机体的抗氧化能力。de Oliveira 等[24]在EGCG 对线粒体保护作用的研究中指出,EGCG可促进PI3K/Akt(磷脂酰肌醇-3-激酶/蛋白激酶B)轴和ERK(细胞外调节蛋白激酶)的表达上调,这导致Nrf2 活化并易位至细胞,从而激活Nrf2-ARE 信号通路。EGCG调控Nrf2-Keap-1 的具体作用机制还有待进一步的研究。
2.2.2 HO-1
HO-1是内源性抗氧化酶,高表达的HO-1对于保护细胞免受氧化应激及其适应性反应至关重要。Kim 等[25]的研究发现,EGCG 作为外源性抗氧化剂,在H2O2暴露下可增强HO-1 的基因表达。EGCG还可以调节存活蛋白AKT1的表达,与其共同起到保护角质形成细胞的作用。葛杨杨[26]发现,紫外线辐照人HaCaT 皮肤细胞后,用EGCG处理能有效降低细胞内ROS 的含量,并且能够转录激活HO-1。孙万良[9]利用22 Gy 的60Co γ 射线单次照射大鼠全肺,在照后2 h内分别给予地塞米松和EGCG 进行干预治疗。结果表明:与照射组和地塞米松组相比,EGCG处理组大鼠肺组织HO-1的表达明显增加,这表明EGCG可以增加放射性肺损伤大鼠HO-1的基因表达,提高机体的抗氧化水平,并且其效果优于地塞米松。Zhu 等[27]用EGCG 预处理HaCaT 细胞1 h 后,对其进行X 射线照射,然后进行蛋白质印迹实验以检测HO-1的水平。结果表明:EGCG 处理可以增加HaCaT 细胞中HO-1 的表达,并且这种作用效果随着EGCG 浓度的升高而增强。
2.2.3 GSH-Px、SOD和SOD2
GSH-Px 是机体内广泛存在的一种重要的过氧化物分解酶。El-Missiry的研究[15]表明,与单纯照射组结果比较,EGCG 预处理增加了大鼠海马中GSH-Px 和GR 的活性。Yi 等[8]的研究也表明,EGCG 可以增加小鼠体内GSH-Px 的活性,还可以抑制小鼠的脂质过氧化反应。GCLC 是人谷氨酸-半胱氨酸连接酶(β-GCL 酶)的亚基,负责谷胱甘肽(Glutathione,GSH)的合成。de Oliveira[24]等在EGCG保护线粒体的研究中指出,EGCG处理激活了Nrf2 信号通路,并经由Nrf2 信号通路调控GCLC 的表达,从而调节了GSH 的合成。SOD 是机体重要的内源性抗氧化酶。郭绍来等[4]研究了EGCG的抗氧化作用,研究结果显示:与单纯照射组结果相比,EGCG 能够提高小鼠体内SOD 的水平。这表明了EGCG 具有较好的抗氧化作用。SOD2 是由SOD2 基因编码的抗氧化酶,是机体重要的内源性抗氧化酶之一。SOD2是在胞浆内合成并移至线粒体发挥作用的内源性抗氧化酶。SOD2对调节线粒体中活性氧的浓度有重要的作用,并在防止哺乳动物细胞免受电离辐射损伤中起着至关 重 要 的 作 用[28]。Zhu 等[27]用EGCG 预 处 理HaCaT 细胞1 h 后,对HaCaT 细胞进行X 射线照射,然后检测SOD2 的蛋白质水平。结果显示:EGCG 增加了线粒体局部SOD2 的表达,这表明EGCG通过上调线粒体中SOD2的表达水平,减轻了电离辐射对HaCaT细胞线粒体的损害。
上述研究表明:EGCG发挥抗氧化功能的关键作用靶点是Nrf2-ARE 内源性抗氧化应激通路。EGCG 激活Nrf2-ARE 信号通路的作用途径如图2所示。本文从辐射作用于机体的作用方式及机制的角度,推测EGCG 发挥辐射防护作用最关键的机制是清除自由基。

图2 EGCG激活Nrf2-ARE信号通路的作用途径[24]Fig.2 EGCG activates the Nrf2-ARE signaling pathway[24]
2.3 抗凋亡作用
Ding 等[13]研究了EGCG 对C57 小鼠睾丸的辐射防护作用。为了进一步研究EGCG 的辐射防护作用机制,该作者在照射后16 h和21 d,分析了睾丸及睾丸GC中几种凋亡相关蛋白的表达情况,包括丝裂原激活的蛋白激酶(Mitogen-activated protein kinases, MAPKs)、抗凋亡蛋白(BCL-2)家族、半胱氨酸蛋白酶3(Caspase-3)。实验结果显示:与单纯照射组结果相比,EGCG处理有效地抑制了睾丸组织中Caspase-3、MAPKs 和BAX 的表达,同时,EGCG还可以增加BCL-2的表达。因此,该研究表明:EGCG 可以减轻睾丸细胞凋亡,并对电离辐射诱导GC的死亡具有防护作用。
陈晨[29]对小鼠体内的miRNA进行了差异表达筛选,以小鼠正常肝细胞AML-12 中的miR34a 为研究对象,进一步探究EGCG 的辐射防护分子机制。该研究表明,去乙酰化酶1型(Sirtuin type 1,Sirt1)是miR34a 众多靶基因之一,过表达的miR34a 可抑制Sirt1 的表达。与单纯辐照组结果相比,不同浓度的EGCG处理能够促进小鼠AML-12细胞的增殖,提高AML-12的细胞活力,显著下调AML-12 细胞中的miR34a 的表达,上调Sirt1 的表达。Sirt1可通过抑制p53基因活性,减少细胞周期停滞以及细胞凋亡的发生[30]。因此该作者推测:EGCG保护机体免受电离辐射损伤的作用机制可部分归因于EGCG减少电离辐射导致miR34a过表达,从而上调Sirt1 表达量,进而影响P53 活性,减少细胞凋亡。
El-Missiry等[15]为了进一步研究EGCG对大鼠海马的辐射防护作用机制,对大鼠进行4 Gy γ射线急性照射后,检测了大鼠体内相关凋亡蛋白。结果表明:与单纯照射组相比,EGCG预处理降低了大鼠体内凋亡蛋白Bax、p53 和Caspases-3 和Caspases-9的表达,增加了抗凋亡蛋白BCL-2的表达,这提示EGCG 预处理可以降低大鼠组织的凋亡水平,EGCG的辐射防护作用机制可部分归因于EGCG对大鼠的抗凋亡作用。
2.4 减少DNA损伤
细胞遗传物质DNA 是辐射损伤的重要靶点。电离辐射会导致DNA产生多种变化,比如DNA单链和双链断裂、碱基破坏、碱基改变等,这些改变都会对机体正常的生理功能、新陈代谢等生命活动产生重大影响。Zhu 等[27]探讨了EGCG 能否影响DNA 双链断裂(DSBs)的动态修复过程。DSBs 被认为是电离辐射引起的最严重的病变。辐射诱导的磷酸化H2AX蛋白(γ-H2AX)灶是DNA双链断裂的代表。该作者通过对γ-H2AX进行免疫染色来检测DNA 损伤。结果发现,与照射组相比,EGCG 预处理明显降低了HaCaT 细胞的γ-H2AX病灶数,这说明EGCG预处理可显著降低细胞的DNA损伤。
Yoshioka 等[31]在大肠杆菌puC18 质粒接受γ射线照射的条件下,探讨了绿茶渗滤液及其主要成分EGCG 对大肠杆菌puC18 质粒DNA 断裂的影响。该研究人员单独用100 μmol/L 的EGCG(实验选用安全最大剂量)孵育未辐照的细胞,发现EGCG 未导致DNA 损伤参数发生任何改变。该研究显示:照射之前添加不同剂量的EGCG,可以抑制由于高、低剂量辐射导致的DNA 超螺旋转化为开放环状,还可以减轻由于高、低剂量辐射诱导的质粒DNA 链断裂。在相同浓度下,EGCG 的放射防护效果比槲皮素和维生素C 更好。该研究推测:由于EGCG 分子具有稠合的芳环,很可能在DNA螺旋中相互交错,因此EGCG可能在DNA分子中具有较高的局部浓度,而显示出其更有效的针对DNA断裂的保护作用。
刘官树等[17]采用人L02 肝细胞株作为研究对象,利用脉冲场凝胶电泳检测DNA 双链断裂,对EGCG 的辐射防护作用进行了研究。研究结果显示:与单纯照射组比较,EGCG处理组明显减少了L02肝细胞的DNA双链断裂。
2.5 其他
李曼蓉[32]采用分次低剂量X 射线照射人脐静脉内皮细胞——HUVEC 细胞,研究了EGCG 对细胞DNA 甲基化的影响,检测到HUVEC 细胞全基因组DNA 甲基化水平下降、DNA 修复基因的O6-甲基鸟嘌呤DNA 甲基转移酶(O6-methylguanine-DNA,MGMT)表达下降,以及MGMT的启动子处于甲基化状态。与单纯照射组结果相比,EGCG处理增加了HUVEC 细胞全基因组DNA 甲基化的水平,提高了HUVEC 细胞DNA 修复基因MGMT的表达,并且使MGMT 启动子处于非甲基化的状态。该研究结果表明:EGCG可以逆转慢性低剂量辐射所致的全基因组低甲基化,上调MGMT 的表达,并能够使其启动子处于DNA 非甲基化状态。因此该作者推测:慢性低剂量辐射可能通过累积异常的DNA 甲基化而成为辐射相关疾病的强烈诱导剂,而EGCG 可能通过调控DNA 甲基化水平而发挥辐射损伤防护作用。
徐凯等[33]利用6 MV X 射线分次照射(0.05 Gy/d×10 d) 小 鼠,研 究EGCG 对 小 鼠Rad23b和Ddit3基因的启动子CpG岛甲基化及表达的影响。该作者检测了小鼠外周血单个核细胞(PBMC)以及肾脏、肝脏、脾脏、脑及肺组织中Rad23b和Ddit3基因的启动子CpG岛的甲基化水平和mRNA 的表达变化。与单纯照射组结果比较,除脾脏Rad23b 基因外,不同浓度的EGCG 处理均能明显降低其他组织中Rad23b 和Ddit3 基因的启动子CpG岛高甲基化,并能够增加mRNA 的表达。该研究表明,EGCG 可能通过影响DNA 甲基化来发挥其辐射防护作用。
以上研究指出:EGCG的辐射防护作用机制可能与其清除自由基、抗氧化、抗凋亡、减轻DNA损伤等作用有关(图3),但EGCG 具体的辐射防护作用机制仍需要进一步研究。
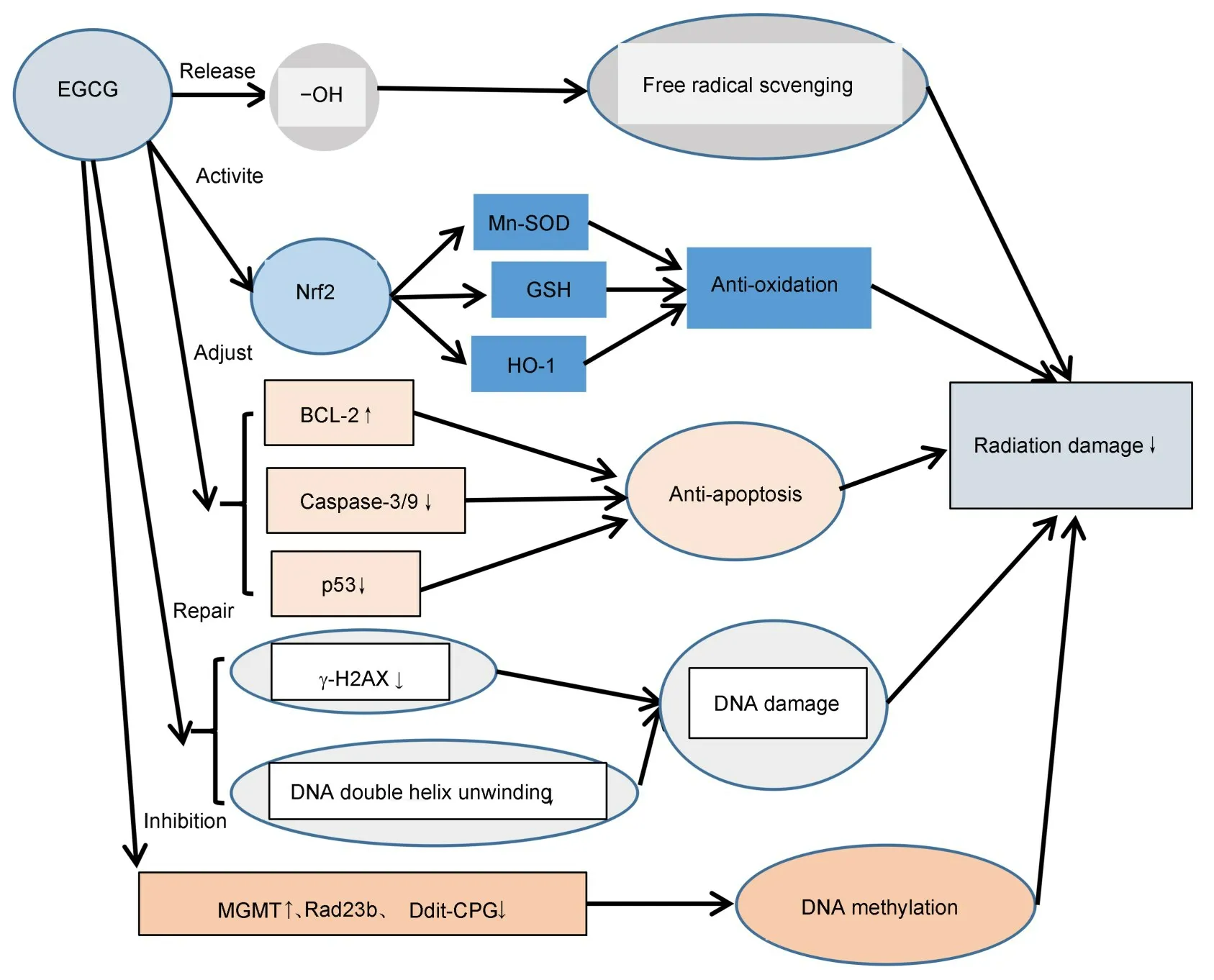
图3 EGCG辐射防护作用的作用机制Fig.3 Mechanism of EGCG radiation protection
3 展望
综上所述,无论在体内还是体外实验中,EGCG均能减轻电离辐射所致损伤,具有辐射防护作用,这为开拓EGCG 的临床应用提供了理论依据。EGCG在临床实验的应用已有相关报道:包括EGCG治疗乳腺癌放疗导致的皮炎[12]、EGCG减轻放射性食管炎[34-35]等,但目前其临床研究报道较少,仍需要进一步深入研究。随着相关研究的不断深入,天然绿茶提取物EGCG 因其副作用少、抗氧化、抗炎性能良好,其临床应用将会越来越广。
