基于代谢标志物快速检测食品中金黄色葡萄球菌
2020-10-28胡凯丽李延梅唐俊妮马欣玥
胡凯丽,李延梅,陈 娟,唐俊妮,马欣玥
(西南民族大学生命科学与技术学院,青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041)
金黄色葡萄球菌(Staphylococcus aureus)广泛存在于自然界中,如空气、水、人和动物的排泄物中等[1]。人和动物的皮肤、黏膜,特别是鼻咽部带菌率均较高,30%~80%的人群为该病原菌的携带者,因此S.aureus污染食品的几率较大[2]。S.aureus易污染的食品主要有奶、肉、蛋、鱼及其制品,是引起食物中毒的主要病原菌之一[3-5]。Chang Yanzi等[6]在2010—2014年期间对来自于中国不同地区的3 476 份食物样品进行分离,鉴定出336 株S.aureus,检出率为9.67%。李自然等[7]采集上海市各类食品进行S.aureus的分离和鉴定表明,505 份食品样品中共有117 份检出S.aureus,平均检出率为23.2%。其中,240 份生牛乳样品中有63 份检出S.aureus,检出率为26.3%;70 份生鲜肉样品中,有23 份检出S.aureus,检出率为32.9%。容冬丽等[8]利用定性和定量法对我国15 个代表性城市采集的540 份即食食品和蔬菜样品进行S.aureus检测,共检出阳性样品50 份,平均污染率为9.3%,其中卤肉(16.3%)污染率最高,其次是烤肉9.2%,蔬菜(4.0%)污染率最低。
快速准确检测S.aureus是预防其大规模食物中毒爆发的关键环节。目前对S.aureus的检测方法主要包括细菌培养法[9-10]、免疫学实验[11]和基于特异性基因的聚合酶链式反应(polymerase chain reaction,PCR)检测方法[12-13]。细菌培养法和免疫学实验存在耗时费力、操作繁琐等缺点。传统的PCR技术不易区分死活菌,容易造成假阳性的结果。开发准确快速的S.aureus活菌检测技术至关重要。随着分析化学技术的进步,挖掘各种微生物的特征性代谢产物目前已成为病原微生物快速检测和鉴定研究的一个重要方向[14-16]。细菌挥发性代谢产物是由复杂的挥发性化学成分组成,包括各种不同化学结构和不同极性的挥发性化合物。尽管某些种或属的细菌被发现存在着交迭的挥发性代谢产物类型,但每个种或属的细菌都有着独特的代谢方式,典型的挥发性成分和挥发性特征必定是种或属所特有的,可以视为鉴别的生物标志[17-18]。Filipiak等[19]在研究S.aureus胰蛋白胨大豆肉汤培养物时,检测到3-甲基丁醛和3-甲基丁酸的含量较高。Tait等[20]在胰蛋白胨大豆肉汤、脑心浸出液肉汤和EF肉汤中分别接种S.aureus、大肠杆菌(Escherichia coli)和肺炎克雷伯菌,在S.aureus的培养物中检测到3-甲基丁醛和3-甲基丁酸,而在其他2 种菌的培养物中均未检出。Bos等[21]对S.aureus、肺炎链球菌、粪肠球菌、铜绿假单胞菌、肺炎克雷伯氏菌和E.coli 6 种致病菌的挥发性代谢产物比较分析证实,3-甲基丁醛和3-甲基丁酸是S.aureus的特征代谢产物。Chen Juan等[22]在胰蛋白胨大豆肉汤中接种E.coli O157:H7、肠炎沙门氏菌、单核细胞性李斯特菌、福氏志贺氏菌和S.aureus,只有S.aureus检出了3-甲基丁醛和3-甲基丁酸。这些研究均表明,3-甲基丁醛和3-甲基丁酸可以作为S.aureus的候选检测标志物。
本研究参考GB 4789.10—2016《食品微生物学检验金黄色葡萄球菌检验》中S.aureus的培养条件,以7.5%NaCl肉汤为前增菌培养基,考察了S.aureus代谢产物3-甲基丁醛和3-甲基丁酸的特异性和稳定性,进一步将代谢标志物应用于真实食物样品的检测中,比较代谢标志物检测技术与常规检测技术结果的符合率,为开发基于代谢标志物检测食品中S.aureus活菌技术打下了理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
S.aureus参考菌株(ATCC 6538,ATCC 43300)、E.coli O157:H7参考菌株(CICC 21530)、肠炎沙门氏菌参考菌株(Salmonella enteritidisCICC 21482)。S.aureus分离菌株(编号分别为127、134、137、140、Y4、B83、H5和F19),采用S.aureus 16S rDNA特异性引物PCR扩增鉴定。上述菌株保存于西南民族大学食品质量与安全实验室。
1.1.2 材料与培养基
生鲜猪瘦肉购于成都各超市、菜市场、便利店;生牛乳采集于成都市青白江区散养牛场;米饭购于成都各单位食堂、饭店、外卖。
Baird-Parker(BP)琼脂基础、改良山梨醇麦康凯(modified sorbitol maconkey agar,CT-SMAC)琼脂基础、木糖赖氨酸脱氧胆盐(xylose lysine deoxycholate agar,XLD)琼脂、亚碲酸盐卵黄增菌液、CT-SMAC添加剂、7.5% NaCl肉汤、胰蛋白胨大豆肉汤(tryptic soy broth,TSB) 青岛海博生物技术有限公司;TaqPCR Master Mix(2X with Blue Dye)、DL2000 Marker、TE缓冲液(10 mmol/L Tris-HCl,1 mmol/L pH 8.0乙二胺四乙酸二钠盐) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
Trace DSQ型气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪(配置Triplus自动进样器) 美国Thermo公司;MOF-4086S低温冰箱、MLS-3020高压蒸汽灭菌锅 日本三洋公司;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;DHG-9203A电热恒温鼓风干燥箱 上海一恒科技有限公司;GHP-9280隔水式恒温培养箱 上海齐欣科学仪器有限公司;HZQ-F160恒温振荡培养箱 太仓市实验设备厂;50/30 μm DVB/CAR/PDMS萃取头 美国Supelco公司;Galanz WD800B型微波炉 广东格兰仕集团有限公司;DYY-6C型电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 S.aureus挥发性代谢产物的特异性分析
分别从BP平板、CT-SMAC平板和XLD平板上挑取S.aureus 6538、E.coliO157:H7 21530和S.enteritidis 21482典型菌落接入5 mL TSB培养基中,于(36±1)℃、200 r/min条件下培养13 h。然后,将这些新鲜培养物进行梯度稀释至10-5,分别吸取S.aureus 6538菌悬液240 μL、E.coliO157:H7 21530菌悬液120 μL和S.enteritidis 21482菌悬液120 μL各接入400 mL无菌7.5% NaCl肉汤中,使初始接种量均为100~200 CFU/mL,于(36±1)℃、200 r/min条件下培养12、16、20、24 h,取样测定挥发性代谢标记物。每个时间点做3 个平行样品,进行2 次重复实验。
1.3.2 S.aureus单独培养
分别从BP平板上挑取S.aureus 6538、43300、127、134、137、140、Y4、B83、H5和F19的典型菌落接入5 mL TSB培养基中,于(36±1)℃、200 r/min条件下培养13 h。然后,将这些新鲜培养物进行梯度稀释至10-5,吸取S.aureus菌悬液240 μL接入400 mL无菌7.5% NaCl肉汤中,使S.aureus初始接种量为100~200 CFU/mL,于(36±1)℃、200 r/min条件下培养24 h。每隔2 h取样测定挥发性代谢标记物和S.aureus的生长数量,每个时间点做3 个平行样品。以不接种S.aureus的7.5% NaCl肉汤为空白样品。进行2 次重复实验。
1.3.3 S.aureus与E.coli混合培养
分别从BP平板、CT-SMAC平板挑取S.aureus 6538和E.coli O157:H7 21530典型菌落接入5 mL TSB中,于(36±1)℃、200 r/min条件下培养13 h。然后,将S.aureus 6538和E.coli O157:H7 21530新鲜培养物进行梯度稀释至10-5,分别吸取S.aureus 6538菌悬液240 μL和E.coli O157:H7 21530菌悬液120 μL同时接入400 mL无菌7.5% NaCl肉汤中,使S.aureus 6538和E.coli O157:H7 21530初始接种量均为100~200 CFU/mL(S.aureus 6538与E.coli O157:H7 21530比例1∶1);将S.aureus 6538新鲜培养物梯度稀释至10-5、E.coli O157:H7 21530新鲜培养物梯度稀释至10-4,分别吸取10-5S.aureus 6538菌悬液240 μL和10-4E.coli O157:H7 21530菌悬液120 μL同时接入400 mL无菌7.5% NaCl肉汤中,使S.aureus 6538初始接种量为100~200 CFU/mL,E.coli O157:H7 21530初始接种量为1 000~2 000 CFU/mL(S.aureus 6538与E.coli O157:H7 21530比例1∶10);将S.aureus 6538新鲜培养物梯度稀释至10-5、E.coli O157:H7 21530新鲜培养物梯度稀释至10-3,分别吸取10-5S.aureus 6538菌悬液240 μL和10-3E.coli O157:H7 21530菌悬液120 μL同时接入400 mL无菌7.5% NaCl肉汤中,使S.aureus 6538初始接种量为100~200 CFU/mL,E.coli O157:H7 21530初始接种量为10 000~20 000 CFU/mL(S.aureus 6538与E.coli O157:H7 21530比例1∶100)。于(36±1)℃、200 r/min条件下培养24 h,每隔2 h取样测定挥发性代谢标记物和S.aureus 6538的生长数量,每个时间点做3 个平行。以不接种S.aureus 6538和E.coli O157:H7 21530的7.5% NaCl肉汤为空白样品。进行2 次重复实验。
1.3.4 S.aureus与S.enteritidis混合污染
同1.3.3节。
1.3.5 S.aureus、E.coli和S.enteritidis混合污染
使S.aureus 6538、E.coli O157:H7 21530和S.enteritidis 21482的初始接种量分别为100~200 CFU/mL(接种比例1∶1∶1),其他操作同1.3.3节。
1.3.6 代谢标志物检测食物样品中S.aureus
取猪精瘦肉、生牛乳、米饭各20 份,每份样品25 g。将样品转移至225 mL无菌7.5% NaCl肉汤中,均质。于(36±1)℃、200 r/min条件下增菌培养至20 h,分别取样进行挥发性代谢产物分析、BP平板培养以及细菌PCR鉴定,每份样品做3 个平行。分别以不培养的猪肉、生牛乳和米饭为空白样品(0 h的样品)。
1.3.7 挥发性代谢产物的测定
1.3.7.1 萃取条件
采用50/30 μm DVB/CAR/PDMS萃取头,在80 ℃预孵化10 min,萃取30 min[23]。
1.3.7.2 气相色谱条件
TR-FFAP色谱柱(30 m×0.25 mm,0.25 μm);不分流模式,不分流1 min之后分流比为50∶1;流速1 mL/min;升温程序:40 ℃保持3 min,7 ℃/min升温至220 ℃并保持2 min;载气为99.999%氦气;进样口温度230 ℃;解吸时间2 min。
1.3.7.3 质谱定性条件
电子电离源,电子能量70 eV;离子源温度250 ℃;传输线温度220 ℃;选择离子流扫描模式,参数见表1。

表1 选择离子流扫描参数Table 1 Parameters for selective ion flow scan
1.3.8 细菌生长数量的测定
吸取1 mL 7.5% NaCl肉汤培养物,经10 倍梯度稀释至适宜的稀释度,吸取1 mL于灭菌平板中,倒入冷却至50 ℃左右的BP培养基,混摇均匀,置于(36±1)℃培养24~48 h。每个时间点做3 个平行样品,进行2 次重复实验。
1.3.9 S.aureus的PCR鉴定
DNA提取:吸取培养20 h的7.5% NaCl肉汤培养物1 mL于1.5 mL的EP管中,4 ℃、12 000 r/min离心2 min,收集菌体;加入适量TE缓冲溶液充分洗涤菌体,离心弃上清;加入1 mL的TE缓冲溶液重悬菌体,涡旋使菌体充分混匀;采用微波炉(额定微波频率2.45 GHz,最大输出功率800 W)加热2 min,离心取上清液,-20 ℃保存。
PCR扩增体系:TaqPCR Master Mix 10 μL,10 μmol/L的上下游引物各0.8 μL,DNA模板0.4 μL,灭菌的dd H2O补足20 μL体系。用S.aureus 16S rDNA特异性引物(S.aureus 16S rDNA)进行PCR扩增,引物序列为(5’-3’)F-GTGCACATCTTGACGGTACC、R-CGAAGGGGAAGGCTCTATC,Tm值为60 ℃,产物理论长度为565 bp[24]。
PCR扩增条件:95 ℃预变性5 min;95 ℃变性40 s,58 ℃退火50 s,72 ℃延伸40 s,35 个循环;72 ℃延伸7 min,4 ℃保存。
PCR产物琼脂糖电泳检测:配制1%琼脂糖凝胶,取5 μL PCR扩增产物上样,80 V电泳45 min,凝胶成像系统观察与储存电泳图片。
1.4 数据分析
2 结果与分析
2.1 S.aureus挥发性代谢产物的特异性
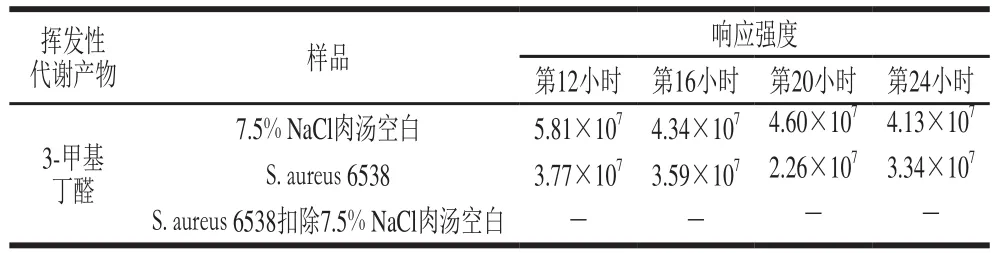
表27.5% NaCl肉汤中3-甲基丁醛的检测结果Table 2Detection results of 3-methyl-butanal in 7.5% NaCl broth at different culture times

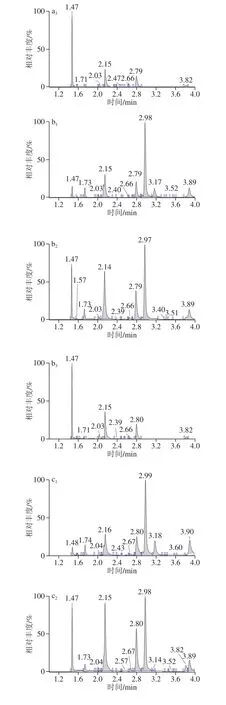
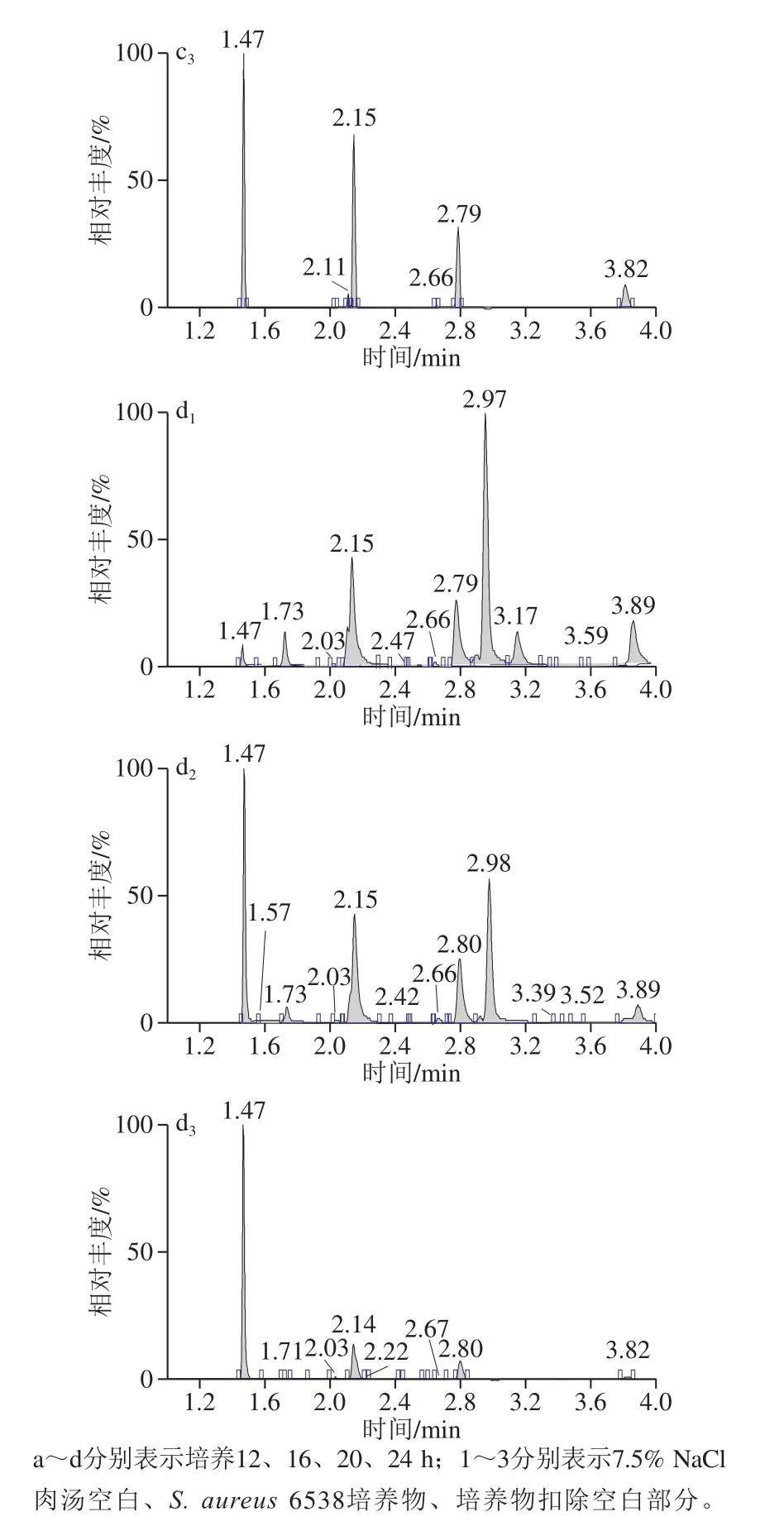
图17.5% NaCl中3-甲基丁醛提取离子流色谱图Fig.1 Extraction ion chromatograms of 3-methyl-butanal in 7.5% NaCl broth at different culture times
保留时间2.97~2.99 min为3-甲基丁醛。由表2和图1可见,以不接种S.aureus的7.5% NaCl肉汤为空白样品,与接种了S.aureus的7.5% NaCl肉汤培养物进行比较,空白样品和培养样品均检出了一定强度的3-甲基丁醛,但是当培养样品检出强度扣除空白样品检出强度以后,3-甲基丁醛没有表现出净增长。说明S.aureus没有产生高于空白的3-甲基丁醛信号,不能作为检测标志物。

表37.5% NaCl肉汤中3-甲基丁酸的检测结果Table 3Detection results of 3-methyl-butyric acid in 7.5% NaCl broth at different culture times


图27.5% NaCl中3-甲基丁酸提取离子流色谱图Fig.2 Extraction ion chromatograms of 3-methyl-butyric acid in 7.5% NaCl broth at different culture times
保留时间17.12~17.14 min为3-甲基丁酸。由表3和图2可知,在7.5% NaCl肉汤中,培养至第12、16、20、24小时只有S.aureus能检出3-甲基丁酸,E.coli O157:H7和S.enteritidis都没有检出3-甲基丁酸。因此,3-甲基丁酸可以作为S.aureus的特征挥发性代谢产物。
2.2 S.aureus挥发性代谢产物的稳定性
2.2.1 不同S.aureus单独培养

图3 不同S.aureus菌株3-甲基丁酸的释放规律Fig.3 Release of 3-methyl-butyric acid from different S.aureus strains

图4 不同S.aureus的菌体生长情况Fig.4 Growth rates of different S.aureus strains
由图3、4可知,在7.5% NaCl肉汤中,10 株S.aureus单独生长6~10 h 3-甲基丁酸信号强度出现首次显著增长(P<0.05),对应的菌体生长量在5×105~3.25×109CFU/mL。在整个培养过程中,3-甲基丁酸响应强度呈现持续增长,第24小时达到最大值4.29×107~1.68×108,对应的菌体生长量为0.86×1013~1.21×1013CFU/mL。其中,第24小时S.aureus 6538产生的3-甲基丁酸响应强度为1.09×108,菌体生长量为9.55×1012CFU/mL。
2.2.2 S.aureus和E.coli混合培养
2.2.2.1 S.aureus和E.coli(1∶1)混合培养
由图5可知,在7.5% NaCl肉汤中,S.aureus 6538和E.coli O157:H7 21530(1∶1)混合生长至第14小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到3.36×107,略低于S.aureus单独培养时3-甲基丁酸的信号强度。S.aureus的菌体最终生长量达到8.95×1012CFU/mL,与S.aureus 6538单独培养时菌体生长量相近。

图5 S.aureus和E.coli(1∶1)混合培养时菌体生长与3-甲基丁酸释放规律Fig.5 Bacterial growth and release of 3-methyl-butyric acid from S.aureus when co-cultured with E.coli O157:H7 (1:1)
2.2.2.2 S.aureus和E.coli(1∶10)混合培养

图6 S.aureus和E.coli(1∶10)混合培养时菌体生长与3-甲基丁酸释放规律Fig.6 Bacterial growth and release of 3-methyl-butyric acid from S.aureus when co-cultured with E.coli O157:H7 (1:10)
由图6可知,在7.5% NaCl肉汤中,S.aureus 6538和E.coli O157:H7 21530(1∶10)混合生长至第12小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到2.72×107,略低于S.aureus单独培养时3-甲基丁酸的信号强度。S.aureus 6538的菌体最终生长量达到8.35×1012CFU/mL,与S.aureus 6538单独培养时菌体生长量相近。
2.2.2.3 S.aureus和E.coli(1∶100)混合培养

图7 S.aureus和E.coli(1∶100)混合培养时菌体生长与3-甲基丁酸释放规律Fig.7 Bacterial growth and release of 3-methyl-butyric acid fromS.aureus when co-cultured with E.coli O157:H7 (1:100)
由图7可知,在7.5% NaCl肉汤中,S.aureus 6538和E.coli O157:H7 21530(1∶100)混合生长至第14小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到5.21×107,略低于S.aureus单独培养时3-甲基丁酸的信号强度。S.aureus 6538的菌体最终生长量达到9.05×1012CFU/mL,与S.aureus 6538单独培养时菌体生长量相近。
2.2.3 S.aureus和S.enteritidis混合培养
2.2.3.1 S.aureus和S.enteritidis(1∶1)混合培养
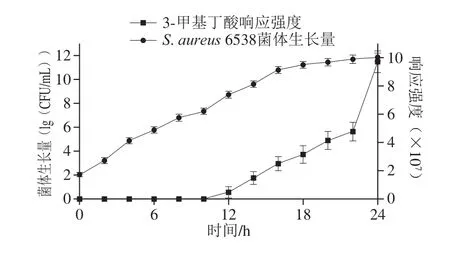
图8 S.aureus和S.enteritidis(1∶1)混合培养时菌体生长与3-甲基丁酸释放规律Fig.8 Bacterial growth and release of 3-methyl-butyric acid from S.aureus when co-cultured with S.enteritidis (1:1)
由图8可知,在7.5% NaCl肉汤中,S.aureus 6538和S.enteritidis 21482(1∶1)混合生长至第12小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到9.7×107,与S.aureus 6538单独培养时3-甲基丁酸的释放量相似。S.aureus 6538的菌体最终生长量可以达到7×1011CFU/mL,略低于S.aureus 6538单独培养时菌体生长量。
2.2.3.2 S.aureus和S.enteritidis(1∶10)混合培养

图9 S.aureus和S.enteritidis(1∶10)混合培养时菌体生长与3-甲基丁酸释放规律Fig.9 Bacterial growth and release of 3-methyl-butyric acid fromS.aureus when co-cultured with S.enteritidis (1:10)
由图9可知,在7.5% NaCl肉汤中,S.aureus 6538和S.enteritidis 21482(1∶10)混合生长至第12小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到4.66×107,略低于S.aureus单独培养时3-甲基丁酸的信号强度。S.aureus 6538的菌体最终生长量可以达到4.91×1011CFU/mL,略低于S.aureus 6538单独培养时菌体生长量。
2.2.3.3 S.aureus和S.enteritidis(1∶100)混合培养

图10 S.aureus和S.enteritidis(1∶100)混合培养时菌体生长与3-甲基丁酸释放规律Fig.10 Bacterial growth and release of 3-methyl-butyric acid from S.aureus when co-cultured with S.enteritidis (1:100)
由图10可知,在7.5% NaCl肉汤中,S.aureus 6538和S.enteritidis 21482(1∶100)混合生长至第12小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到6.31×107,略低于S.aureus单独培养时3-甲基丁酸的信号强度。S.aureus 6538的菌体最终生长量可以达到4.36×1011CFU/mL,略低于S.aureus 6538单独培养时菌体生长量。
2.2.4 S.aureus、E.coli和S.enteritidis(1∶1∶1)混合培养

图11 S.aureus、E.coli和S.enteritidis(1∶1∶1)混合培养时菌体生长与3-甲基丁酸释放规律Fig.11 Bacterial growth and release of 3-methyl-butyric acid from S.aureus when co-cultured with E.coli O157:H7 and S.enteritidis (1:1:1)
由图11可知,在7.5% NaCl肉汤中,S.aureus 6538、E.coli O157:H7和S.enteritidis 21482(1∶1∶1)混合生长至第12小时3-甲基丁酸信号强度出现首次显著增长(P<0.05),之后逐渐上升,第24小时达到8.10×107,略低于S.aureus 6538单独培养。S.aureus 6538最终菌体生长量可以达到4.73×1011CFU/mL。
2.3 食物样品中S.aureus的检测结果
2.3.1 生鲜猪肉样品中S.aureus检出情况
由表4可知,采集的20 份生鲜猪肉样品经7.5% NaCl肉汤增菌培养20 h后,顶空固相微萃取-GC-MS的结果全部显示检出3-甲基丁酸,峰响应强度在105~106。同时,对培养的菌液进行PCR鉴定,发现20 份样品培养液基因组DNA全都能扩增出S.aureus 16S rDNA特异性片段(图12),表明所有样品均为阳性。另外,BP平板培养结果也显示全部检出S.aureus,生长量在109~1011CFU/g。可以看出传统培养法、PCR法和基于挥发性代谢标志物检测方法对于生鲜猪肉样品中S.aureus检测所得结果一致,3 种方法结果之间的符合率为100%。

表4 生鲜猪肉样品中S.aureus生长与代谢标志物检出情况Table 4 Growth and metabolic markers of inoculated S.aureus in fresh pork samples

图12 生鲜猪肉样品S.aureus 16S rDNA PCR扩增产物电泳图Fig.12 Electrophoresis patterns of 16S rDNA PCR amplification products from inoculated S.aureus in fresh pork samples
2.3.2 生牛乳样品中S.aureus检出情况
由表5可知,采集的20 份生牛乳样品经7.5% NaCl肉汤增菌培养20 h后,顶空固相微萃取-GC-MS的结果全部显示检出3-甲基丁酸,峰信号强度在105~106。同时,对培养的菌液进行PCR鉴定,发现20 份样品培养液基因组DNA全都能扩增出S.aureus16S rDNA特异性片段(图13),表明所有样品均为阳性。另外,BP平板培养结果也显示全部检出S.aureus,生长量在109~1011CFU/g。可以看出传统培养法、PCR法和基于挥发性代谢标志物检测方法对于生牛乳样品中S.aureus检测所得结果一致,3 种方法结果之间的符合率为100%。

表5 生牛乳样品中S.aureus生长与代谢标记物检出情况Table 5 Growth and metabolic markers of inoculated S.aureus in raw milk samples

图13 生乳样品S.aureus 16S rDNA PCR扩增产物电泳图Fig.13 Electrophoresis patterns of 16S rDNA PCR amplification products from inoculated S.aureus in raw milk samples
2.3.3 米饭样品中S.aureus检出情况
由表6可知,采集的20 份米饭样品经7.5% NaCl肉汤增菌培养20 h后,9号样品没有检出3-甲基丁酸,PCR结果也为阴性,传统培养法也没有检出S.aureus,说明9号样品不存在S.aureus的污染。在剩下的19 份样品中,顶空固相微萃取-GC-MS检测结果除2号样品外,其他样品均检出3-甲基丁酸,峰信号强度在105~106;对培养液进行PCR鉴定,14号样品基因组DNA未能扩增出S.aureus16S rDNA特异性片段,其余样品基因组DNA都能扩增出该片段(图14),表明代谢标记物检测方法与PCR检测方法之间的符合率为90%。BP平板培养结果显示全部样品检出S.aureus,生长量在106~1011CFU/g,表明代谢标记物检测方法与传统培养方法结果之间的符合率为95%。

表6 米饭样品中S.aureus生长与代谢标记物检出情况Table 6 Growth and metabolic markers of inoculated S.aureus in cooked rice samples

图14 米饭样品S.aureus 16S rDNA PCR扩增产物电泳图Fig.14 Electrophoresis patterns of 16S rDNA PCR amplification products from inoculated S.aureus in cooked rice samples
3 讨 论
在常用食品发酵剂乳酸菌[25-26]和肉葡萄球菌、木糖葡萄球菌[27-28]中,支链氨基酸分解代谢途径已有报道,亮氨酸首先在支链氨基酸转氨酶催化作用下生成α-酮异己酸,经非氧化脱羧途径生成3-甲基丁醛,最后经醛脱氢酶催化为3-甲基丁酸,或者α-酮异己酸经氧化脱羧途径直接生成3-甲基丁酸。可见,3-甲基丁醛是亮氨酸分解代谢的中间产物,3-甲基丁酸是最终产物。有学者建议通过检测细菌的代谢终产物鉴定细菌,但是从细菌的代谢终产物中找到稳定的标志物比较困难[29]。在已有研究报道[19-21]和本课题组前期实验的基础上,筛选出3-甲基丁醛和3-甲基丁酸作为S.aureus潜在的检测标志物。本研究参考国家标准检测方法,以7.5% NaCl肉汤为前增菌培养基,发现该培养基本身会产生高强度的3-甲基丁醛,S.aureus的代谢活动没能改变其检出水平,说明S.aureus在7.5%NaCl肉汤中几乎不产生3-甲基丁醛或产生后被迅速转化为3-甲基丁酸。与在胰蛋白胨大豆肉汤中S.aureus被检出3-甲基丁醛[19,22]相比较,说明培养基质会影响细菌的代谢活动。3-甲基丁酸则是在各种培养基质中稳定的代谢产物,包括本实验使用的7.5% NaCl肉汤及胰蛋白胨大豆肉汤[19,22]、脑心浸出液肉汤[20]和牛乳[30]等其他培养基质。
鉴于目前缺乏S.aureus支链氨基酸分解代谢途径的详细研究报道,今后课题组拟开展食品源S.aureus分离菌株的支链氨基酸分解代谢能力分析,并详细探究支链氨基酸分解代谢途径,即探明S.aureus中3-甲基丁酸的产生机理,可以为建立代谢标志物检测技术奠定更深入的理论基础。
4 结 论
在7.5% NaCl肉汤培养基中,S.aureus不能产生高于空白的3-甲基丁醛信号,3-甲基丁酸则是S.aureus的特异性代谢产物,该代谢产物的释放不受S.aureus菌株差异的影响,也不受与S.aureus共同培养的E.coliO157:H7和S.enteritidis的影响,具有良好的稳定性。对于生鲜猪肉、生牛乳和米饭样品,挥发性代谢标志物检测法与传统培养法和PCR检测法的结果之间符合率很高,该方法只需将待检样品增菌培养20 h,然后取样装入顶空瓶即可上机自动化检测,操作流程简单。
