动物性食品中氟苯尼考检测的电化学免疫传感器构建
2020-10-28刘卫华刘敏轩于文龙王向红
刘卫华,杨 茜,刘敏轩,于文龙,王向红
(河北农业大学食品科技学院,河北 保定 071000)
氟苯尼考(florfenicol,FF)是第3代氯霉素类抗生素,于1988年诞生于美国,1999年在我国被批准为二类新兽药。FF杀菌谱广,可以有效杀灭厌氧革兰氏阳性菌及阴性菌[1],并且用药后基本不再产生再生性贫血障碍[2-3],目前已代替氯霉素(chloramphenicol,CAP),广泛应用于水产养殖和畜牧业[4-9]。FF的过度使用,不但会导致用药动物身体机能的下降,还会引起一系列人畜共患的细菌性疾病,FF的肝毒性和耐药性等致病因素也极有可能转移到人体中,埋下健康隐患[10-16]。对此,我国和欧盟都对动物肌肉中FF的残留作出了限量规定,最大限量均为300 μg/kg,最小限量为100 μg/kg[17-18]。
近年来,多地市场的肉类、蛋类商品被查出FF残留超标[19],建立动物性食品中FF残留的快速筛查方法也成为了研究热点。
目前,最常用的FF检测方法主要有高效液相色谱-串联质谱法[20-22]、液相色谱-质谱联用法[23-24]、气相色谱法等仪器检测方法[25-27]以及免疫分析法[28-30]。这些检测方法虽然有很高的灵敏度,但因仪器不便携、检测成本高,无法实现样品的现场检测,因此需要研发FF残留的快速检测方法。电化学方法因具有仪器便携、成本低、检测周期短、操作简便快速等优点,广泛应用在农兽药残留、致病微生物等检测领域中。高牧丛等[31]基于石墨烯(graphene,GR)-壳聚糖(chitosan,CS)复合材料制备了用于检测尿酸的电化学免疫传感器。在6~600 μmol/L线性范围内呈现良好的线性关系,R2为0.993 4,检出限为0.33 μmol/L(RSN=3),添加回收率在97.5%~101.3%之间。Qi Shaopeng等[32]制备了一种基于GR的莱克多巴胺(ractopamine,RAC)免疫传感器,通过GR与RAC分子间的π-π吸附作用将RAC固定在GR表面,实现了RAC的特异性检测。在0~4 000 ng/mL质量浓度范围,RAC检出限为0.06 ng/mL,实际猪肉样品的加标回收率在93.6%~113.6%之间。Jijie等[33]建立了用于检测致病性大肠杆菌的免疫传感器。通过电沉积在金电极表面修饰了还原氧化石墨烯-聚乙烯亚胺复合薄膜,大肠杆菌的线性浓度范围为1×101~1×104CFU/mL,相关系数为0.995,检出限为10 CFU/mL,且特异性较好、灵敏度较高,可以用于实际血清、尿液和水样品的检测。
本实验开发一种基于GR-CS复合修饰材料的电化学免疫传感器,依据抗原和抗体的特异性结合,旨在建立检测FF的电化学方法,应用于肉类和鸡蛋样品的现场检测。
1 材料与方法
1.1 材料与试剂
猪肉、牛肉、鸡肉、鸡蛋,购于河北省保定市。
FF、CAP、甲砜霉素(thiamphenicol,TAP)、牛血清白蛋白(bovine serum albumin,BSA) 上海源叶生物科技有限公司;氟苯尼考胺(florfenicol amine,FFA)德国Witega公司;FF多克隆抗体(anti-FF)由本实验室自制(效价1∶60 000,IC15为0.72 ng/mL,亲和性较好);CS 北京索莱宝科技有限公司;GR 北京德科岛金科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
CHI660E型电化学工作站、CHI 104 3 mm直径玻碳盘电极(glass carbon disk electrode,GCE)、CHI 115铂丝对电极、CHI 150饱和甘汞电极 上海辰华仪器有限公司;SKP-02.300电热恒温培养箱 黄石市恒丰医疗器械有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;LCT Premier XE液相色谱-串联质谱联用仪 美国Waters公司。
1.3 方法
1.3.1 GR-CS复合材料的制备及表征
准确量取50.0 mL 0.05 mol/L HCl溶液,于恒温水浴锅中加热至80~90 ℃,随后加入准确称取的50.0 mg CS粉末,搅拌溶解。溶解后取出冷却至室温,加入0.1 mol/L NaOH溶液调pH 5,配制成1 mg/mL的CS溶液,置于4 ℃备用。
准确称取3.0 mg GR粉末,加入到1.0 mL配制好的1 mg/mL CS溶液中,超声分散2 h,得到均匀分散的GR-CS混悬体系,质量浓度为3 mg/mL,置于4 ℃保存。
采用扫描电子显微镜观察GR粉末和GR-CS复合修饰材料的形态。
1.3.2 GCE裸电极的修饰
GCE裸电极在使用前依次用0.3 μm和0.05 μm的氧化铝粉在抛光绒布上抛光打磨,直至呈现光滑镜面。随后分别在硝酸溶液和乙醇溶液和去离子水中超声,室温下晾干。在pH 7.0含0.1 mol/L KCl和10 mmol/L K3Fe(CN)6的磷酸盐测试溶液(0.1 mol/L KCl +10 mmol/L K3Fe(CN)6+0.1 mol/L PBS)中进行循环伏安(cyclic voltammetry,CV)法扫描,电位差不超过90 mV后,用移液枪移取10 μL制备好的GR-CS复合修饰材料,垂直滴涂于GCE裸电极表面,在室温下过夜晾干,得到GR-CS/GCE。
1.3.3 免疫传感器的制备
用移液枪移取10 μL稀释好的anti-FF,垂直滴涂于GR-CS/GCE表面,立即放入恒温培养箱中在37 ℃温育1 h,得到anti-FF/GR-CS/GCE。再移取10 μL的5% BSA溶液,垂直滴涂于anti-FF/GR-CS/GCE表面,37 ℃继续温育1 h,得到BSA/anti-FF/GR-CS/GCE,并用CV法对修饰电极进行表征。
将含有FF的待测样液取10 μL垂直滴涂在BSA/anti-FF/GR-CS/GCE表面,37 ℃进行温育。采用三电极体系,以BSA/anti-FF/GR-CS/GCE为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,在0~0.6 V电压范围内进行差分脉冲伏安(differential pulse voltammetry,DPV)法扫描测定,在0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L PBS测试溶液中进行DPV扫描,记录峰值电流。
1.3.4 实际样品的检测
参照GB/T 20756—2006《可食动物肌肉、肝脏和水产品中氯霉素、甲砜霉素和氟苯尼考残留量的测定 液相色谱-串联质谱法》[34],对预先经检测无FF的猪肉、牛肉、鸡肉、鸡蛋(分为全蛋、蛋黄和蛋清3 个测试组)样品进行预处理。
称取5.0 g试样(精确至0.01 g),分别加入FF标准液75 μL,15 mL乙酸乙酯和5 g无水硫酸钠,均质提取后4 000 r/min离心5 min,用乙酸乙酯定容至50 mL。取10 mL提取液于鸡心瓶中,45 ℃旋蒸至干,残渣用3 mL去离子水溶解并超声,加入3 mL正己烷涡旋混合,静置分层,移取1 mL水相于1.5 mL聚丙烯离心管中,13 000 r/min离心5 min,过0.2 μm滤膜后,待测。
取10 μL待测样液垂直滴涂在BSA/anti-FF/GRCS/GCE表面,按照1.3.3节方法进行DPV扫描,记录峰值电流。
1.3.5 液相色谱-串联质谱法检测FF
C18色谱柱;柱温40 ℃;流动相为甲醇-水(40∶60,V/V)溶液;电喷雾电离源;扫描方式为负离子模式。
配制质量浓度梯度为1、10、100、200、300、500、700、1 000 ng/mL的FF标准溶液,绘制FF标准曲线。取样品待测液20 μL进行检测,并与电化学检测结果拟合。
1.4 数据统计及图表绘制
使用Excel进行数据统计和图表的绘制。
2 结果与分析
2.1 传感器的制备原理
FF免疫传感器的制备原理如图1所示。GCE经抛光打磨处理干净后,在电极表面垂直滴涂GR-CS,室温下过夜晾干。再将一定质量浓度的anti-FF包被在电极表面,恒温温育后用BSA封闭电极表面剩余的活性位点。将一定质量浓度的FF标准溶液滴涂在电极表面,使FF分子与anti-FF发生特异性结合,电极表面的电子传递因抗原-抗体结合产生大分子的结合产物而受到阻碍,从而导致电流发生变化,并以此绘制标准曲线[35]。
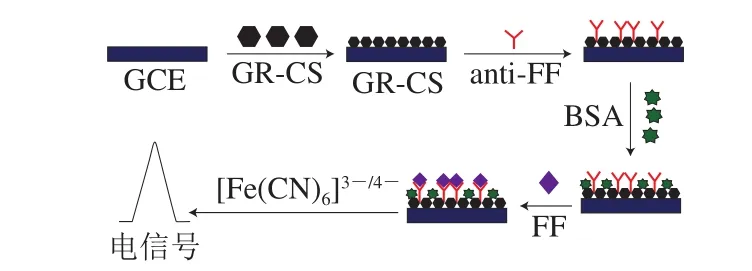
图1 FF免疫传感器的制备原理图Fig.1 Schematic of the preparation of immunosensor for florfenicol detection
2.2 GR-CS复合材料的表征
由图2A可以看出,GR表面存在许多孔穴,使其可以吸附抗体等物质,但却因其片状结构而易相互重叠。由图2B可以看出,CS因其特有的分散性和成膜性,使GR粉末良好地分散,形成一层均匀的导电薄膜。

图2 GR粉末(A)和GR-CS复合修饰材料(B)的扫描电镜图Fig.2 SEM images of GR (A) and GR-CS composite (B)
2.3 不同修饰过程中电极的表征
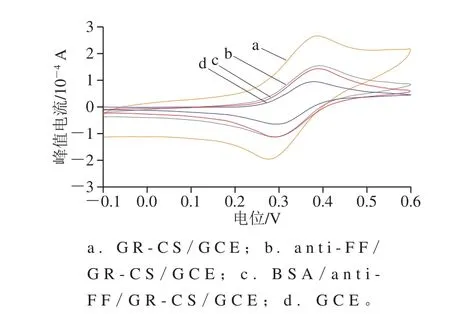
图3 不同修饰电极的CV曲线Fig.3 Cyclic voltammograms of different modified electrodes
采用CV法对不同修饰过程中电极表面的电化学行为进行表征。将不同修饰的电极在0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L PBS的测试液中进行CV扫描,得到CV曲线(图3)。GCE裸电极(曲线d)经过抛光打磨处理后,出现了一对可逆的氧化还原峰,且峰值电流最小;在GCE电极表面修饰上GR-CS后(曲线a),峰值电流明显增大,说明电极表面电子传递速率得到显著增强;进一步修饰上anti-FF后(曲线b),峰值电流降低,说明抗体分子阻碍了电极表面电子的传递,即anti-FF成功修饰在电极表面;修饰好的电极在5% BSA溶液中封闭1 h后(曲线c),峰值电流进一步减小,说明BSA在电极表面上成功修饰,封闭了电极表面剩余的活性位点,传感器构建成功。
2.4 抗体质量浓度的确定
电极表面抗体的质量浓度是影响后续FF检测步骤很重要的因素。为选择一个最佳的抗体修饰质量浓度,将不同质量浓度的anti-FF垂直滴涂在GR-CS/GCE表面,滴涂量为10 μL,随后在37 ℃温育1 h,最后在0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L PBS的测试液中进行DPV扫描,电压0~0.6 V、扫描速率0.05 V/s,灵敏度1×10-4。
由图4可以看出,当anti-FF质量浓度为0~60 μg/mL时,随着质量浓度的增加,DPV峰值电流迅速降低,表明抗体分子正不断地被固定在GR-CS/GCE表面;当质量浓度为60~120 μg/mL时,DPV峰值电流的变化趋于平缓,说明电极表面上抗体的固定量已趋于饱和;当质量浓度大于120 μg/mL时,电极表面上的抗体过多,阻碍了电子的传递。因此,选择60 μg/mL为anti-FF的最佳修饰质量浓度。
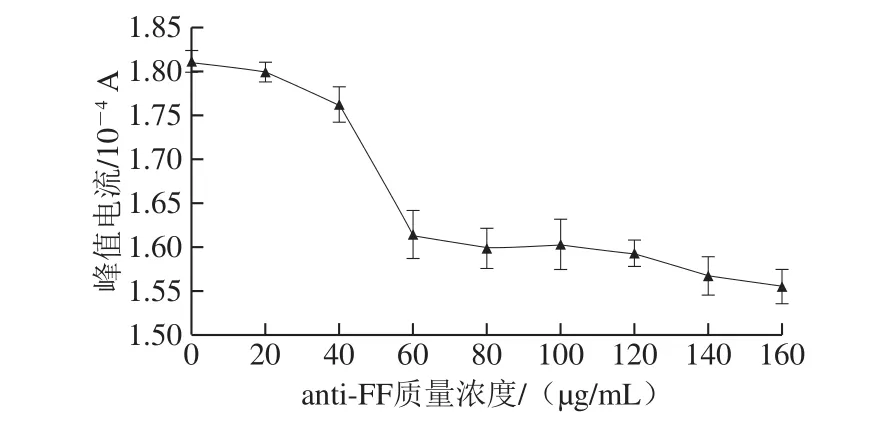
图4 不同anti-FF质量浓度下的DPV峰值电流Fig.4 DPV peak currents at different anti-FF antibody concentrations
2.5 温育时间的确定
在anti-FF/GR-CS/GCE上滴涂10 μL稀释后的FF标准品溶液,37 ℃温育时间依次延长,在0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L PBS的测试液中进行DPV扫描,电压0~0.6 V、扫描速率0.05 V/s,灵敏度1×10-4。
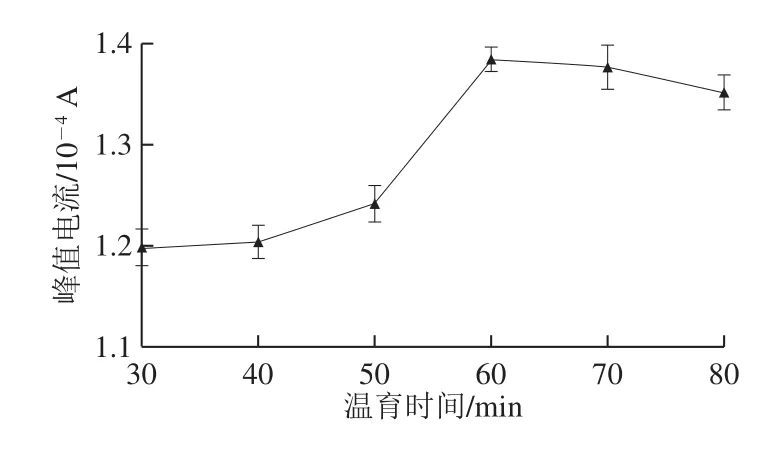
图5 不同温育时间下的DPV峰值电流Fig.5 DPV peak currents at different incubation times
如图5所示,温育时间在30~60 min范围内时,随着温育时间的延长,DPV峰值电流不断增大,这表明免疫反应产物的生成需要一定时间,并随着时间的延长不断地进行;当温育时间继续延长至60 min以上,DPV峰值电流变化趋于平缓,这表明抗原-抗体的结合反应产物已趋于稳定,免疫反应已基本达到终点。因此,选择60 min为最佳的温育时间。
2.6 FF标准曲线建立
在GR-CS/GCE表面分别垂直滴涂10 μL质量浓度为60 μg/mL的anti-FF,37 ℃温育1 h后用1×PBS清洗,随后用5% BSA溶液37 ℃封闭1 h,1×PBS清洗后,垂直滴涂不同质量浓度的FF标准溶液,37 ℃温育1 h后,在测试液0.1 mol/L KCl+10 mmol/L K3Fe(CN)6+0.1 mol/L PBS(pH 7.0)中进行DPV扫描,电压0~0.6 V、扫描速率0.05 V/s,灵敏度1×10-4。
DPV峰值电流与FF质量浓度呈反比,FF质量浓度越大,电极表面上与FF结合的抗体分子越多,生成的结合产物数量增多,导致电极表面电子的传递受到空间阻碍,峰值电流越小。在1~1 000 ng/mL范围内,FF质量浓度(x)与DPV峰值电流(y)的线性关系为y=-0.031 1lnx+1.470 4,R2=0.983 5,检出限为0.08 ng/mL(RSN=3)。
2.7 样品加标回收率
利用1.3.4节样品前处理方法对猪肉、鸡肉、牛肉和鸡蛋样品进行处理。FF的加标量为10、100、1 000 μg/kg,每组样品重复测定3 次。如表1、2所示,所有样品的加标回收率在76.90%~94.30%之间,说明本方法构建的电化学免疫传感器可以用于肉类和鸡蛋中FF残留的检测。

表1 肉类样品加标回收率(n=3)Table 1 Recoveries of FF from spiked meat samples determined by electrochemical immunosensor (n= 3)
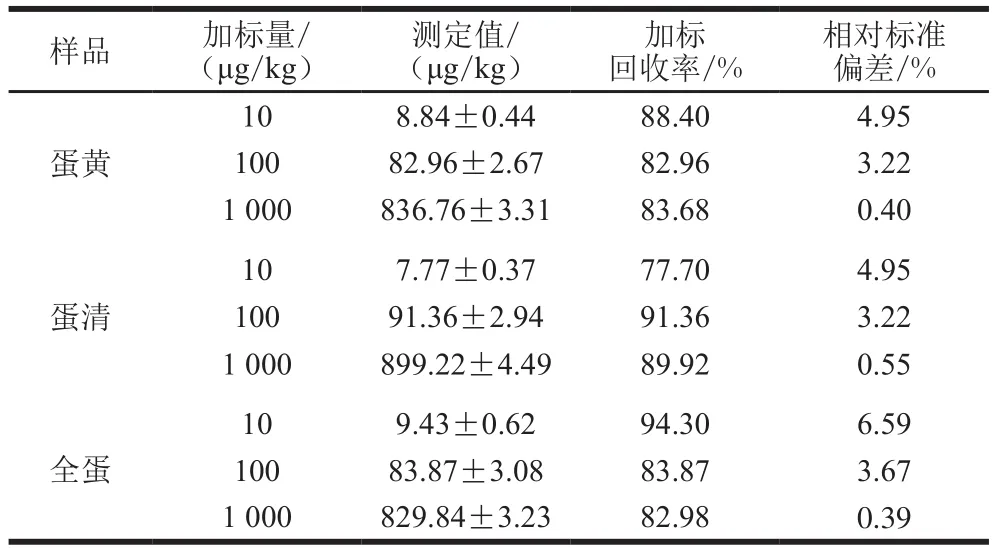
表2 鸡蛋样品加标回收率(n =3)Table 2 Recoveries of FF from spiked egg samples determined by electrochemical immunosensor (n= 3)
2.8 选择性和特异性考察结果
选取FF的3 种结构类似物FFA、TAP以及CAP,考察传感器对于这些药物的DPV响应。如图6所示,当在FF标准溶液中分别添加100 倍质量浓度的TAP、CAP以及FFA时,传感器的DPV峰值电流从低至高依次为FF、FF+TAP、FF+CAP、FF+FFA。电化学免疫传感器在FF标准溶液及3 种干扰物溶液中的峰值电流分别为1.289×10-4、1.307×10-4、1.352×10-4、1.358×10-4A,表明加入干扰物,电流分别增加1.4%、4.9%和5.3%,这说明免疫传感器具有良好选择性。如图7所示,TAP、CAP以及FFA的添加质量浓度为FF添加质量浓度的100 倍,传感器的DPV峰值电流大小从低至高依次为FF(1.223×10-4A)、TAP(1.370×10-4A)、CAP(1.394×10-4A)、FFA(1.468×10-4A);相对于空白对照组(1.481×10-4A),电流分别降低17.5%、7.5%、5.9%和0.9%。
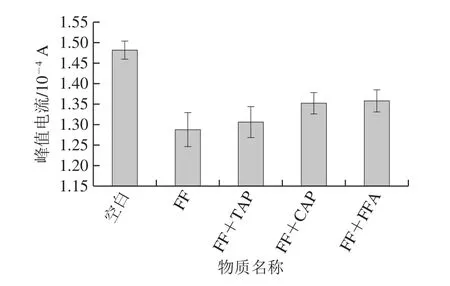
图6 FF电化学免疫传感器的选择性Fig.6 Selectivity of the developed florfenicol immunosensor
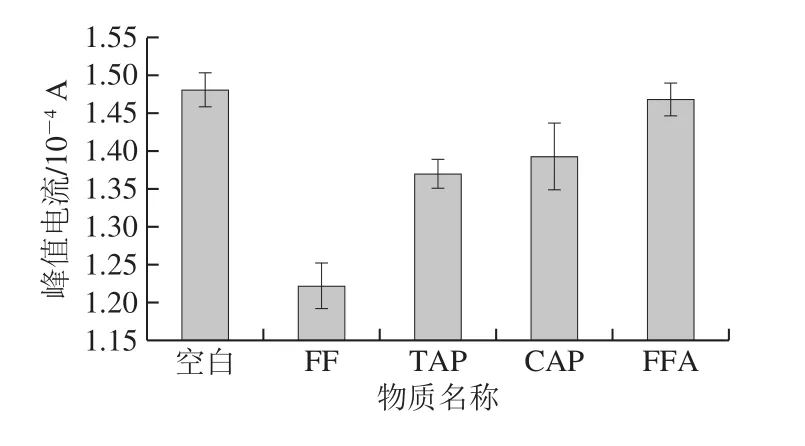
图7 FF电化学免疫传感器的特异性Fig.7 Specificity of the developed florfenicol immunosensor
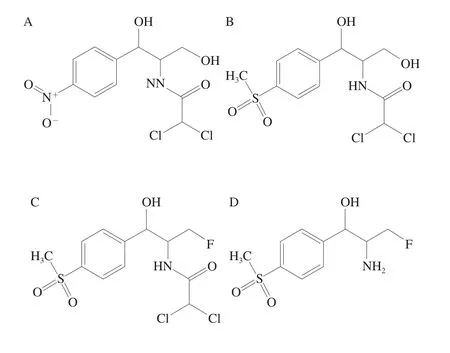
图8 CAP(A)、TAP(B)、FF(C)和FFA(D)的化学结构Fig.8 Chemical structures of chloramphenicol (A), thiamphenicol (B),florfenicol (C) and florfenicol amine (D)
由图8可知,TAP与FF的结构最为接近,基本基团均为分子两端的甲苯磺酰基和两个氯原子以及中间位置的酰胺基团,因此电流变化值最小,与FF的交叉反应率最高;CAP和FF相比,苯环上的磺酰基变为硝基,氟原子变为羟基,但分子另一端的氯原子和酰胺基团不变,因此电流变化值高于TAP,与FF的交叉反应率低于TAP;FFA和FF相比,断开了酰胺键,脱去了羰基和氯原子,相对于TAP和CAP,与FF的结构差异最大,因此电流变化值最大,与FF的交叉反应率最高低。
由此可知,图6中,加入干扰物后每个实验组的电流变化值均较小,说明建立的免疫传感器选择性良好;图7中,建立的免疫传感器对100 倍质量浓度的其他结构类似物的电流变化值较小,说明对FF的特异性较强。
2.9 稳定性实验结果
将制备好的BSA/anti-FF/GR-CS/GCE于4 ℃保存6 d,每隔24 h测定一次相同电极的DPV峰值电流。峰值电流的变化情况如图9所示,第6天电极的峰值电流相较于第1天仅下降了11.6%,说明构建的传感器稳定性良好。
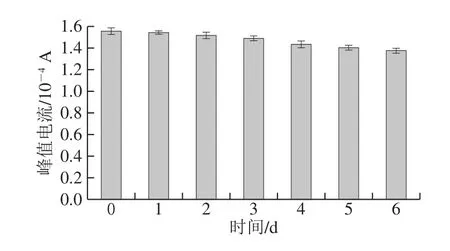
图9 FF电化学免疫传感器的稳定性Fig.9 Stability of the developed florfenicol immunosensor
2.10 液相色谱-串联质谱法对电化学方法的验证
2.10.1 液相色谱-串联质谱法检测实际样品
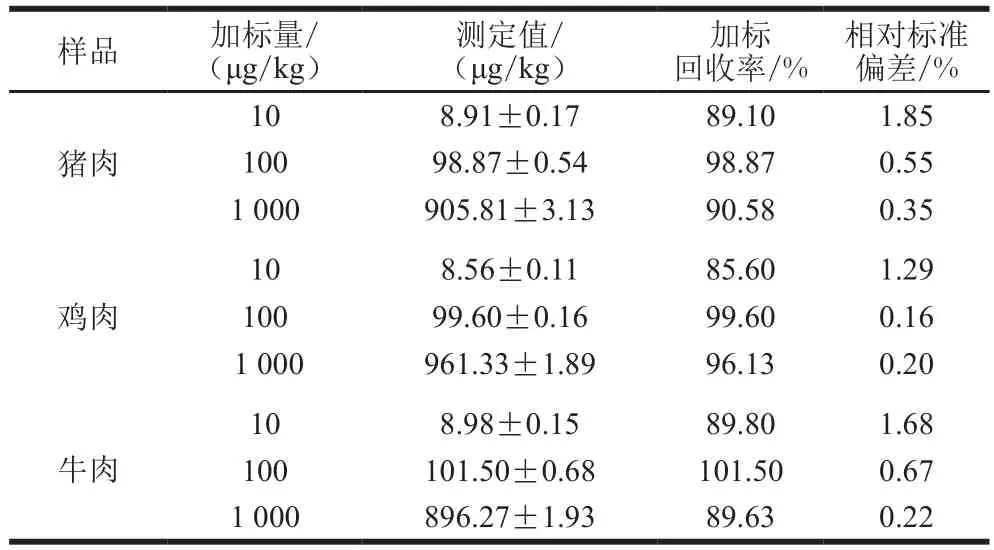
表3 肉类样品加标回收率(n=3)Table 3Recoveries of FF from spiked meat samples determined by LC-MS/MS (n= 3)
配制质量浓度梯度为1、10、100、200、300、500、700、1 000 ng/mL的FF标准溶液,得到FF标准曲线,线性回归方程为y=170.32x+67 028,R2=0.999 8,检出限(RSN=3)为1.0 ng/mL。
根据1.3.4节方法对猪肉、鸡肉、牛肉和鸡蛋样品(预先检测不含FF)进行前处理。FF的加标量为10、100、1 000 μg/kg,每组样品重复测定3 次。加标回收率结果如表3、4所示,所有样品的加标回收率在85.60%~101.50%之间,说明前处理方法可行,可以用于动物性食品中FF的检测。

表4 鸡蛋样品加标回收率(n=3)Table 4 Recoveries of FF from spiked egg samples determined by LC-MS/MS (n= 3)
2.10.2 液相色谱-串联质谱法与电化学法检测结果的相关性分析

图10 电化学和液相色谱-串联质谱测定结果线性回归分析Fig.10 Good linear correlation between electrochemical and LC-MS/MS results
由图10可知,电化学方法和液相色谱-串联质谱方法的测定结果拟合方程为y=1.080 4x+2.951 4,R2=0.989 8。因此,本研究建立的电化学免疫传感器检测动物性食品中残留的FF方法准确可靠,可用于现场大量样品的快速检测。
3 结 论
本研究制备GR-CS复合修饰材料,利用FF多克隆抗体成功构建了一种基于GR的新型电化学免疫传感器,用于检测动物性食品中的FF残留。在1~1 000 ng/mL范围内,FF质量浓度与DPV峰值电流呈线性关系,检出限为0.08 ng/mL(RSN=3),操作简便,灵敏度高,选择性、特异性和稳定性均良好,可用于现场大批量样品的快速检测。
