超声波温育处理提取水稻种子DNA方法探讨
2015-12-24王志纯
王志纯
(福建省种子管理总站,福建福州350003)
DNA的聚合酶链反应(polymerase chain reaction,PCR)技术已经广泛应用于农作物品种鉴定[1-3]、农作物种子纯度鉴定[4-5]与转基因产品检测等[6-8].实验室样品制备与DNA提取等前处理对检测结果的准确性影响较大,但是,在现成的水稻等植物及其产品转基因成分检测方法与水稻种质纯度等标准中[5,9-10],对实验室样品制作与DNA提取纯化等处理只有笼统的表述,而样品前处理直接影响DNA提取的质量与产量,继而决定PCR检测结果的准确性[11-13].植物材料通常采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)裂解缓冲液在65℃恒温下常规温育,进行样品前处理,作者曾研究过样品颗粒细度与CTAB细胞裂解缓冲液温育时间对DNA提取与转基因成分荧光PCR检测灵敏度的影响[11-13].超声波振荡处理能使样品与CTAB细胞裂解缓冲液充分作用,能提高生物DNA提取的产量与纯度[14-15],但在超声波环境中以CTAB裂解缓冲液65℃温育提取水稻种子DNA,迄今未见报道.
为提高水稻种子DNA提取效率,在保证检测结果准确的前提下,缩短DNA提取时间,本研究以3种不同颗粒细度的水稻种子粉末样品为实验材料,对影响水稻种子特异物种成分(GOS基因)检测的主要前处理因素,DNA提取过程中的CTAB裂解缓冲液在65℃恒温常规温育与超声波温育处理效果进行比较分析,以期筛选出优化的前处理措施,提高水稻种子实时荧光PCR检测效率和结果的准确性,为建立水稻种子鉴定的快速检测方法提供依据.
1 材料与方法
1.1 供试材料
水稻“汕优63”种子由福建省农业科学院提供.
1.2 试剂
TE缓冲液(pH 8.0)、超纯水、蛋白酶K、RNA分解酶为上海生工生物工程有限公司产品;GoTaq Probe qPCR Master Mix(2×)(含CXR Reference Dye)试剂盒为Promega公司产品;水稻内源基因(GOS)扩增用的引物与探针[6]由大连宝生物科技公司合成(表1).其他试剂药品均为国产分析纯.

表1 荧光定量PCR引物/探针序列Table 1 The primer/probe sequence of fluorescence PCR
1.3 方法
1.3.1 样品制备 称取200 g稻谷样品,烘干后研磨成粉末,分别过50目(滤过颗粒<270 μm)与100目(滤过颗粒<150 μm)圆振筛,制成颗粒细度<50目、50-100目、>100目3个细度范围的样品.
1.3.2 DNA提取 采用CTAB法[6]提取DNA,称取500 mg样品粉末于50 mL离心管中,加入5 mL质量浓度为20 g·L-1的CTAB裂解缓冲液,于65℃恒温数控超声波清洗器(KQ-500DE型,500 W、40KHZ)中(使用功率100%)振荡温育处理10、30和60 min,同时在65℃恒温水浴锅中常规温育10 min、30 min、60 min、4 h和8 h为对照处理,共8个处理,最后将获得的DNA溶于200 μL的0.1×TE缓冲液(pH 8.0)中,充分涡旋后,测定DNA溶液的D260nm/D280nm值与质量浓度(ng·μL-1).每份样品重复提取2份DNA.
1.3.3 荧光PCR测试 每份DNA样本做2个实时荧光PCR测试,反应温度循环程序为2步法:95℃预变性10 min;95℃变性35 s,60℃退火及延伸60 s,45个循环.阈值设定原则[16]根据仪器噪声情况进行调整,以阈值线略高于正常阴性样品扩增曲线的最高点为准.
1.3.4 荧光PCR反应体系 荧光PCR单管反应体积为20 μL,引物与探针等试剂加样量如表2.
1.3.5 样品前处理对水稻内源基因 GOS的荧光PCR 检测的影响 按照 1.3.1 和 1.3.2 节设置的 3 种颗粒细度与8种CTAB恒温温育与超声波温育处理时间,共24种前处理,各提取2份DNA,每份DNA做2次荧光PCR反应,即每个水稻种子粉末样品做4次水稻内源基因(GOS)的PCR测试,取平均值,每次(96孔板)实验都设置大豆阴性对照与双蒸水(ddH2O)空白对照各1个.

表2 荧光PCR反应体系Table 2 Fluorescence PCR reaction systems
1.4 数据统计分析
采用Microsoft Office Excel 2003进行数据分析与绘图,对不同处理条件下样品DNA质量浓度与水稻内源基因(GOS)的实时荧光PCR检测结果(Ct值)的差异显著性进行方差分析,并估算边际均值条形图.
2 结果与分析
2.1 CTAB的常规温育与超声波温育处理对DNA提取效果比较
3种不同颗粒细度的样品进行6种CTAB温育处理,每个处理重复2次取平均值,共获得18个DNA溶液样本的质量浓度平均值见表3.各个组合样品的DNA溶液D260nm/D280nm值为1.7-2.0,符合PCR检测要求.
由表3可知,在相同的样品颗粒细度下,不论恒温65℃常规温育处理还是超声波温育处理,提取的DNA质量浓度分别随着DNA提取过程中CTAB温育时间的延长而提高,提取的DNA浓度最高的是超声波温育处理60 min,其余依次为超声波温育温育30 min与温育10 min处理.不论样品颗粒细度(目)如何,在温育时间相同下,超声波处理获得的DNA质量浓度明显高于温育时间相同的相应的常规处理.温育处理措施相同的情况下,样品颗粒细度越小,提取的DNA质量浓度越高,这与作者先前研究结果[13]一致.Mi-crosoft Office Excel 2003无重复双因素方差分析表明,样品颗粒细度与CTAB温育处理(含常规、超声波处理与处理时间)对样品 DNA 质量浓度的影响分别达到显著(F=4.57,F0.05=3.44,P<0.05)与极显著水平(F=24.46,F0.01=11.26,P<0.01).不论样品颗粒细度多大,CTAB 温育时间多少,超声波温育处理获得的DNA质量浓度均明显高于常规温育处理(图1-A、B、C),单因素方差分析结果表明2种处理获得的DNA质量浓度差异达到极显著水准(F=8.79,F0.01=8.53,P<0.01),说明超声波处理可以明显提高 DNA 提取质量浓度,与其它材料的研究结果[14-15]一致.
表3 超声波温育处理与常规温育处理水稻种子样品提取的DNA质量浓度Table 3 The DNA concentration of rice seed samples extracted by ultrasonic incubating treatment and conventional incubating treatment ng·μL-1
图1 CTAB超声波温育处理与常规温育处理对水稻种子DNA质量浓度影响的比较Fig.1 Comparison of the DNA concentration of rice seed samples extracted by ultrasonic and conventional treatments incubating in hexadecyltrimethyl ammonium bromide(CTAB)lysis buffer
2.2 CTAB常规温育与超声波温育处理对荧光PCR检测效果的影响
用18种不同处理各2个DNA溶液样本(共计36个)进行水稻种子内源GOS基因的荧光PCR测试,各做2次PCR重复,每个处理获得4个Ct值(表4).
由表4可知,在相同的样品颗粒细度下,不论恒温65℃常规温育还是超声波温育处理,荧光PCR测试获得的CT值均随着DNA提取过程中CTAB温育时间的延长而降低,趋势与表3中的DNA浓度趋势一致.超声波处理中,温育60 min Ct值都是最小的,其次为温育30 min处理,最大的是温育10 min处理.不论样品颗粒细度(目)与温育时间如何,超声波温育处理荧光PCR获得的Ct值明显小于相应的常规温育处理,即超声波温育处理后,样品与缓冲液充分作用,提高了DNA的提取效果,进而提高了荧光PCR的检测灵敏度.
表4 CTAB的常规温育与超声波温育处理对水稻种子内源GOS基因荧光PCR Ct值的影响比较Table 4 Comparison of the fluorescent RT-PCR results(Ct value)of GOS gene based on ultrasonic and conventional treatments for rice samples incubated in hexadecyltrimethyl ammonium bromide(CTAB)lysis buffer
Microsoft Office Excel 2003无重复双因素方差分析表明,样品颗粒细度对样品荧光PCR检测Ct值的影响达到显著水平(F=5.04,F0.05=3.44,P<0.05),而 CTAB 温育处理(含常规与超声波)的影响达到极显著水平(F=33.72,F0.01=11.26,P<0.01),分析结果与 DNA 浓度完全一致.不论样品颗粒细度多大,CTAB 温育时间多少,超声波温育处理获得的荧光PCR检测Ct值均明显低于常规温育处理(图2-A、B、C),无重复单因素方差分析表明,CTAB超声波温育处理与常规温育处理获得的内源基因GOS荧光PCR检测的Ct值有极显著差异(F=11.17,F0.01=8.53,P<0.01).在各样品颗粒细度中,CTAB 温育时间相同,超声波温育处理获得的Ct值均低于相应常规温育处理(图2-A、B、C),其中超声波温育30与60 min(表4、图2-B与 C)都达到显著水准(F30min=8.10,F1h=10.47,F0.05=7.71,P<0.05),超声波温育 10 min 处理(表 4、图 2-A)未达到显著水准(F10min=0.89,F0.05=7.71,P>0.05).
图2 CTAB超声波温育处理与常规温育处理对水稻种子GOS内源基因Ct值影响的比较Fig.2 Comparison of the Ct values of endogenous GOS gene from rice seed samples incubated in hexadecyltrimethyl ammonium bromide(CTAB)lysis buffer by ultrasonic and conventional treatments
2.3 DNA提取方法的比较与优化
2.2中CTAB超声波温育处理30与60 min对水稻内源GOS基因的荧光PCR检测有显著性影响,因此选这两个处理与先前研究[13]优化的常规温育4 h与8 h处理的结果进行比较.表5可知,DNA质量浓度常规温育8 h处理与超声波处理60 min比较接近,均高于常规温育4 h处理与超声波温育处理30 min.图3表明,样品颗粒细度越小,所提的DNA质量浓度越高,与先前研究结果一致[13].样品颗粒细度<50目时,4种处理的DNA质量浓度差异不大;样品颗粒细度在50-100目时,超声波温育处理1 h的DNA质量浓度最高,其余的DNA质量浓度从高到底依次是常温温育8 h、4 h与超声波温育处理30 min;样品颗粒细度>100目时,4种处理的DNA质量浓度均较高,常规温育处理8 h与超声波处理60 min的DNA质量浓度差异不大,均高于常温温育4 h与超声波温育处理30 min.
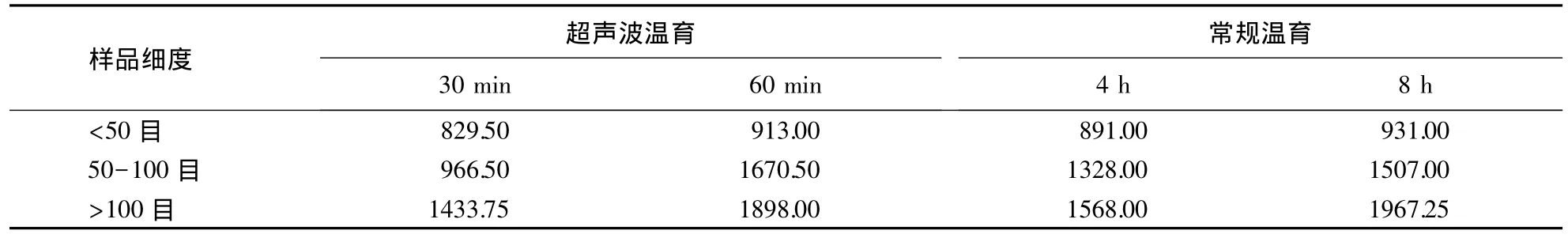
表5 优化的超声波处理与常规温育处理提取的DNA质量浓度Table 5 The DNA concentration of rice seed samples extracted by optimized ultrasonic treatment and conventional incubation treatment ng·μL-1
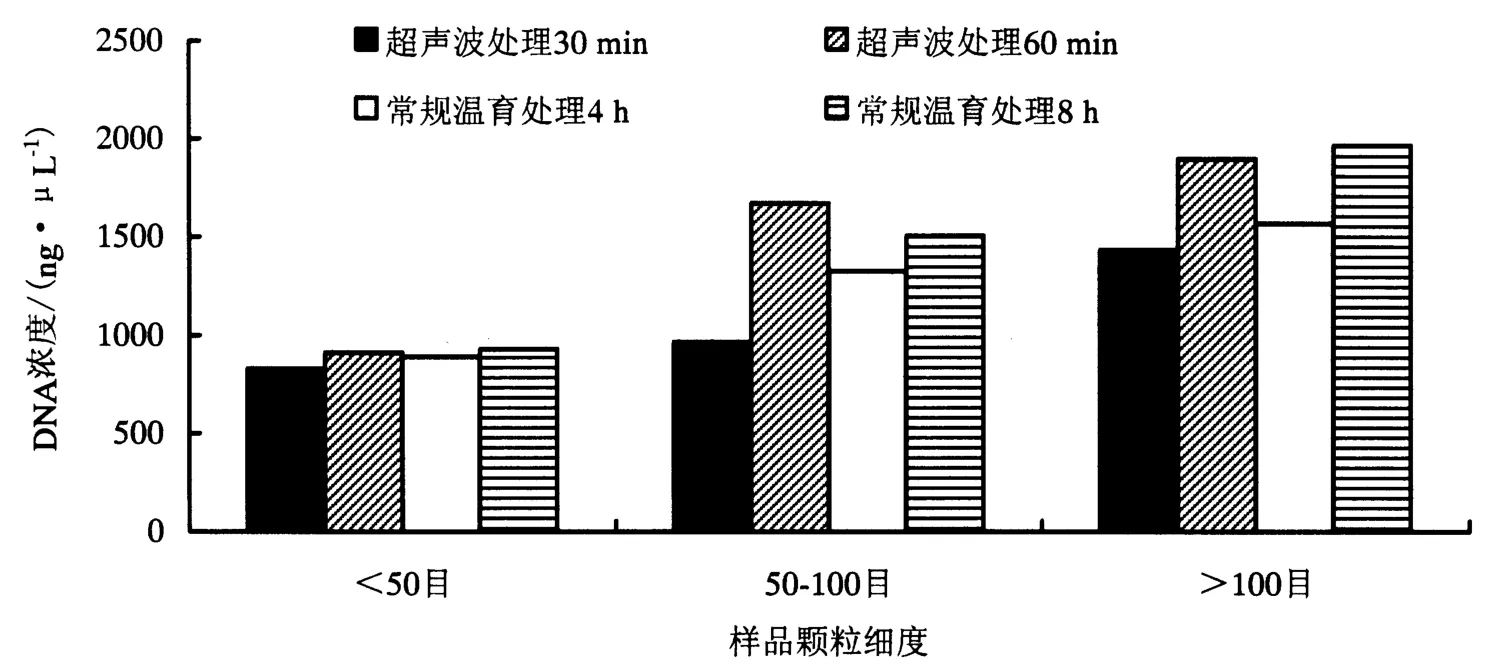
图3 温育超声波处理30 min、60 min与常规处理4 h、8 h的DNA浓度比较Fig.3 Comparison of the DNA concentration of rice seed samples extracted by ultrasonic treatment incubating for 30 min,60 min and conventional treatment for 4 h,8 h in hexadecyltrimethyl ammonium bromide(CTAB)lysis buffer
从水稻内源GOS基因的荧光PCR检测的Ct值来看,表4与表6可知,Ct值较小即PCR检测灵敏度较高的是常温温育8 h、4 h与超声波温育处理30、60 min 4个处理,样品灵敏度越细,Ct值越小(图4),但4 个处理间差异单因素(仅考虑温育处理)方差分析 F 检验不显著(F=1.33,F0.05=4.06,P>0.05).各种处理两两单因素(温育处理)方差分析发现:超声波温育处理60 min与常规温育8 h对GOS基因的荧光PCR检测的Ct值的影响,与其他处理比较,具有差异显著性的最多,其次是超声波温育30 min处理(表7).可见超声波温育处理30与60 min可以达到常规温育8 h的效果(图4),说明超声波温育处理大幅度缩短了DNA提取时间,只需30-60 min,至少可节省7 h,且能保证荧光PCR检测结果的准确性,提高了水稻种子物种成分的检测效率.

表6 超声波温育处理30 min、60 min与CTAB的常规温育4 h、8 h获得的水稻种子内源GOS基因荧光PCR Ct值比较Table 6 Comparison of the fluorescent RT-PCR results(Ct value)of GOS gene based of rice samples on ultrasonic incubating for 30 min,60 min and conventional incubating for 4 h,8 h in hexadecyltrimethyl ammonium bromide(CTAB)lysis buffer
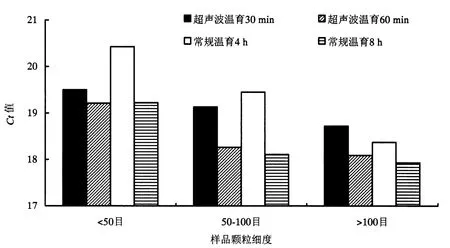
图4 温育超声波处理30 min、60min与常规处理4 h、8 h获得的GOS荧光PCR Ct值比较Fig.4 Comparison of the Ct values of endogenous GOS gene from rice seed samples incubated in hexadecyltrimethyl ammonium bromide(CTAB)lysis buffer by ultrasonic treatment incubating for 30 min,60 min and without ultrasonic treatment for 4 h,8 h
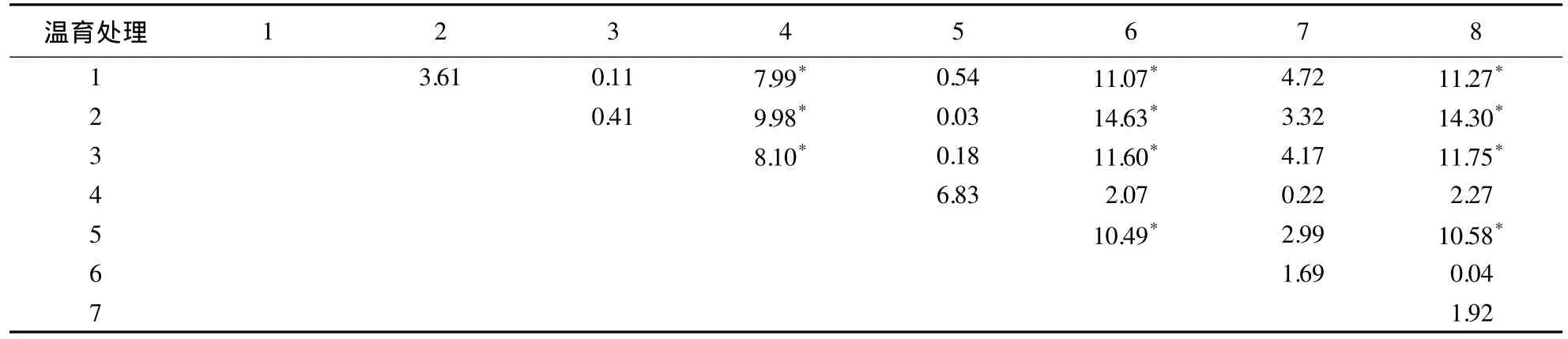
表7 不同温育处理对GOS基因Ct值影响显著性的F检验1)Table 7 F test for the effect of various incubating treatments on Ct values of GOS gene
3 结论
作者曾研究65℃恒温CTAB温育时间与样品颗粒细度等前处理对水稻种子DNA提取效果与荧光PCR检测灵敏度的影响,发现不管样品颗粒细度如何,CTAB温育时间对水稻种子DNA提取效果与荧光PCR检测灵敏度有显著或极显著影响,且最佳组合是CTAB温育时间>8 h(过夜)与样品颗粒细度>100目[13].由于温育时间>8 h(过夜)费时太长,于是作者又进行了本研究.本研究结果发现,在超声波荡温育处理30-60 min,使得样品与CTAB裂解缓冲液快速、充分反应,能够达到温育时间>8 h的DNA提取与荧光PCR检测(水稻内源GOS基因)效果,该方法比DNA提取效果最好的常规温育8h处理节省了至少7 h,在保证荧光PCR检测结果准确的前提下,建立了更快速的DNA提取方法,与其他试验材料研究结果一致[14-15],具有广泛的推广应用前景.
利用超声波振荡温育处理,建立的DNA提取方法最佳步骤:称取500 mg样品粉末(>50目)于50 mL离心管中,加入5 mL质量浓度为20 g·L-1的CTAB裂解缓冲液,于65℃恒温数控超声波清洗器(500 W、40 KHZ)中(使用功率100%)振荡温育处理30 min-1,其余步骤按文献[6],最后将获得的DNA溶于200 μL 的0.1 × TE 缓冲液(pH 8.0)中,充分涡旋后,测定DNA 溶液的D260nm/D280nm值与质量浓度(ng·μL-1),当天使用的放置于4℃冰箱中备用,隔天使用,放置于-20℃下冷冻保存.
[1]钱前,陈洪.真假杂交稻II优63的RAPD鉴定[J].中国水稻科学,1996,10(4):241.
[2]张辉,姜勇.杂交水稻品种鉴定和纯度分析技术研究进展[J].安徽农业科学,2009,37(20):9416-9419.
[3]王凤格,易红梅,赵久然,等.NY/T 1432-2014玉米品种鉴定技术规程SSR标记法[S].北京:中国农业出版社,2014.
[4]薛艳颖,陈兴奎,樊严.SSR分子标记技术在杂交玉米种子纯度鉴定中的应用[J].杂粮,2007,27(1):6-7.
[5]赵虹,徐国华,廖芳丽.SSR分子标记技术在杂交水稻种子纯度鉴定中的作用[J].湖北农业科学,2011,50(17):3490-3491.
[6]MADE D,DEGNER C,GROHMANN L.Detection of genetically modified rice:a construct-specific real-time PCR method based on DNA sequence from transgenic Bt rice[J].European Food Research Technology,2006,224(2):217-278.
[7]黄新,张琰,侯立华,等.转基因水稻“科丰6号”实时荧光PCR定性定量检测方法研究[J].生物技术通报,2010(2):90-93.
[8]REITING R,GROHMANN L,MADE D.A testing cascade for the detection of genetically modified rice by real-time PCR in food and its application for detection of an unauthorized rice line similar to KeFeng6[J].Journal of Consumer Protection and Food Safety[J].2012,5(2):185-188.
[9]陈红运,黄文胜,朱水芳,等.SN/T 1194-2003植物及其产品转基因成分检测抽样与制样方法[S].北京:中国标准出版社,2003.
[10]陈红运,梁新苗,陈双雅,等.SN/T 2584-2010水稻及其产品中转基因成分实时荧光PCR检测方法[S].北京:中国标准出版社,2010.
[11]张冰,王志纯,邵碧英,等.荧光聚合酶链式反应检测白粿干模拟转基因样品前处理优化[J].食品科学,2014,35(2):243-247.
[12]江树勋,张冰,邵碧英,等.影响米粉干转基因成分荧光PCR检测的若干因素分析[J].食品工业科技,2014,35(21):154-158.
[13]王志纯,张冰,邵碧英,等.水稻种子样品前处理对转基因成分荧光PCR检测的影响[J].福建农林大学学报:自然科学版,2015,44(1):8-13.
[14]阎晓菲,林善,童婷,等.超声波提取牛奶中细菌DNA方法的优化[J].中国畜牧兽医,2014,41(5):89-93.
[15]魏国美,韩涛,许任伟,等.冠突散囊菌DNA提取方法的比较[J].福建轻纺,2014(1):43-47.
[16]蒋春燕,王泰健,王琴,等.实时荧光定量 PCR 技术[J].动物医学进展,2005,26(12):97-101.
