黄芪多糖激活Nrf2/HO-1信号通路改善模型大鼠糖尿病性肝损伤
2020-10-28曲敬蓉张艳艳宿宏佳李静静毛淑梅
曲敬蓉,张艳艳,宿宏佳,李静静,李 浩,张 腾,刘 英,毛淑梅
(1. 潍坊医学院药理学教研室,山东 潍坊 261053;2. 山东中医药大学博士后科研流动站, 山东 济南 250355;3. 高密市人民医院麻醉科,山东 高密 261500;4. 大连医科大学药学院,辽宁 大连 1160441;5. 山东中医药大学附属医院, 山东 济南 250011)
近年糖尿病患病率逐渐增高,众多患者因糖尿病而引起肝损伤,后者是糖尿病致死的重要原因之一。因其发病机制复杂,目前糖尿病性肝损伤尚无特效药物。研究显示[1],过强的氧化应激反应在糖尿病性肝损伤中起促进作用,故抗氧化应激被视为一种重要的治疗手段。转录因子NF-E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)/血红素氧合酶(heme oxygenase,HO)-1信号通路是机体重要的氧化应激保护体系之一,调控Nrf2/HO-1通路可改善多种因素引起的肝脏损伤[2]。黄芪多糖(astragalus polysaccharide,APS)是从黄芪中分离获取的多糖类有效成分,具有抗炎、抗氧化等多种药理作用,在多种疾病模型中显示出调节Nrf2或HO-1表达的作用[3-4]。课题组前期研究显示,APS对糖尿病引起的肾损伤具有良好的保护作用[5],但APS对2型糖尿病引起的肝脏损伤是否具有保护作用,其作用是否与调节Nrf2/HO-1通路有关,未见报道。本研究针对黄芪多糖防治糖尿病性肝损伤及其机制进行了探讨。
1 材料与方法
1.1 材料
1.1.1实验动物 Wistar大鼠(♂)50只,体质量(200±20) g,购自山东鲁抗公司(实验动物合格证号:SCXK鲁20130001)。饲养在大鼠通气笼具系统中,饲养环境温度维持在(23~26) ℃,实验方案经潍坊医学院实验动物伦理委员会批准。
1.1.2主要试剂 APS(纯度:70%)购自广东省惠州市东方公司;盐酸二甲双胍片购自齐鲁制药;STZ(S0130)购自美国 Sigma公司;SOD(A001-3-2)、MDA(A003-1-2)购自南京建成生物工程研究所;HE染色试剂盒(G1120 )、PAS染色试剂盒(G1281)、Masson染色试剂盒(G1120 )、RIPA裂解液(R0020)购自Solarbio公司;BCA蛋白定量试剂盒(CW0014S)购自北京CWBIO公司;Nrf2抗体(ab31163)、HO-1抗体(ab13248)购自美国Abcam公司;p-Nrf2抗体(bs-2013R)购自北京BIOSS公司;β-actin抗体(TA-09)、羊抗兔IgG(ZDR-5306)、羊抗小鼠IgG(ZDR-5307)购自北京Zsbio公司;TRIzol (15596026)购自美国Thermo Fisher公司;逆转录试剂盒(FSQ-101)购自日本TOYOBO公司;扩增试剂盒(204052)购自德国QIAGEN公司。
1.1.3主要仪器 大鼠通气笼具系统(IVC-56/30-A/B):上海天环科技有限公司;石蜡切片机(RM2235):德国Leica公司;NanoDrop One:美国Thermo Fisher公司;梯度PCR仪(Mastercycler pro):德国Eppendorf公司;电泳仪、转膜仪等(Mini-Protean):美国Bil-Rad公司;Spectra Max M5:美国Molecular Devices公司;荧光定量PCR仪(LightCycler 480Ⅱ):美国Roche公司。
1.2 方法
1.2.1造模、分组及给药 本文采用文献中广泛使用的高糖高脂饮食联合链脲佐菌素(STZ)法制备二型糖尿病大鼠模型。随机选取40只大鼠,高糖高脂饲料喂养8周;8周后大鼠腹腔注射STZ(25 mg·kg-1),72 h过后测定大鼠随机血糖,血糖≥16.7 mmol·L-1者视作成模,选取成模大鼠的32只随机分为4组:模型组(Model)、二甲双胍组(Metformin)、APS高剂量组(APS High)、APS低剂量组(APS Low),每组8只。另纳入8只健康大鼠为正常组,大鼠予以普通饮食,腹腔注射等容积缓冲液。
APS低剂量组以APS 200 mg·kg-1·d-1灌胃,APS高剂量组以APS 400 mg·kg-1·d-1灌胃,二甲双胍组以二甲双胍250 mg·kg-1·d-1灌胃,模型组和正常组以等容积溶剂(生理盐水)灌胃。连续给药12周,实验过程中每组有1~2只大鼠死亡,12周后处死大鼠并取材。
1.2.2形态学实验 摘取大鼠肝脏组织后,立即固定、包埋,切片(厚4 μm)后,65 ℃ 烘烤4 h,脱蜡至水后,HE染色对大鼠肝脏病理变化进行观察,PAS染色确定大鼠肝细胞中的相对糖原含量变化,Masson染色观察大鼠肝脏纤维组织增生。
1.2.3氧化应激指标检测 取100 mg肝脏组织制成10%组织匀浆。4 ℃ 3 500 r·min-1离心10 min后取上清。按说明书操作,用WST-1法测定肝脏SOD活力,用TBA法测定肝脏MDA水平。
1.2.4Western blot 取100 mg新鲜肝脏组织,加入RIPA裂解液和PMSF(RIPA ∶ PMSF=100 ∶ 1),置冰上制成匀浆后静置10 min,4 ℃ 12 000 r·min-1离心15 min后取上清,用BCA法测定浓度,滴加相应量上样缓冲液,100 ℃ 10 min。配制SDS-PAGE 凝胶,上样、电泳、转膜、封闭后,加入Nrf2(1 ∶ 1 000)、p-Nrf2(1 ∶ 1 000)、HO-1(1 ∶ 1 000)和β-actin(1 ∶ 1 000)的一抗,4 ℃孵育过夜。加入对应二抗(1 ∶ 5 000),室温下孵育1 h,使用增强的化学发光(ECL)试剂检测抗原-抗体复合物,曝光后用Image J进行灰度分析。
1.2.5Q-PCR 用TRIzol法提取新鲜肝脏组织的RNA,配制20 μL体系,37 ℃ 15 min,95 ℃ 5 min得到cDNA。按比例加入cDNA、引物和染料,95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s(40个循环)扩增。引物序列如下:Nrf2 5′-CTGGCTGATACTACCGCTGTT-3′(正向)、5′-GTGGAGAGGATGCTGCTGAA-3′(反向);HO-1 5′-ACAGAAGAGGCTAAGACCG-3′(正向)、5′-CAGGCATCTCCTTCCATT-3′(反向);β-actin 5′-TCACCCACACTGTGCCCCATCTACGA-3′(正向)、5′-CAGCGGAACCGCTCATTGCCAATGG-3′(反向)。采用比较阈值循环(CT)法,用方程2-ΔΔCT进行数据处理后用Graphpad Prism8.0做统计图。
2 结果
2.1 HE染色如Fig 1所示,正常组大鼠肝细胞结构清晰,细胞核形态正常。模型组大鼠肝细胞排列松散、形态改变,可见脂肪空泡,细胞核固缩、分裂甚至消失,胆小管出现增生。与模型组相比,二甲双胍组的肝细胞排列整齐,无明显脂肪空泡,形态得到改善;APS组的肝细胞排列较整齐,胆小管发生轻微增生,形态有所改善。
2.2 PAS染色如Fig 2所示,正常组大鼠肝细胞排列整齐,糖原着浅紫红色;模型组大鼠肝细胞排列松散,浅紫红色糖原数量明显减少;APS组大鼠的肝细胞排列较整齐,浅紫红色糖原数量较模型组明显增多,效果与二甲双胍组基本一致。
2.3 Masson染色如Fig 3所示,正常组大鼠肝细胞排列规则、形态结构正常,肝细胞未发生变性,未发现明显的胶原纤维;模型组大鼠肝细胞排列松散,出现脂肪空泡,间隙变宽且存在明显胶原纤维;APS组大鼠肝细胞结构与模型组相比结构相对正常,脂肪空泡和胶原纤维数量较少,效果与二甲双胍组基本一致。
2.4 APS对糖尿病大鼠肝脏SOD活力、MDA水平的影响如Tab 1所示,模型组大鼠肝脏组织SOD活力较正常组明显降低,二甲双胍组的SOD活力较模型组明显升高(P<0.05),APS组SOD活力较模型组有所升高(P<0.05),效果不及二甲双胍。模型组大鼠肝组织MDA水平较正常组明显升高,二甲双胍组MDA水平较模型组明显降低(P<0.05),APS组SOD活力较模型组有所降低(P<0.05),效果不及二甲双胍。

Fig 1 HE staining (×400) A: Control; B:Metformin; C: APS High; D: APS Low; E: Model

Fig 2 PAS staining (×400)A: Control; B:Metformin; C: APS High; D: APS Low; E: Model

Fig 3 Masson staining (×400)A: Control; B:Metformin; C: APS High; D: APS Low; E: Model

Tab 1 Effects of APS on oxidative stress levels of
2.5 APS对糖尿病大鼠肝脏Nrf2、p-Nrf2、HO-1蛋白表达水平的影响如Fig 4所示,模型组大鼠肝脏组织Nrf2、p-Nrf2和HO-1的蛋白表达水平较正常组明显降低(P<0.05),二甲双胍组大鼠肝脏组织的三者水平较模型组均升高(P<0.05),APS组的Nrf2、p-Nrf2和HO-1的蛋白表达水平较模型组也有所升高(P<0.05)。
2.6 APS对糖尿病大鼠肝脏Nrf2、HO-1 mRNA表达水平的影响如Fig 5所示,模型组Nrf2和HO-1的mRNA表达水平较正常组降低(P<0.05)。二甲双胍组大鼠的二者表达水平明显高于模型组(P<0.05)。APS组的Nrf2和HO-1的mRNA表达水平较模型组也有所升高(P<0.05)。
3 讨论
糖尿病引起的肝损伤在糖尿病并发症中致死率较高,其发病机制复杂,尚无特效药。由于中药及其提取物具有多靶点、不良反应相对较小等特点,多种中药及提取物被用于糖尿病性肝病的治疗,并显示了较好的疗效[6]。前期课题组研究发现,APS能够防治大鼠糖尿病肾病[5],而APS是否能够防治糖尿病引起的肝损伤尚未见报道。二甲双胍作为2型糖尿病一线治疗药物,不仅可以降低血糖,研究尚证实二甲双胍具有良好的肝脏保护作用,其作用与抑制氧化应激有关[7],本研究选择二甲双胍作为阳性对照药物。本研究制备2型糖尿病大鼠模型12 W后,形态学实验发现模型组大鼠肝脏存在病理损伤;而与模型组比较,经APS干预的糖尿病大鼠肝脏损伤明显减轻,说明APS能够缓解糖尿病引起的肝脏损伤。

Fig 4 Relative protein expressions of Nrf2, p-Nrf2, HO-1
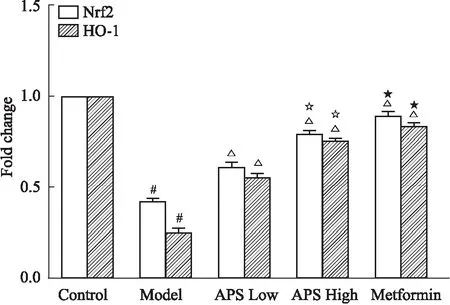
Fig 5 Relative expression of mRNA of Nrf2, HO-1
糖尿病导致的肝损伤机制复杂,其中糖尿病机体过强的氧化应激反应被认为参与了肝损伤的发生,抗氧化应激反应被认为是治疗糖尿病肝损伤的一项有益策略[1]。中药黄芪的抗氧化作用已被大量文献证实,其提取物APS亦在多种疾病模型中显示出了抑制氧化应激的作用[8],但APS是否对糖尿病引起的肝脏局部氧化应激反应具有调节作用,尚无报道。本研究结果显示,与正常组相比,模型大鼠肝脏局部MDA水平明显升高、而SOD活力明显降低,表明糖尿病大鼠肝脏局部氧化应激水平升高,这与既往报道一致[9]。但经APS干预后,与模型组比较,APS组大鼠肝脏局部MDA水平明显降低、而SOD水平明显升高,上述结果表明APS对糖尿病引发的肝脏氧化应激反应具有抑制作用。鉴于氧化应激反应对糖尿病肝损伤的促进作用,推测本研究中APS对糖尿病大鼠的肝脏保护作用可能与其抑制肝脏氧化应激水平有关。
HO-1是机体防御氧化应激的重要机制之一,研究证实机体发生多种损伤均与HO-1表达异常或活性异常有关[10-11],而通过上调HO-1表达,可调节MDA、SOD等物质的水平,改善氧化应激引起的损伤[12]。本研究结果显示,糖尿病大鼠肝脏中HO-1水平明显降低;与本结果类似,Wen等[13]研究发现糖尿病大鼠肝脏、肾脏及胰腺组织中HO-1下降。而本研究中经APS干预后,糖尿病大鼠肝脏HO-1水平明显升高,表明APS可增加糖尿病大鼠肝脏HO-1表达;结合HO-1 在机体氧化应激防御系统中的作用,推测APS抗氧化应激作用可能与其上调HO-1表达有关。Nrf2是一种可调控HO-1表达的转录因子,当Nrf2发生磷酸化而被激活后可进入细胞核,在细胞核内磷酸化的Nrf2可促进HO-1的基因表达[14]。大量研究表明[15],上调Nrf2表达及增加Nrf2活化可降低机体氧化应激水平,从而对细胞产生保护作用。而一项新近研究显示,APS可通过调节Nrf2表达而减轻替米考星引起的肝脏损伤[4]。但APS对糖尿病机体肝脏Nrf2表达是否具有调节作用,未见报道。本研究结果显示,糖尿病大鼠肝脏Nrf2表达较正常组大鼠明显降低,Nrf2磷酸化水平亦低于正常组大鼠。而经过APS干预后,糖尿病大鼠肝脏Nrf2表达明显增加,其磷酸化水平亦明显升高,表明APS可上调糖尿病大鼠肝脏Nrf2表达并促进其活化。鉴于Nrf2对HO-1表达具有调控作用,推测APS可能通过增加Nrf2表达并促进其活化而上调了糖尿病大鼠肝脏HO-1的表达,激活Nrf2/HO-1信号通路而发挥了肝脏保护作用。
综上所述,APS能够改善糖尿病大鼠的肝脏损伤,其作用机制可能与激活大鼠肝脏Nrf2/HO-1信号通路有关。