姜黄素通过调节PCSK9促进肝细胞摄取血浆LDL-C
2020-10-28王楚瑶蒋素素向德彪杨慧仙邵倞琦李博洁袁育林贺卫和龙石银张彩平廖端芳
王楚瑶,蒋素素,向德彪,杨慧仙,邵倞琦,李博洁,袁育林,贺卫和,张 敏,龙石银,田 英,张彩平,廖端芳
(1. 南华大学衡阳医学院生物化学与分子生物学教研室,湖南 衡阳 421001;2. 湖南中医药大学药学院药理学教研室,湖南 长沙 410208; 3. 南华大学衡阳医学院心血管疾病研究所,湖南 衡阳 421001)
1 材料与方法
1.1 实验材料
1.1.1细胞模型 将过表达及干扰PCSK9慢病毒,转染至HepG2细胞和LO2细胞。
1.1.2材料 药品与试剂:姜黄素(curcumin)购于美国Sigma公司(货号:08511);瑞舒伐他汀(rosuvastatin)购于RHAWN(罗恩试剂)(货号:R012409);高糖DMEM购于Gibco公司(货号:C11995500BT);胎牛血清购于四季青公司(货号:13011);胰酶细胞消化液购于碧云天公司(货号:C0202);苏木精(货号:H8070)、4%组织细胞固定液(货号:P1110)均购于Solarbio公司;油红O购于AMRESCO公司(货号:0684);人源性LDL购于广州弈源公司(货号:YB-001);总胆固醇测定试剂盒购于Cell Biolabs(货号:STA-384);兔抗LDLR(货号:Ab52818)、兔抗人PCSK9(货号:ab52754)均购于Abcam公司;兔抗人β-actin13E5(货号:4970)购于CST公司;HRP标记的山羊抗兔二抗购于absin公司(货号:abs20040);其余均为进口或国产分析纯试剂。
1.1.3实验仪器 超净工作台购自苏州安泰公司;倒置显微镜购于Carl Zeiss公司、荧光显微镜购自 Olympus 公司;CO2培养箱购于Thermo(America)公司;高速冷冻离心机购于 Eppendorf(German)公司;双垂直蛋白电泳购自北京六一生物科技有限公司;高灵敏度化学发光成像仪购于Tanon 6200公司。
1.2 实验方法
1.2.1实验分组 油红O,胆固醇实验分组:(1) Basal;(2) Control(25 mg·L-1LDL);(3) RNAi-PCSK9/OE-PCSK9+Curcumin(25 mg·L-1LDL+25 μmol·L-1Curcumin);(4) RNAi-PCSK9/OE-PCSK9+Rosuvastatin(25 mg·L-1LDL+ 10 μmol·L-1Rosuvastatin)。Western blot实验分组:(1) Basal(HepG2/LO2细胞); (2) Control(OE/RNAi-PCSK9-Control-HepG2/LO2细胞); (3) RNAi-PCSK9-1/2/3(HepG2/LO2细胞); (4) OE-PCSK9(HepG2/LO2细胞)。
1.2.2慢病毒转染实验 上海吉凯基因有限公司设计与合成RNAi/OE-PCSK9引物,构建重组体进行测序以及PCSK9 mRNA表达的测定。利用293T 细胞包装PCSK9过表达及干扰慢病毒。培养细胞生长至对数生长期细胞,按5×104个每孔接种到六孔板中培养24 h,加入病毒稀释液培养12 h后更换为全血清培养基,48 h之后加入5 mg·L-1嘌呤霉素筛选3~4 d,转移至无菌培养瓶中培养。
1.2.3荧光显微镜检测干扰/过表达PCSK9细胞模型荧光强度 细胞长到对数生长期,以每孔105个细胞种板至预置好的无菌六孔板,培养24 h之后在荧光显微镜下观察荧光强度。
1.2.4油红O染色观察细胞内脂质摄取 将细胞培养至对数生长期,每孔105个细胞接种到准备好的六孔板上,每孔放一块灭菌盖玻片。培养24 h后按照实验分组加入姜黄素及瑞舒伐他汀分别处理24 h,4 %组织细胞固定液室温固定30 min之后用油红O染色液染色3 min,苏木精染色30 s,甘油封片,在倒置显微镜下观察拍照,可见细胞内脂滴呈橙红色,细胞核呈淡蓝色。
1.2.5Western blot检测干扰/过表达PCSK9细胞蛋白表达 将细胞消化成均匀的细胞悬液,每孔4×105个细胞接种到细胞瓶中,培养24 h,收集细胞提取蛋白,BCA检测蛋白浓度,加入上样缓冲液,沸水煮5 min用于Western blot实验,根据1 ∶ 500(LDLR)、1 ∶ 1 000(PCSK9)、1 ∶ 1 000(β-actin)、1 ∶ 5 000(二抗)的稀释比例进行孵育。检测PCSK9、LDLR蛋白表达,验证过表达及干扰效果。
1.2.6酶法检测细胞内胆固醇含量 对数生长期细胞按每瓶2×105个细胞接种到无菌细胞瓶中培养24 h,加入姜黄素与瑞舒伐他汀培养24 h,使用预冷的PBS轻柔洗3次,胰酶消化细胞并收集细胞,离心,加入200 μL裂解液,冰上裂解30 min。取上清液,60 ℃干燥过夜,取沉淀溶于200 μL 1 μmol·L-1NaOH中,用于BCA测定各组细胞内总蛋白含量用于标准化各组样本胆固醇数值。烘干的胆固醇进行真空干燥30 min加入200 μL胆固醇分析稀释液,按照总胆固醇测定试剂盒(CELL BIOLABS)说明书,制备好的样品加入96孔板中,每孔加入胆固醇反应试剂用酶标仪分别测定总胆固醇和游离胆固醇含量。将样品所测得的吸光度值代入预先做出的胆固醇标准曲线的线性回归方程当中,计算出样品中胆固醇的浓度。标化后胆固醇的浓度单位采用总胆固醇或游离胆固醇与蛋白浓度的比值,即μmol·L-1。
2 结果
2.1 倒置荧光显微镜下检测细胞内荧光强度根据暗视野中细胞形态以及荧光强度筛选最适感染条件。预实验结果显示5 mg·L-1聚凝胺(polybrene)可以显著提高转染效率,因此后续实验感染条件为10% FBS DMEM+5 mg·L-1polybrene。RNAi组慢病毒MOI(multiplicity of infection)为30,OE组MOI为20。感染成功后镜下观察,HepG2细胞和LO2细胞的RNAi组和OE组均可见均匀绿色荧光,可知慢病毒稳转进入HepG2和LO2细胞,可进行后续实验(Fig 1)。
2.2 Western blot检测慢病毒转染完成后,细胞内PCSK9以及LDLR蛋白表达水平慢病毒转染细胞模型构建成功后,提取细胞总蛋白用于Westernblot实验,检测PCSK9和LDLR蛋白表达。结果显示,慢病毒干扰PCSK9 HepG2细胞组(RNAi-PCSK9-1)的PCSK9蛋白表达显著降低(P<0.01),RNAi-PCSK9-1 LDLR蛋白表达升高(P<0.01);慢病毒干扰PCSK9 LO2细胞组(RNAi-PCSK9-3)的PCSK9蛋白表达显著降低(P<0.01),RNAi-PCSK9-3 LDLR蛋白表达升高(P<0.01);过表达PCSK9 (OE-PCSK9) HepG2/LO2组的PCSK9蛋白表达显著升高(P<0.01),OE-PCSK9 LO2细胞组LDLR蛋白表达降低(P<0.01),OE-PCSK9 HepG2细胞组LDLR蛋白表达降低(P<0.05)。结果符合预期,说明慢病毒转染PCSK9细胞模型构建成功(Fig 2)。
2.3 油红O染色观察姜黄素对干扰及过表达PCSK9细胞内脂质摄取的影响姜黄素及瑞舒伐他汀处理24 h后,油红O结果显示:Control组细胞内脂滴较Basal组多,提示已模拟高脂环境。姜黄素(25 μmol·L-1)与瑞舒伐他汀(10 μmol·L-1)处理24 h后,可见细胞内脂滴明显增多,经GraphPad Prism 5软件分析数据显示,分别与Control组相比,NAi-PCSK9-1 HepG2组 (P<0.05) 脂质含量增加;瑞舒伐他汀处理后,RNAi-PCSK9-1 HepG2组 (P<0.01)脂质含量增加,LO2细胞结果同上,姜黄素处理后RNAi-PCSK9-3 (P<0.01)脂质含量增加;瑞舒伐他汀处理后RNAi-PCSK9-1组 (P<0.01)以及OE-PCSK9组(P<0.01)脂质含量增加。提示姜黄素能促进干扰/过表达PCSK9的HepG2/LO2细胞摄取LDL-C(Fig 3)。

Fig 1 Screen of optimal condition by RNAi/over-expression PCSK9 in HepG2/LO2 cells (×20)
2.4 酶法测定慢病毒转染细胞模型细胞内胆固醇摄取为进一步明确姜黄素是否特异调节PCSK9引起细胞内胆固醇含量增多,通过胆固醇酶法测定细胞内胆固醇含量,经SPSS17.0统计软件数据显示,分别加入姜黄素(25 μmol·L-1)与瑞舒伐他汀(10 μmol·L-1)孵育24 h,与无姜黄素与瑞舒伐他汀处理的Control组相比,胆固醇含量测定结果显示RNAi-PCSK9 HepG2组用姜黄素处理后总胆固醇(total cholesterol,TC),游离胆固醇(free cholesterol,FC)含量升高(P<0.01);RNAi-PCSK9 LO2组用姜黄素处理后TC,FC含量升高(P<0.01),OE-PCSK9 HepG2组FC含量降低(P<0.01),OE-PCSK9 LO2组总胆固醇 (P<0.01)降低;瑞舒伐他汀处理后RNAi-PCSK9 HepG2组TC,FC含量升高(P<0.01),OE-PCSK9组TC含量下降(P<0.01)FC含量下降(P<0.01);RNAi-PCSK9 LO2组TC,FC含量升高(P<0.01),OE-PCSK9组TC降低(P<0.01)FC降低(P<0.05)。提示姜黄素使细胞内胆固醇摄取增多(Fig 4)。
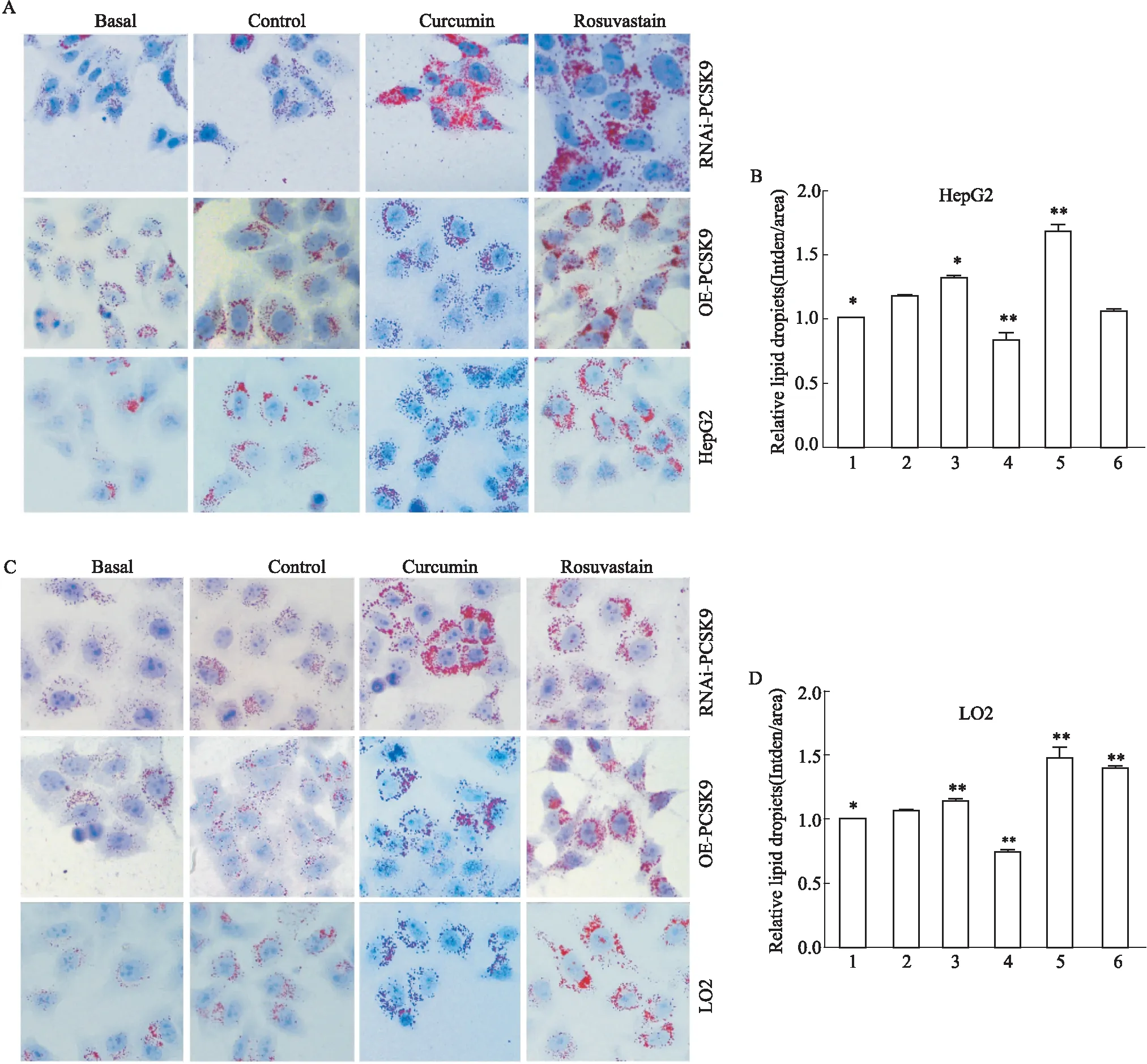
Fig 3 Oil red O staining of HepG2/LO2 cells infected by RNAi-PCSK9 and OE-PCSK9 treated with curcumin co-incubated with LDL (×400) n=3)
3 讨论
动脉粥样硬化性心血管疾病的重要危险因素之一是血浆LDL-C水平升高,而动脉粥样硬化性心血管疾病是患病后高死亡率高致残率的主要诱因[13]。LDL-C主要经LDLR内吞循环代谢经胆道从肠道排出体外。目前调节LDLR的表达及其在细胞表面分布的因子PCSK9,通过增强肝低密度脂蛋白受体的降解而参与胆固醇稳态的一种蛋白[14]。PCSK9是一种分泌性丝氨酸蛋白酶,细胞表面的LDLR的胞外域相互作用,来调节血浆中LDL-C的浓度。通过结合并内化后,PCSK9介导LDLR经溶酶体途径降解,从而抑制LDLR向肝细胞表面的再循环,并延迟肝脏对血浆LDL的分解代谢[15]。现已上市的PCSK9免疫抑制剂在临床Ⅱ和Ⅲ期研究中显示有显著降低血浆LDL-C水平,并使动脉粥样硬化性心血管疾病患病风险减少[16],然而因其用药方式的单一及其昂贵的价格,致使其临床大量使用仍有很长的距离,积极寻找降低PCSK9的药物依然迫切。
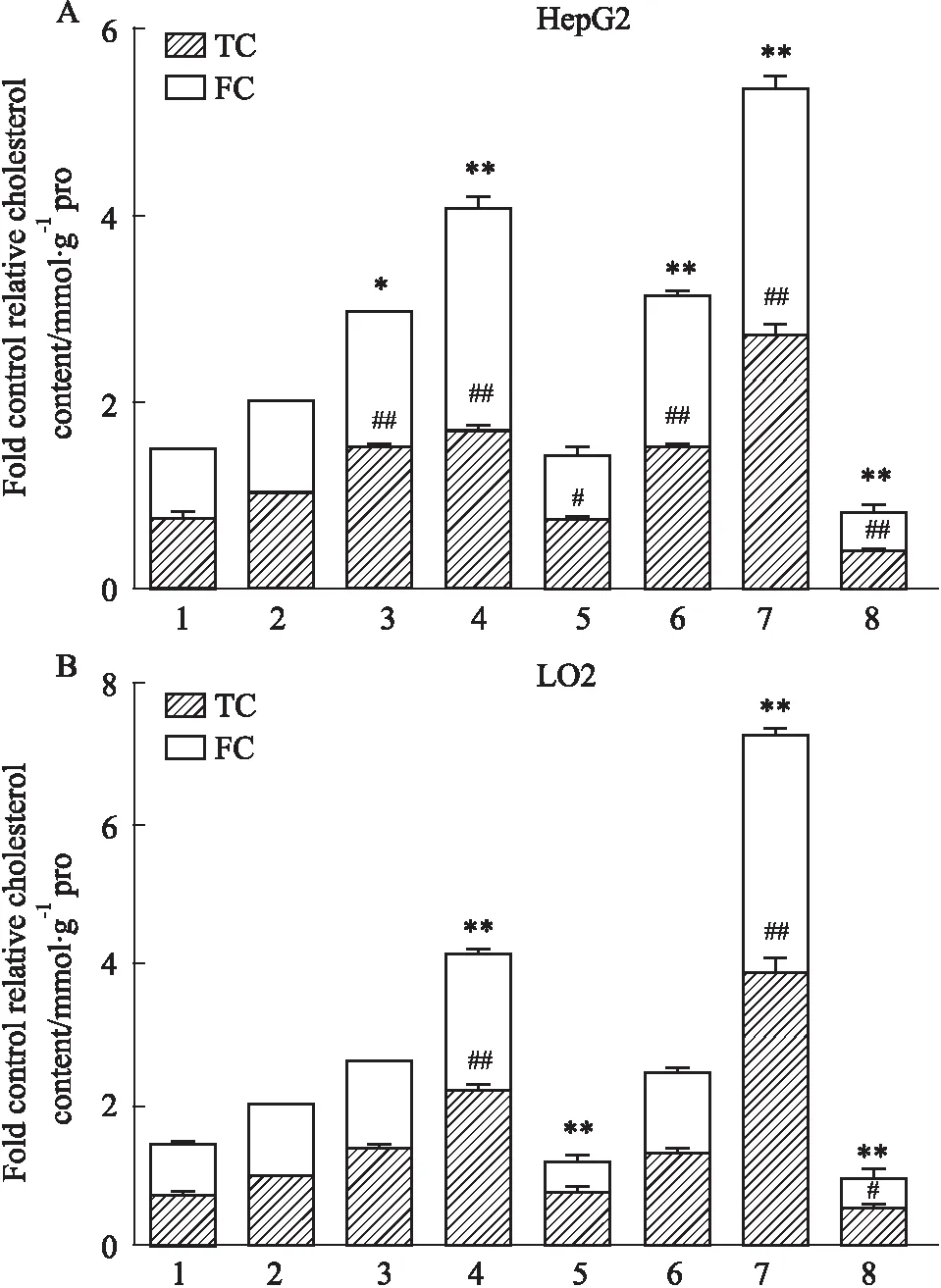
Fig 4 Effect of curcumin and rosuvastatin on content of total cholesterol and free cholesterol in HepG2/LO2 cells infected by OE-PCSK9 and RNAi-PCSK9
为明确姜黄素作用LDL-C的靶点,本实验构建过表达PCSK9以及干扰PCSK9的慢病毒,分别感染HepG2和LO2细胞,通过荧光显微镜测定慢病毒感染率,Western blot测定PCSK9/LDLR蛋白表达水平,以筛选稳转成功细胞模型。瑞舒伐他汀作为一种已上市的他汀类药物,有着较好的降血脂作用[17],因此,我们将瑞舒伐他汀作为阳性药物组以评测姜黄素的降低LDL-C的作用。用LDL孵育细胞模拟高脂环境,油红O及胆固醇酶法结果显示姜黄素和瑞舒伐他汀使RNAi/OE-PCSK9细胞内脂质摄取增加。本实验研究发现,姜黄素可逆转慢病毒转染的HepG2/LO2细胞过表达PCSK9引起的升高PCSK9蛋白表达的作用,可加强慢病毒转染的HepG2/LO2细胞干扰PCSK9引起的降低PCSK9蛋白表达,提示姜黄素特异性抑制PCSK9蛋白表达,升高肝细胞LDLR蛋白水平,促进摄取LDL-C。2018年,美国心脏病学会/美国心脏协会临床实践指南工作组报告指出使用PCSK9抑制剂会导致更高的生命周期成本,建议高危患者使用PCSK9抑制剂以提高其经济价值,以降低LDL-C为新靶点的药物开发仍在继续[18]。本课题组通过细胞实验探究姜黄素作用于PCSK9调节LDL-C摄取作用及其分子机制,因姜黄素用药方式的多样性,因此有着较为可观的临床应用前景,以期为新型临床调脂药物的研发提供理论依据。
(致谢: 本实验主要在脂蛋白与动脉硬化实验室完成,感谢老师及同学的支持及帮助)