金属Ce在高温蒸汽下的氧化动力学初步研究
2020-10-28张生栋孙晓祎丁有钱
黄 昆,陈 锦,张生栋,孙晓祎,丁有钱,白 龙
中国原子能科学研究院 放射化学研究所,北京 102413
铈(Ce)作为镧系元素中的第2号元素,是一种重要的稀土元素,也是镧系元素中化学性质最活跃、最复杂的金属元素之一,其价电子结构(4f15d16s2)与锕系元素U(5f36d17s2)和Pu(5f67s2)的价电子结构相近似,化学性质也非常活泼且本身无放射性[1],金属Ce与金属Pu、U均具有低熔点、非对称晶体结构、多种同素异形体共存、发生相变时均发生体积变化等特性[2-3]。因此,为减少研究工作的危险性及降低研究成本,可以利用金属Ce来模拟研究锕系元素U、Pu等材料的腐蚀行为和转化行为。
国外对金属Ce作为金属U、Pu模拟材料的实验研究也有报道,主要集中在熔炼模拟[4-6]和高放废物的固化研究[7],而国内在这方面的研究刚刚起步[8]。罗丽珠等[9]通过对Ce、Pu金属在氧化环境下的表面化学性质变化的比较发现,二者的氧化过程相似。金属Pu在水蒸气环境中氧化形成PuO2,但金属Ce蒸汽氧化的行为研究尚有待系统研究,关于金属Ce的氧化研究多关注氧气气氛下的氧化,陈丕恒[10]以金属Ce为研究对象,采用热重、差热扫描分析、扫描电子显微镜、激光拉曼、X射线衍射分析仪、X射线光电子能谱和数值模拟方法较系统地研究了金属Ce在氧气气氛下的氧化行为及氧化物间相互转换动力学。Ce与水蒸气的反应动力学相关研究目前鲜见报道。
本工作拟在蒸汽(氩气载带)条件下开展金属Ce蒸汽氧化行为研究,探讨金属Ce水蒸气氧化的过程机理,为Ce的蒸汽氧化转化提供理论支撑,继而为Pu、U的蒸汽氧化转化机理研究提供参考。
1 实验部分
1.1 仪器及材料
STA 449F3同步热分析仪,德国耐驰;BP211D天平,德国Sarorius公司,感量0.01 mg;FIX550氢气在线探测器,深圳市万迪科技有限公司,精度1×10-6(体积分数)。
Ce金属,Ce质量分数≥99.5%,北京红誉新材料有限公司生产;高纯氩气/氧气/氮气,纯度99.999%,北京普莱克斯实用气体有限公司。
1.2 实验方法
1.2.1热重分析法分析蒸汽氧化过程 采用线切割的方式将Ce金属块制备成若干φ5 mm×2 mm金属样片,样片用金相砂纸打磨后浸泡在煤油中保存。实验前使用滤纸将样片表面煤油擦拭干,并用无水乙醇清洗后吹干。待样片准备好后,将样片置于样品托上,转入热重分析仪反应腔内,设置载气(空气)流速为100 mL/min、保护气流速为20 mL/min、吹扫气流速40 mL/min,升温速率10 K/min,并根据实验需要设置进水流量,热重分析仪尾气排放管路设置氢气浓度在线探测器(如图1所示),可用于监测氧化过程产生的氢气含量变化。氧化产物通过拉曼光谱进行形态分析。
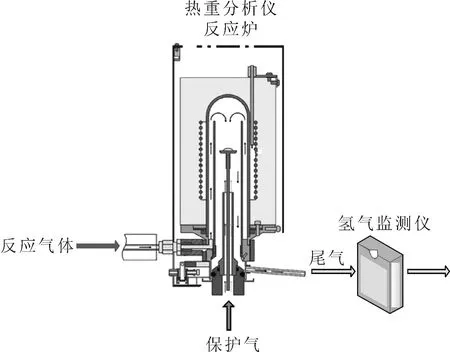
图1 实验装置示意图
1.2.2蒸汽浓度控制方法 反应过程通过热重分析仪自带蒸汽发生装置,通过控制进入蒸发腔的水量及载气流量(氩气)来获得不同蒸汽浓度(体积分数)。以单位时间内水的定量蒸发量,来计算气体中蒸汽量,蒸汽的产生速率由式(1)计算。
(1)
式中:n′(H2O)为标况下(0 ℃,0.101 3 MPa),蒸汽产生的摩尔速率,mol/min;m′(H2O)为标况下水的质量流量,g/h;M(H2O)为水的摩尔质量,18 g/mol。标况下载气流量(氩气)摩尔速率由式(2)计算。
(2)
其中:n′G为标况下载气流量摩尔速率,mol/min;V′G为标况下载气通入体积速率,mL/min;Vm为气体的摩尔体积,标况下为22.4 L/mol。根据物料守恒,认为在蒸汽不损失的情况下,工况下混合气体中蒸汽的摩尔分数由式(3)计算。
(3)
式中:n(H2O)、nG分别为工况下蒸汽产生的摩尔速率、载气流量摩尔速率。
混合气体主要是蒸汽与氩气的混合,气体压力为常压,因此工况下混合气体中蒸汽体积分数φ(H2O)即混合气体中蒸汽的摩尔分数,如式(4)所示。
(4)
2 结果与讨论
2.1 金属Ce蒸汽氧化过程
选取氩气载带50%(体积分数,下同)蒸汽作为反应气体,反应温度为300 ℃,通过热重分析仪实时监测样片质量变化,绘制反应过程曲线,表征反应速率的变化特征,结果示于图2。从图2可知,在50%(体积分数,下同)H2O-50%Ar、300 ℃、常压条件下,反应动力学曲线显示出Ce的蒸汽氧化过程呈现较为明显的阶段性。动力学曲线显现的阶段性特征说明在整个反应过程中的不同阶段有着不同的反应速率和微观变化。金属Ce的蒸汽氧化过程随时间可以分为3个不同的氧化阶段,具体3个阶段的反应过程推断如下。

φ5 mm×2 mm金属Ce样片,300 ℃,常压,50%H2O-50%Ar,流速100 mL/min
Stage Ⅰ:抛物线阶段,由水分子在氧化层的扩散决定氧化反应速率。随着密实氧化膜增厚,氧化粒子到达氧化物-金属Ce界面的时间变长,即反应速率随时间呈抛物线关系。
Stage Ⅱ:线性反应动力学阶段,氧化层厚度增加并不影响金属Ce的氧化速率,可能是由于密实氧化膜再结晶或晶粒增长形成多孔氧化层,这种结构不影响水分子的迁移扩散。
过渡阶段:如图2所示,在Stage Ⅱ和Stage Ⅲ之间存在过渡区域,这一阶段由于氧化层厚度持续增加使得表面应力增加,导致氧化膜破裂、脱落。
Stage Ⅲ:金属Ce与气体界面控制线性反应阶段。这个阶段是由于氧化层破裂和脱落导致新的金属Ce暴露。此阶段的氧化速率大于Stage Ⅱ氧化速率,小于Stage Ⅰ零时刻氧化速率,一方面是由于破裂和脱落暴露的金属Ce量较少的原因,另一方面,是金属Ce表面残留着一层没有脱落的氧化物保护层所致。
2.2 反应速率随不同蒸汽浓度的变化趋势
比较了30%蒸汽与50%蒸汽浓度下金属的高温蒸汽氧化过程,结果示于图3。由图3发现,50%蒸汽浓度下反应各阶段的速率均要快于30%蒸汽浓度下速率,呈现反应速率与蒸汽浓度的正相关性。这与氧气气氛下氧化过程的趋势接近,氧化物浓度越高,越有利于反应进行,且与金属U在不同蒸汽分压下的反应速率变化规律一致,分压越高反应速率越快[11]。
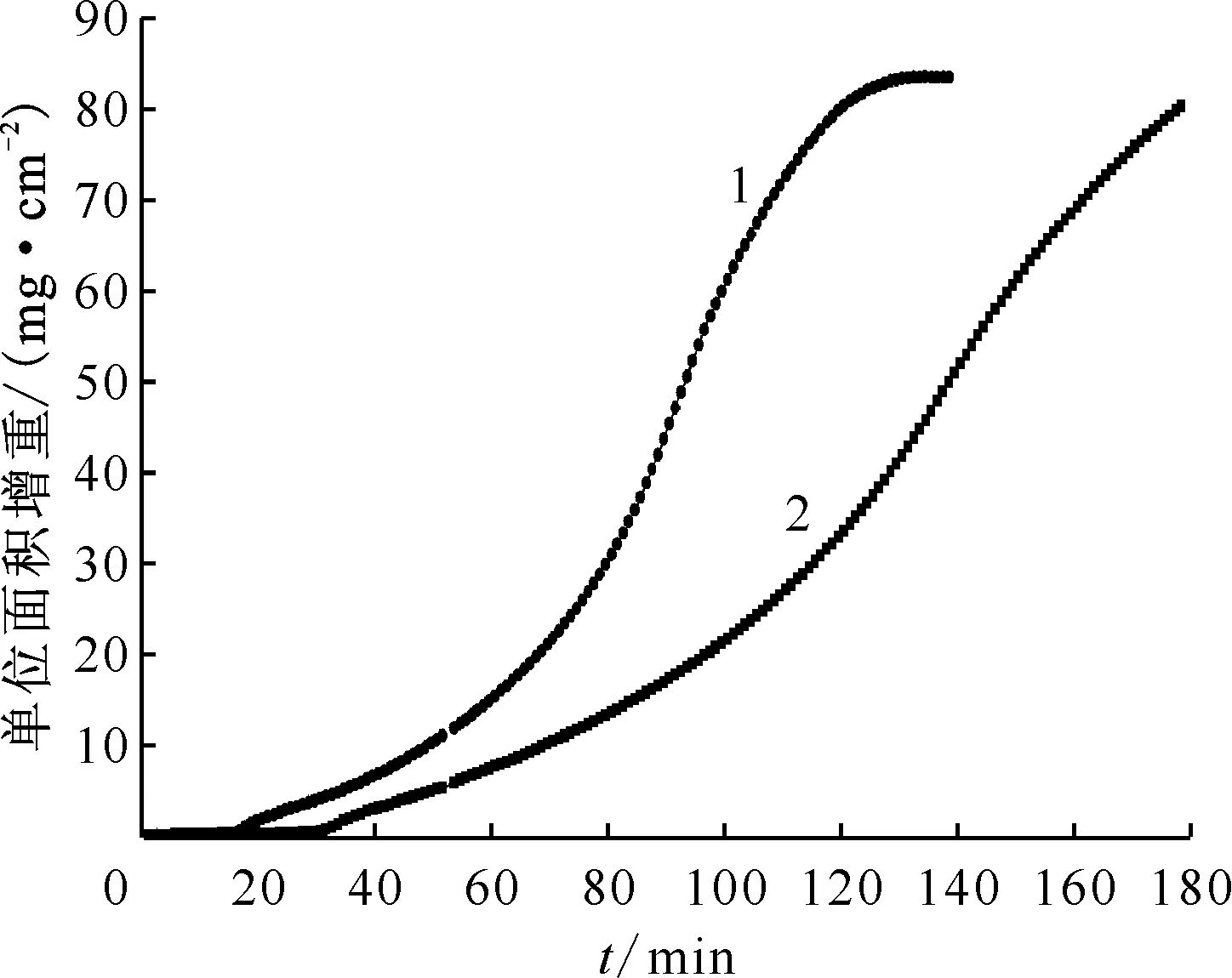
φ5 mm×2 mm金属Ce样片,300 ℃,流速100 mL/min
2.3 产物分析
金属Ce常见的氧化物包括Ce2O3和CeO2,金属Ce经蒸汽氧化后生成疏松态灰色氧化物粉末(图4),取样采用拉曼光谱对粉末进行分析,结果示于图5。由图5看出,在462 cm-1处发现CeO2的F2g特征振动峰[12],表明金属Ce经蒸汽氧化后最终产物以CeO2为主。

图4 金属Ce蒸汽氧化后的产物

图5 Ce蒸汽氧化粉末的Raman谱图
金属Ce在蒸汽氧化过程中,通过对尾气中氢含量的监测,发现在氧化反应过程中持续产生氢气,氢气含量与反应速率有相关性,待反应结束后,未再监测到氢气。
2.4 反应机理探讨
关于金属Ce与水的氧化反应机理尚在探索之中,一般认为Ce在水蒸气中的氧化反应机理类似于Ce在纯氧或干燥空气中的氧化反应机理,从氧化过程速率的变化、氧化产物成分以及监测到氢气等现象可以推断以下反应机理。
首先发生吸附过程,水分子在清洁的Ce表面发生物理和化学吸附。由于化学吸附作用,水分子解离断开其中一个OH键,留下的OH有极强的化学吸附作用,并与金属Ce反应生成氧化物,而H与表面OH的结合较弱,H重新组合成H2分子并且逸出到气相。这个反应阶段一直持续到整个表面形成一个氧化物层。随着氧化过程的进行,氧化膜层加厚,由于金属体相和氧化产物之间密度的不同,表面应力积累到一定程度使氧化膜层破裂从而露出新鲜的Ce表面,水分子和新鲜Ce表面反应加快产生更多的氧化物而又导致氧化膜层破裂,这样一个动态平衡使得在稳定的反应条件下反应后期会出现稳定的反应动力学现象。
3 结 论
开展了金属Ce在蒸汽下的氧化反应研究,获得了在蒸汽及氩气的混合气体下300 ℃的反应动力学曲线,结果表明,金属Ce的高温蒸汽氧化反应过程呈现明显的阶段性,根据反应速率的差异大体可分为三个阶段,其反应的产物主要包括CeO2和氢气。初步探讨了金属Ce在高温蒸汽环境中的反应机理,认为在水蒸气氧化过程发生了水分子的吸附解离,且存在氧化物膜增厚剥落的过程。
