金属Ce氢化-氮化反应动力学
2020-10-28王长水胡小飞孟照凯
王长水,张 凯,宋 鹏,胡小飞,何 辉,陈 辉,孟照凯
中国原子能科学研究院 放射化学研究所,北京 102413
铈(Ce)是元素周期表的第58号元素,也是第一个具有f电子的元素,因其独特的电子结构而表现出许多特殊的性质,如反铁磁性、超导性和单质的 Kondo效应等[1-4]。Ce及其化合物广泛应用于催化、冶金、医药和纺织等领域[5-8]。金属Ce化学性质活泼,极易与 O、N、S和H 等元素形成化合物,Ce的氢化和氮化特性是其实际应用中备受关注的问题之一[9-10]。
金属Ce与核工程金属材料具有相似的价电子结构,它们的物理化学性质极为相似,如低熔点、多种同素异形体共存等,同时具有相似的相变体积变化率、表面氧化过程、氧化层结构和氢化行为等。因此,Ce被认为是一种较为理想的核工程金属模拟材料[11-13]。核燃料中金属的回收与纯化具有重要的战略意义。与传统的湿法回收相比,气-固相反应体系不会产生大量的放射性废水,具有更好的应用前景。在此过程中,通常会根据回收路线的需求,将金属与不同气氛反应得到氧化物、氟化物、氢化物和氮化物等[14],其中,氢化和氮化反应是两个重要的气-固反应过程,金属材料及其合金性能的理论模拟和实验的系统研究均十分困难。为减少研究工作的危险性及降低研究成本, 发展模拟材料显得尤其重要。金属Ce的氢化-氮化反应动力学研究可以为金属材料的相关研究提供有益参考。
本工作拟从金属Ce出发,研究Ce氢化-氮化反应的动力学特性,揭示反应温度、反应初始压力和金属Ce片厚度对反应速率的影响规律,并利用X射线衍射(XRD)和扫描电镜(SEM)对氮化产物进行定性研究。
1 实验部分
1.1 材料与仪器
金属Ce锭,纯度99%,上海阿拉丁生化科技股份有限公司;氢气、氮气,纯度≥99.999%,山东白燕化工有限公司;SK-GO8123K管式气氛炉,天津中环;VD85气体压力计,德国THYRCONT公司;GC-2010 plus气相色谱分析仪,日本岛津;D8 Advance X射线衍射仪(XRD),德国Bruker公司;Sirion 200型扫描电子显微镜(SEM)和能量色散X射线光谱仪(EDS),美国FEI公司。
1.2 金属Ce的氢化反应
利用电火花线切割将金属Ce锭切成一定厚度的金属片。去除Ce片表面氧化层直至显银白色,准确称量后放入预加热到设定温度的管式气氛炉中。持续抽真空10 min后,向气氛炉中充入H2至预定压力,利用压力计实时记录反应体系压力的变化,并直至反应压力不再变化,则表明金属Ce完全氢化生成氢化铈。本工作中反应温度为20~200 ℃,反应初始压力为20~100 kPa,金属Ce片厚度为1、3、9 mm。
1.3 氢化铈的氮化反应
在金属Ce完全氢化后,开启真空泵,抽走未反应的H2,并以10 ℃/min的速率升至预定温度。通入N2至设定压力,记录反应体系的压力变化。同时,在固定反应时间点采集反应体系中的混合气体,利用气相色谱分析气体组成。当气体压力不再变化时,视为反应结束。在Ar吹扫下冷却至室温,将所得产物浸于石蜡油中保存。分别考察不同反应温度和反应初始压力对反应速率的影响。
1.4 材料表征
使用XRD分析材料的物相结构,衍射靶为Cu,管电压为 40 kV,管电流为40 mA,扫描范围为10°~80°,扫描速率为5°/min。采用SEM观察材料的微观形貌,同时,利用EDS分析材料的元素组成和分布。
1.5 动力学模拟
金属Ce的氢化反应是一个典型的相界面反应过程[15-16],如图1所示,反应首先在某一点开始,然后以该点为中心往周围扩散,产物氢化铈呈蓬松的多孔结构,其存在有利于H2的吸附解离。本工作采用相界面反应模型对氢化-氮化反应动力学进行模拟,具体公式如下[15]:

图1 相界面反应模型示意图
1-(1-α)1/3=kt
其中:α为反应进度,α=某时间已消耗的H2量/H2的总消耗量;k为反应速率常数;t为反应时间。
2 结果与讨论
2.1 氢化反应
2.1.1氢化反应过程 图2为初始反应温度(θ0)20 ℃、H2初始压力为100 kPa的条件下氢化反应过程体系压力(p)变化及金属Ce形貌变化图。如图2所示,金属Ce的氢化过程可分为4个阶段:诱导阶段、成核阶段、快速反应和减速终止。在诱导阶段,H2分子在金属Ce表面的吸附解离较慢,H2压力基本恒定。在成核阶段中,H2压力发生了缓慢的下降,同时从图2可以看出,在该条件下金属Ce表面具有明显的成核生长现象,银白色的Ce片上有黑色的氢化腐蚀点出现;随时间增长,氢化点逐渐生长,并且黑色点状逐渐增大至样品全黑。经历成核之后,H2压力大幅下降,反应速率大幅提高。这是由于经过诱导成核过程后形成的氢化铈有利于H2的活化,同时Ce片被撑开并发生粉化,从而大大提高了加氢的速率。最后,H2压力保持不变,证明反应已经完成。

θ0=20 ℃,p0(H2)=100 kPa
2.1.2初始反应温度对氢化反应的影响 图3为H2初始压力(p0(H2))100 kPa下不同初始反应温度(20~200 ℃)下的氢化动力学曲线。图3(a)显示不同初始反应温度下的氢化反应均存在诱导期,但诱导时间随初始反应温度升高逐渐缩短(图3(b))。当初始反应温度高于140 ℃时,诱导过程基本消失。从图3(a)还可以看出,当反应进入快速反应阶段后,不同初始反应温度下的压力变化曲线几乎是平行的,这说明初始反应温度可能对反应速率影响不大。如图3(c)所示,当初始反应温度从20 ℃升高到100 ℃时,反应速率变化不大。金属Ce氢化反应过程剧烈放热,因此金属Ce氢化的实际反应温度远高于初始反应温度,从而导致不同初始反应温度下的氢化反应速率非常接近。通过计算氢化反应的速率常数对反应动力学进行进一步研究,结果示于图4。如图4所示,随初始反应温度升高,反应速率常数基本不变,约为8.5×10-4s-1,说明初始反应温度对氢化反应动力学影响不大,主要影响氢化反应诱导期。这可能与氢化反应本身剧烈放热的特性有关。

p0(H2)=100 kPa

p0(H2)=100 kPa
2.1.3H2初始压力对氢化反应的影响 图5为初始反应温度为100 ℃及不同H2初始压力下(20、40、60、80、100 kPa)的氢化动力学曲线。图5(a,b)显示诱导期随H2初始压力增大而逐渐缩短,说明提高H2初始压力有助于H2分子突破表面层,进而缩短反应诱导期。如图5(c,d)所示,随H2初始压力增加,氢化反应速率及反应速率常数逐渐增加,增加H2初始压力有利于提高反应速率,说明氢气的扩散是速控步骤。图6为初始反应温度为200 ℃、不同H2初始压力下的氢化过程曲线,随H2初始压力增加,反应速率常数与H2初始压力呈良好的线性关系(k=0.071p0(H2)+0.328,r2=0.996),说明速率方程表达式中,氢气浓度相的指数为1。综合图5和图6实验结果,证明H2初始压力对氢化动力学有较大的影响。
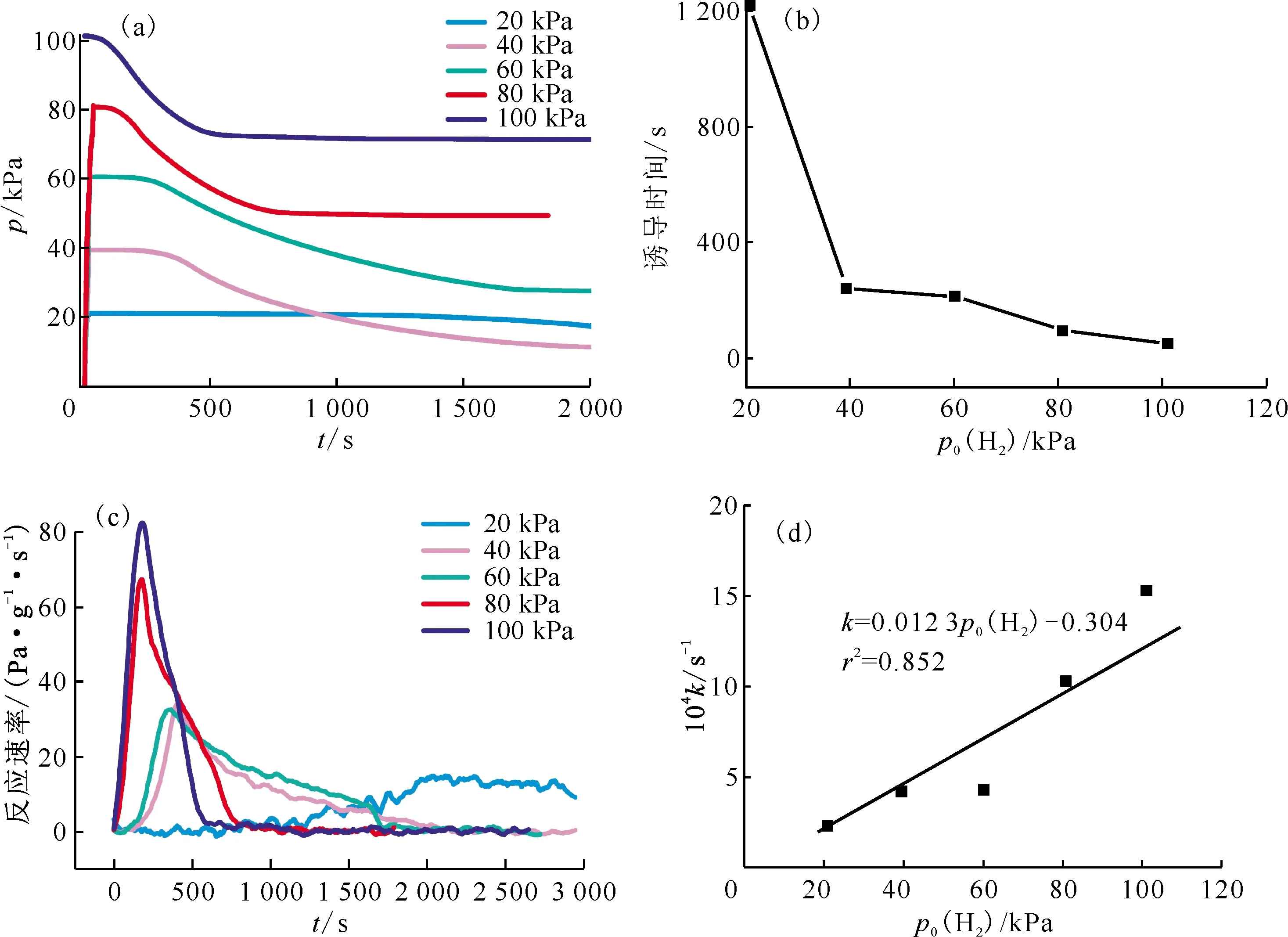
(a)——反应过程体系压力-时间关系,(b)——诱导时间-H2初始压力关系,(c)——反应速率-H2初始压力关系,(d)——反应速率常数-H2初始压力关系

(a)——反应过程体系压力-时间关系,(b)——反应速率常数-H2初始压力关系
2.1.4金属Ce片厚度对氢化反应的影响 在保持Ce片总质量约为12 g、初始反应温度为200 ℃和H2初始压力为100 kPa的条件下,分别考察厚度为1 mm、3 mm和9 mm金属Ce片的氢化反应,结果示于图7。如图7所示,Ce片层厚度对加氢速率有明显的影响,随Ce片层厚度增加,氢化反应速率常数明显降低。这可能是由于随Ce片厚度增加,H2扩散路程增加,扩散阻力增加,反应速率降低。

mtotal(Ce)≈12 g,θ0=200 ℃,p0(H2)=100 kPa
2.2 氮化反应
2.2.1氮化反应过程 图8为初始反应温度为350 ℃及N2初始压力约为90 kPa条件下的氮化反应过程。通入N2后,反应压力迅速从87.16 kPa升至106.1 kPa(图8(b)),说明氢化铈与N2发生了反应2CeHx+N2→2CeN+xH2,导致反应体系压力增加。随反应进行,压力增加的趋势逐渐变缓,最后压力基本保持不变。在反应压力变缓后对反应体系进行采样分析。通过气相色谱分析发现反应体系中只有N2和H2存在,并且N2体积分数为69.4%,H2体积分数为30.6%。据此计算,参加反应的N2/H2摩尔比约为1/3,说明氢化铈与N2反应生成了CeN和H2。通过对比样品照片可以发现,在通入N2后,黑色的氢化铈固体逐渐变为古铜色固体。反应结束后,所得固体内部几乎全部为古铜色,进一步说明生成了CeN。
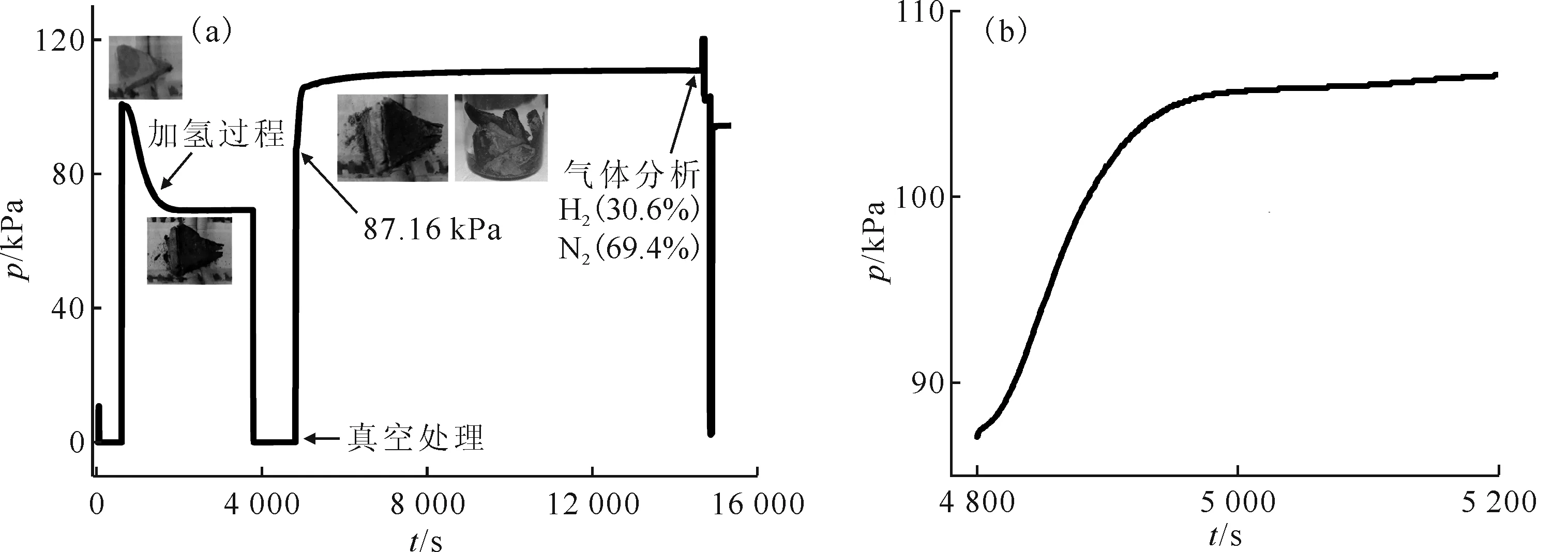
θ0=350 ℃,p0(N2)≈90 kPa
2.2.2氮化产物表征 图9是氮化反应产物的XRD谱图。如图9所示,反应产物在2θ= 31.0°、35.8°、51.6°、61.6°、64.4°、84.1°和97.5°等处均出现了明显的衍射峰,并且与CeN的标准谱图(JCPDF No.15-0882)中的(111)、(200)、(220)、(311)、(222)、(331)和(442)等晶面完全对应,充分证明所得古铜色产物为CeN。同时,在28.6°、33.0°和47.6°处的弱衍射峰表明样品中含有少量的CeO2(JCPDF No.43-1002),这可能是因为在样品转移过程中部分CeN被氧化为CeO2。同时,SEM和EDS测试结果表明(图10),古铜色产物为表面致密结构,并且材料中存在Ce和N元素,进一步证明氢化铈氮化产物为CeN。
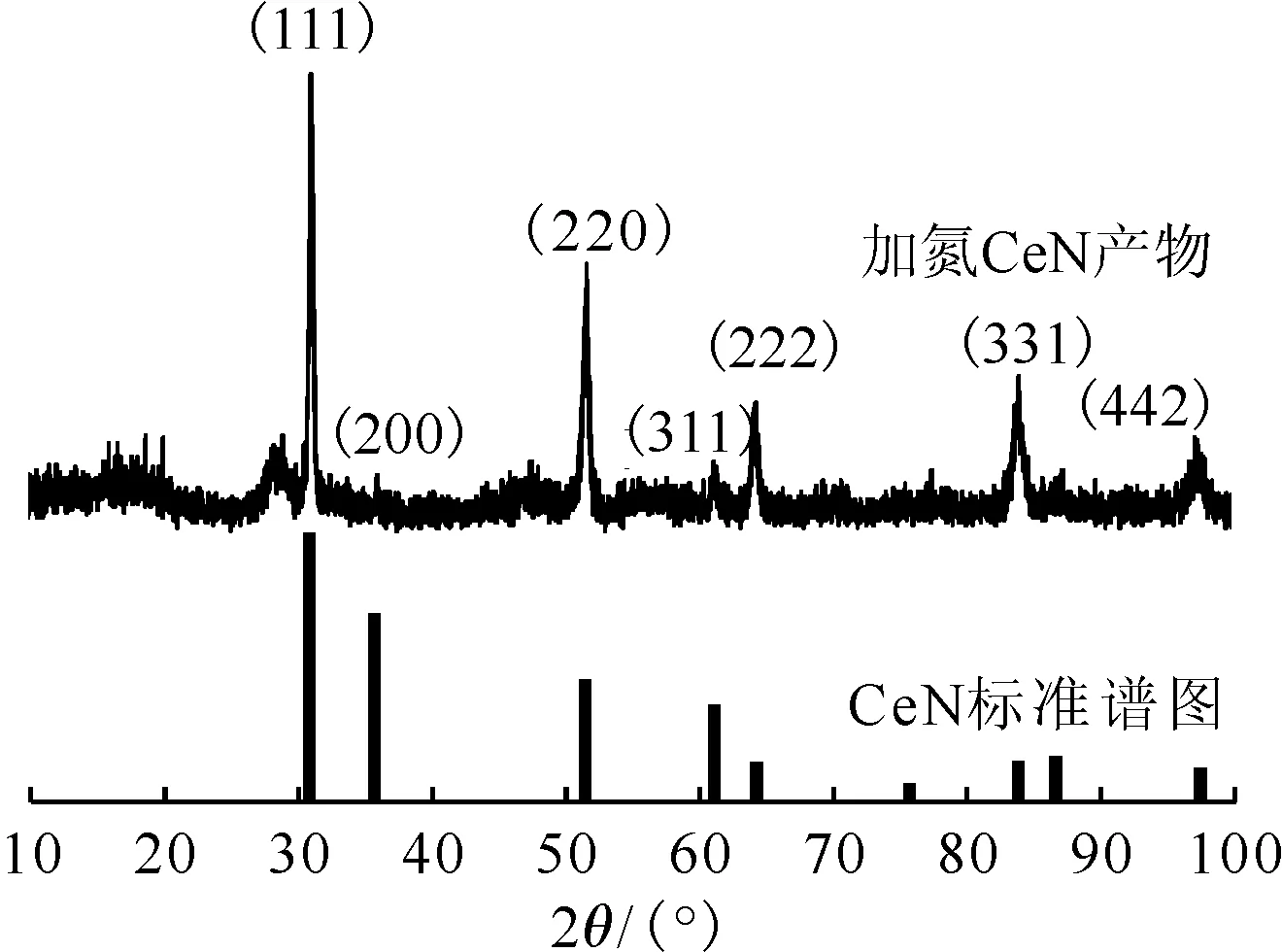
图9 氮化反应后样品XRD谱图

图10 氮化反应后样品SEM(a)和EDS(b)表征
2.2.3初始反应温度对氮化反应的影响 图11是不同初始反应温度(250、350、450、550 ℃)下的氮化反应。如图11(a)所示,初始反应温度为250 ℃时,通入氮气后反应体系的压力增加非常缓慢,说明该初始反应温度下氮化反应进行得比较缓慢,这可能是由于该反应的脱氢过程需要较高的活化能[17]所致。在350、450、550 ℃条件下,反应体系压力快速增大,说明升高初始反应温度有利于氮化反应进行。图11(b)给出了反应速率常数与初始反应温度的关系,可见随初始反应温度的升高,反应速率常数增大,当初始反应温度高于350 ℃时,反应速率常数变化不明显,计算得到反应的活化能为157 kJ。在实际工艺中,350 ℃可作为适宜的初始反应温度。

p0(N2)≈90 kPa
2.2.4N2初始压力对氮化反应的影响 在初始反应温度为350 ℃下,分别考察N2初始压力约为30、60、90 kPa下的氮化反应,结果示于图12。如图12所示,通入不同初始压力的N2后,反应体系的压力均明显升高,说明在不同初始压力下N2与氢化铈均可发生反应。通过对比反应速率常数与N2初始压力的关系,发现N2初始压力约为30 kPa时,反应缓慢;增加N2初始压力至约60 kPa,反应速率常数明显增加,继续增加到约90 kPa,反应速率常数变化不大。
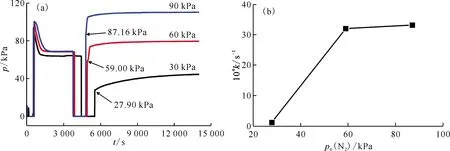
(a)——反应过程体系压力-时间关系,(b)——反应速率常数-N2初始压力关系
3 结 论
以金属Ce为起始原料,对Ce氢化-氮化动力学参数进行了研究,分别考察了初始反应温度、反应初始压力和Ce片厚度等对金属氢化-氮化反应的影响规律。研究结果表明:
(1)Ce氢化反应可划分为诱导、成核、快速反应和减速终止等4个阶段,升高初始反应温度能缩短诱导时间,但对反应速率无明显影响;提高H2初始压力和降低片层厚度有利于加快反应速率;
(2)氢化铈可以与N2反应产生CeN和H2,提高初始反应温度和N2初始压力对于提高反应速率非常有利;初始反应温度为350 ℃、N2初始压力约为60 kPa是氢化铈氮化的较优条件。
