人参皂苷Rh2通过OPG/RANKL信号通路介导对老年大鼠骨量流失的保护作用
2020-10-28朱恒杰陈扬平姚江凌
朱恒杰 陈扬平 姚江凌
海南医学院第一附属医院急诊创伤科,海南 海口 570103
骨质疏松症已经成为一个严重的医学问题,它是一种以骨组织微结构退行性改变和骨量减少为特征的疾病,可导致骨质脆性增加,骨折发生率增加[1]。根据病因可分为原发性骨质疏松症和继发性骨质疏松症,原发性骨质疏松症包括老年性和绝经后骨质疏松症,继发性骨质疏松症所占比例很小。去卵巢大鼠模型是目前最常用的绝经后骨质疏松动物模型。在年轻和老年大鼠与人类中,同样的机制调控着骨量的增加和丢失[2]。骨质疏松症最危险的结果是骨折,即使是轻微的创伤或日常活动也可能导致骨折,无论是在脊柱、髋部和前臂远端这样的常见部位也是如此[3-4]。目前,治疗骨质疏松症最常用的药物如双膦酸盐、甲状旁腺素片段、RANK配体抑制剂等。然而,这些药物耐受性较差和长期不良反应的限制[5-6]。因此急需新的药物来改善这类情况。人参具有多种潜在作用,包括免疫作用、抗癌作用、性功能增强作用等。但是,很少有研究评估其抗骨质疏松作用[7]。本研究观察人参提取物人参皂苷Rh2对老年大鼠骨量流失的影响并探索可能的机制。
1 材料和方法
1.1 实验分组和治疗
在本实验中使用雌性SD大鼠(其中10只为3月龄大鼠记为(Con组),10只为24个月龄老年大鼠使用生理盐水治疗记为(Mod组),10只为24个月龄大鼠每天接受人参皂苷Rh2(购于浙江亚克药业有限公司,每100 g粉末中含有16.2 g人参皂苷Rh2)给药300 mg/(kg.d),持续治疗12周记为(Rszg组)。大鼠可以自由摄取实验室提供标准的颗粒饮食和水。将实验动物饲养在温度23±2℃,恒定湿度(45%~50%), 12 h/12 h暗光照循环的空调房间中。通过每周称重大鼠并调整人参皂甙Rh2的剂量。治疗12周后取出双侧股骨,用10%中性缓冲福尔马林固定24 h,进行微型计算机断层扫描检查(Micro-CT)和生物力学检测。将右股骨切片并在液氮中冷冻以用于Western印迹(WB)分析。
1.2 Micro-CT成像与组织形态学分析
左侧股骨通过Micro-CT测量(μCT80,Sanco Medical,Brüttisellen,Switzerland),并通过相关分析软件(μCT80 Evaluation Program v6.51,Sanco Medical,Switzerland)进行评估。扫描后,选择股骨远端高于生长板2 mm的松质骨作为VOI,该VOI仅限于股骨内部区域,其中通过使用CT分析器软件绘制自由形式等高线来提取小梁和皮质骨。使用标准化技术勾勒松质骨的微观结构,通过多平面重组获得三维(3D)图像;以确定骨体积分数(BV/TV,%)、骨小梁厚度(Tb.Th,μm),骨小梁数目(Tb.N,mm-1)、骨小梁间隙(Tb.Sp,μm) 和骨密度(BMD,mg/cm3)。
1.3 HE染色组织切片检测
将每个标本纵向切成5 μm厚的切片,并选择中心部分进行每个标本组织的分析。选择股骨组织切片,并用苏木精和曙红(HE) (上海新宇生物技术有限公司)染色进行常规形态学分析。
1.4 生物力学评估
右侧股骨(每组n=5)使用Instron 4302系统进行三点弯曲实验评估。将股骨放在材料检测机支架上,测试区域定义为股骨的最中央部分。以2 mm/min的速度施压载荷直至骨折。通过连接的计算机监控骨折时的最大载荷(N)和弹性模量(mm2)的数据。
1.5 WB检测
左侧股骨在液氮中粉碎后,用IP裂解缓冲液从骨组织中提取总蛋白。用BCA蛋白试剂盒定量测定蛋白浓度。将蛋白与加载缓冲液混合,在100 ℃煮沸5 min,使其变性。用15 %SDS-PAGE分离50μg总蛋白,转移到聚偏氟乙烯(PVDF)膜上。用5%的脱脂奶粉在室温下封闭1 h后,将膜分别与OPG、Runx2 和RANKL一抗在4 ℃孵育过夜,然后与辣根过氧化物偶联的二抗在室温下孵育1 h。用ECL试剂(美国Thermo Scientific)显影印迹。使用GAPDH进行归一化。用Image J软件测量各蛋白条带的总和密度。
1.6 统计学处理
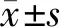
2 结果
2.1 Micro-CT结果分析
股骨干骺端骨小梁三维重建图像如图1 A所示。股骨干骺端的微观参数如图1B~F所示。Mod组左侧股骨BMD、BV/TV、Tb.N和Tb.Th较Con组明显降低,而Tb.Sp则明显升高(P<0.05)。Rszg组左侧股骨BMD、BV/TV、Tb.N和Tb.Th均明显高于Mod组(P<0.05),而Tb.Sp则明显低于Mod组(P<0.05)。

图1 三组大鼠股骨干骺端Micro-CT检测结果注: a Con, b Mod, c Rszg;与Con组相比,*P<0.05;与Mod组相比,#P<0.05。Fig.1 Results of Micro-CT in the femoral metaphysis of three groups of rats
2.2 股骨组织病理学
股骨干骺端骨小梁HE染色如图2所示,Con组织显示股骨干骺端骨小梁致密,骨小梁网状结构正常。Mod组组织表现为疏松均匀的骨小梁变薄,导致骨小梁间隙变宽。Rszg组骨小梁数量和连接增加明显,表现出明显的结构恢复。

图2 三组股骨的组织病理学注:A Con, B Mod,C Rszg;苏木精-伊红染色(10×)。Fig.2 Histopathology of femurs in the three groups
2.3 股骨的生物力学变化
股骨三点弯曲试验表明,Con组的最大载荷和弹性模量均高于Mod组,两组间差异有统计学意义(P<0.05),Rszg组的最大载荷和弹性模量均高于Mod组(P<0.05)。见图3。
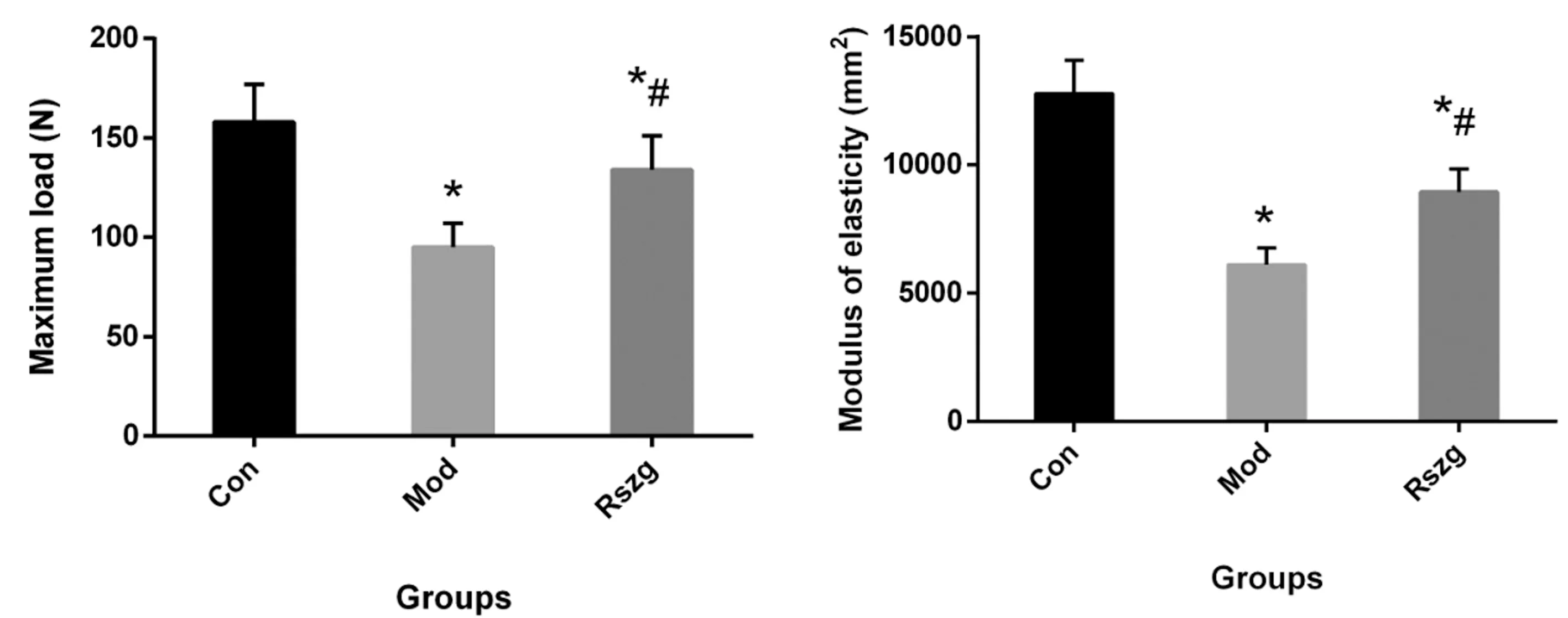
图3 右股骨的三点弯曲试验结果注:与Con组相比,*P<0.05;与Mod组相比,# P<0.05。Fig.3 Three-point bending test results of the right femur of rats
2.4 WB分析
和Con组比较,Mod组OPG和Runx2表达水平明显下调,而RANKL表达水平明显上调,差异有统计学意义(P<0.05)。和Mod组比较,Rszg组OPG和Runx2表达水平明显上调,而RANKL表达水平显著下调,差异有统计学意义(P<0.05)。见图4。
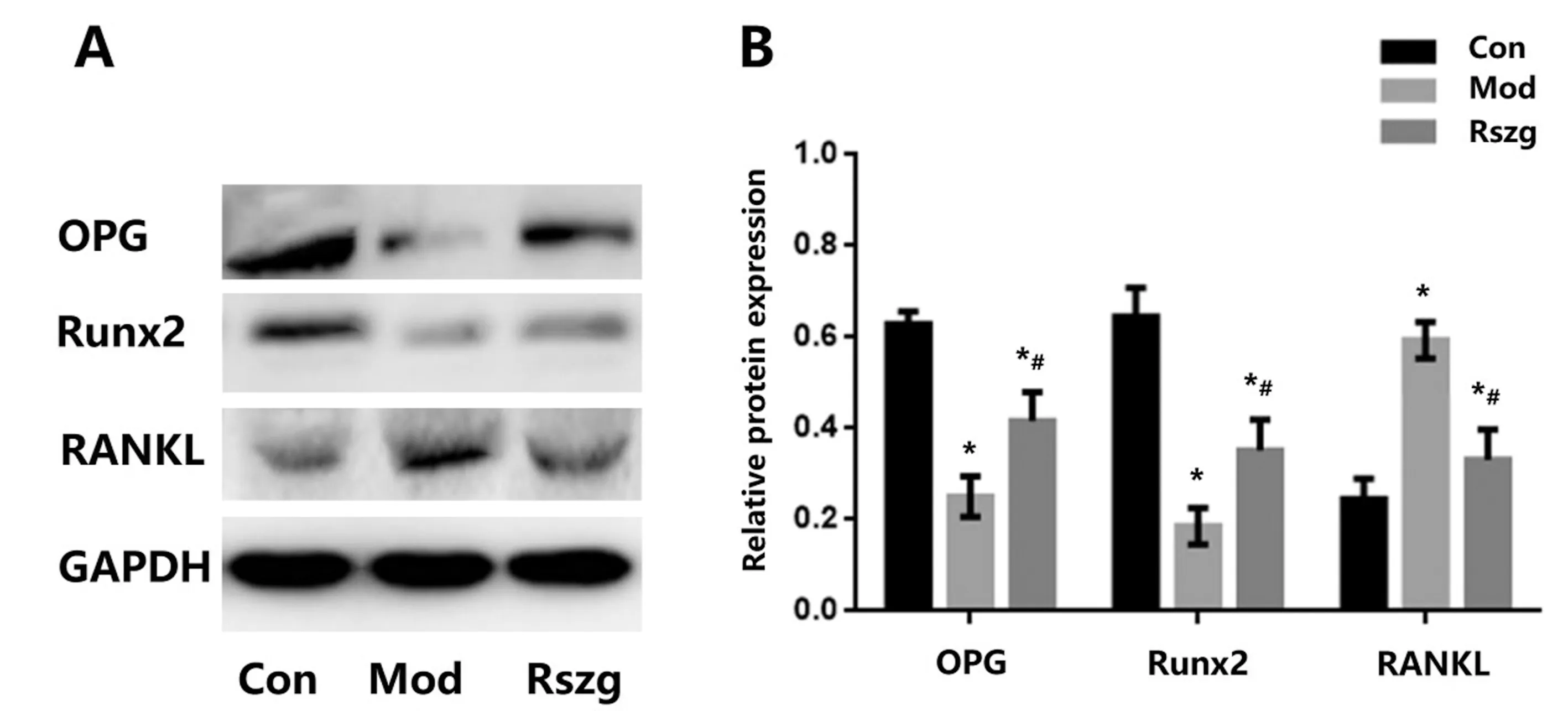
图4 使用WB检测OPG、Runx2、RANKL和GAPDH的相对表达注:与Con组相比,*P<0.05;与Mod组相比,#P<0.05。Fig.4 Relative expression of OPG、Runx2、RANKL to GAPDH using Western blotting
3 讨论
人参是世界上最受欢迎的草药之一,人参皂甙Rh2是其主要成分之一。 据报道,在实验模型中,人参皂甙Rh2具有多种生物活性,包括抗发炎、抗肿瘤和抗糖尿病[8]。 此外,人参皂甙Rh2抑制了骨碎屑的形成而没有任何细胞毒性[9]。因此,人参皂苷Rh2生物活性物质可能对预防老年骨量流失有用。然而,人参皂苷Rh2对老年骨量流失作用和机制仍是未知的。基于上述数据,本研究的目的是评估人参皂甙Rh2对老年雌性SD大鼠骨骼的影响。
在本研究中,从实验开始到治疗第12周,老年大鼠股骨干骺端骨小梁微观结构和骨密度发生显著改变。人参皂甙Rh2的使用显著增加了老年大鼠骨量和骨密度,股骨干骺端Micro-CT和HE切片观察的结果已经清晰表明。在这项研究观察到的人参皂甙Rh2的有益作用可能不仅是由于其促进成骨的效果,而且还因为其对骨吸收的抑制作用。此外,在2018年一项研究[10]中,有学者已经指出人参可以下调实验动物模型中NF-κB刺激的炎症反应,并通过抑制NF-κB介导的炎症基因表达来抑制炎症。破骨细胞的形成需要核因子κB(NF-κB)信号传导。因此,抑制该信号分子可能会降低破骨细胞的增殖、分化和活性,并减慢骨吸收,这很好解释了本研究中人参皂苷Rh2的骨保护作用的影像学和组织学切片观察的结果。
由于骨强度直接影响到骨骼抗骨折能力,是骨密度和骨微观结构外反映治疗效果最直接指标[11]。本研究观察人参皂苷Rh2对大鼠股骨骨强度的影响,发现老年大鼠的最大载荷和弹性模量较年轻大鼠显著降低,而经过人参皂苷Rh2治疗12周,最大载荷和弹性模量较Mod组显著升高,这表明人参皂苷Rh2能改善老年大鼠股骨骨强度。骨骼稳态主要通过成骨细胞和破骨细胞的合作来维持[12]。骨保护素(OPG)是一种具有破骨细胞潜在抑制活性的蛋白,在成骨细胞/基质细胞中自然表达[13]。由成骨细胞/基质细胞产生的RANKL是可与RANK结合的跨膜配体。RANK和RANKL相互作用可以启动基因表达和信号传导级联,从而导致破骨细胞前体细胞分化为成熟的破骨细胞。Runx2对于成骨细胞的发育和骨形成至关重要。作为转录因子Runt域家族的成员,Runx2结合特定的DNA序列来调节众多基因的转录,从而控制成骨细胞从间充质干细胞向成骨细胞的发育和成熟[14]。这项研究的结果表明,人参皂甙Rh2可以调节OPG/RANKL比率并抑制破骨细胞的发生,同时促进Runx2表达。这些结果支持人参皂苷Rh2可以通过刺激OPG和Runx2表达和抑制RANKL表达来调节破骨细胞的分化和功能,这表明人参皂苷Rh2具有可以预防绝经后骨质疏松症的可能机制。
本研究有其不足之处,首先研究模型限制了研究结果进一步推广;其次剂量选取的原因只能证实本研究选取的剂量对老年骨骼流失保护作用,是否适合其他类型的骨质疏松症就不得而知了;由于没有进一步研究该药物对细胞的影响,因此需要进一步进行体外研究验证其对成骨细胞和破骨细胞的影响。
总之,人参皂苷Rh2治疗对老年大鼠骨量流失起到保护作用,而这种效果可能通过介导OPG/RANKL信号通路和促进Runx2表达来实现的。
