小檗碱可以通过改善氧化应激和成骨活性减少2型糖尿病大鼠骨量的流失
2020-10-28郑晓明王康振郑炜宏杨健松万明梁华辉
郑晓明 王康振 郑炜宏 杨健松 万明 梁华辉
中山市中医院,广东 中山 528400
随着人口老龄化和人类饮食的变化,近年来糖尿病的发病率一直在增加。这种疾病已逐渐成为全球重要的公共卫生危害。糖尿病是一种慢性疾病,并与其他慢性全身性疾病相关。糖尿病的系统性并发症包括:视网膜病变、肾病和神经病变以及其他血管并发症;糖尿病性骨质疏松症也是糖尿病常见的慢性并发症之一。由于胰岛素的绝对或相对缺乏、激素失衡或内分泌功能障碍引起的,导致钙、磷代谢紊乱,出现骨密度下降和骨微观结构的改变。近年来的研究表明,氧化应激是糖尿病诱发的骨质疏松症的重要机制之一。研究已经表明活性氧(ROS)可以抑制成骨细胞分化,诱导成骨细胞损伤和凋亡[1-2]。小檗碱(BBR)是从黄连、水仙等草本植物中提纯的一种异喹啉生物碱,具有抗菌、抗肿瘤、抗炎等作用[3]。近期的研究表明小檗碱可以通过抑制骨髓间充质干细胞(BMSCs)中NF-κB和Akt途径来抑制RANKL诱导的破骨细胞生成[4]。在成骨细胞体外实验中发现小檗碱可以通过促进p38丝裂原活化蛋白激酶(MAPK)激活Runx2来增加成骨细胞的分化[5]。鉴于小檗碱的抗氧化作用,因此,本研究的目的探索小檗碱对糖尿病大鼠BMD和微观结构影响和可能机制。
1 材料和方法
1.1 研究方案
60只雌性SD大鼠,约200~230 g;10周龄,由杭州动物实验中心(中国浙江杭州)提供。在动物护理设施中,我们看到所有的老鼠都单独关在笼子里,所有的老鼠饲养在22 ℃的空调房间里,湿度适中,12 h∶12 h的光∶暗循环,并在研究进行之前食用标准的大鼠饲料和水。适应性饲养1周后,将大鼠随机分为4组:对照组(CG)(n=15),糖尿病组(DG)(n=15),糖尿病+50 mg/(kg·d)小檗碱治疗组 (BRB-50)(n=15);和糖尿病+100 mg/(kg·d)小檗碱治疗组(BRB-100)(n=15)。本研究采用多次注射链脲佐菌素的方法建立2型糖尿病大鼠模型[6]。在STZ给药后测定血浆葡萄糖水平(PGLS),非空腹PGLS高于16.7 mmol/L阈值的大鼠表明2型糖尿病模型成功建立,后所有大鼠均给予相对应的药物治疗12周。待研究结束时收集大鼠尿液和血液,随后过量麻醉处死大鼠后收集大鼠双侧股骨,用生理盐水包裹,然后在-20 ℃保存,直至分析。
1.2 检测指标
使用显微计算机断层扫描(μCT)(Micro CTμ100,SCANCO Medical,瑞士)分析左侧股骨的骨小梁结构。分析股骨远端干骺端骨小梁的扫描图像(14.8 μm/切片或1.48 mm),从距生长板50片(740 μm)开始,在感兴趣体积(VOI)内半自动绘制轮廓。在曝光时间为70 kV、200 μA和300 ms时,扫描股骨以获得14.8 μm[7]的图像分辨率。利用重建软件进行图像切片重建,然后分别进行分析。μCT定量参数包括:骨密度(BMD)、骨小梁体积分数(BV/TV)、骨小梁数(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁间距(TB.SP)和结构模型指数(SMI)。
随后对股骨进行组织学检查,对股骨脱钙后进行HE染色。先在4 %的对二甲醛-海德中室温固定2 d,然后在乙二胺四乙酸(EDTA)溶液中脱钙1个月。然后,将右股骨组织标本在一系列分级乙醇溶液中脱水,包埋于甲基丙烯酸甲酯中,然后切成5 μm厚的切片。最后,使用图像分析仪在光学显微镜下用千分尺进行标本的组织形态计量学分析。
将股骨于液氮中冷冻并在RIPA缓冲液裂解,然后等份装载(20 mg蛋白质),使用SDS-PAGE(4%堆积,12%流动凝胶在120 V时90~110 min)分离蛋白质。将蛋白质在100 V下转移至0.2 mm的聚偏二氟乙烯膜(目录号162e0177,Bio-Rad实验室,赫拉克勒斯,加利福尼亚)上60 min。使用了以下一抗: Runx2(1∶2 000,Cell Signalling),b-catenin(1∶750,Santa Cruz BT),Osterix(1∶500,Santa Cruz BT)和PPARγ(1∶500,Santa Cruz BT),然后使用合适二抗处理。化学发光HRP底物检测抗原抗体复合物,并使用LI-COR C-Digit印迹扫描仪进行可视化,并使用相关的Image Studio 5.2软件(LI-COR Biosciences,NE,美国)进行光密度分析。Ponceau S(Biorad)用于控制总蛋白含量,β-actin作内部对照。
在小檗碱治疗12周后,收集每只大鼠24 h的尿液并保存在-20 ℃冰箱中。随后所有大鼠均处死,在乙醚麻醉下经心脏穿刺抽血。在3 000 r/min下离心10 min,从每个样品中提取血清,并在-80 ℃下储存。然后用ELISA(Uscnlife Life Sciences,Inc.)检测尿8-羟基脱氧鸟苷(8-OHdG)的水平。采用Kakkar法检测血清SOD活性[8],血清过氧化氢酶活性采用重铬酸试剂比色法测定。谷胱甘肽过氧化物酶与5,50-二硫双-2-硝基苯甲酸反应后剩余的谷胱甘肽构成一种化合物,其最大吸收波长为412 nm。以二氯-2,4-二硝基苯为底物,用分光度法测定GST。
1.3 统计学处理
所有数据均使用均数±标准差表示,所有分析均使用SPSS 19.0软件进行。组间使用单因素方差分析(ANOVA)进行;P<0.05表明比较差异有统计学意义。
2 结果
2.1 骨小梁形态学观察
所有组的大鼠股骨干骺端进行HE染色,以进一步观察组织学变化,如图1所示。在DG和Brb-50组中,组织学检查显示出大量的骨小梁已经消失和少量不规则排列的骨小梁。而与使用小檗碱处理后的骨小梁相比;骨小梁的数量和之间的连接在一定程度上得到了改善。
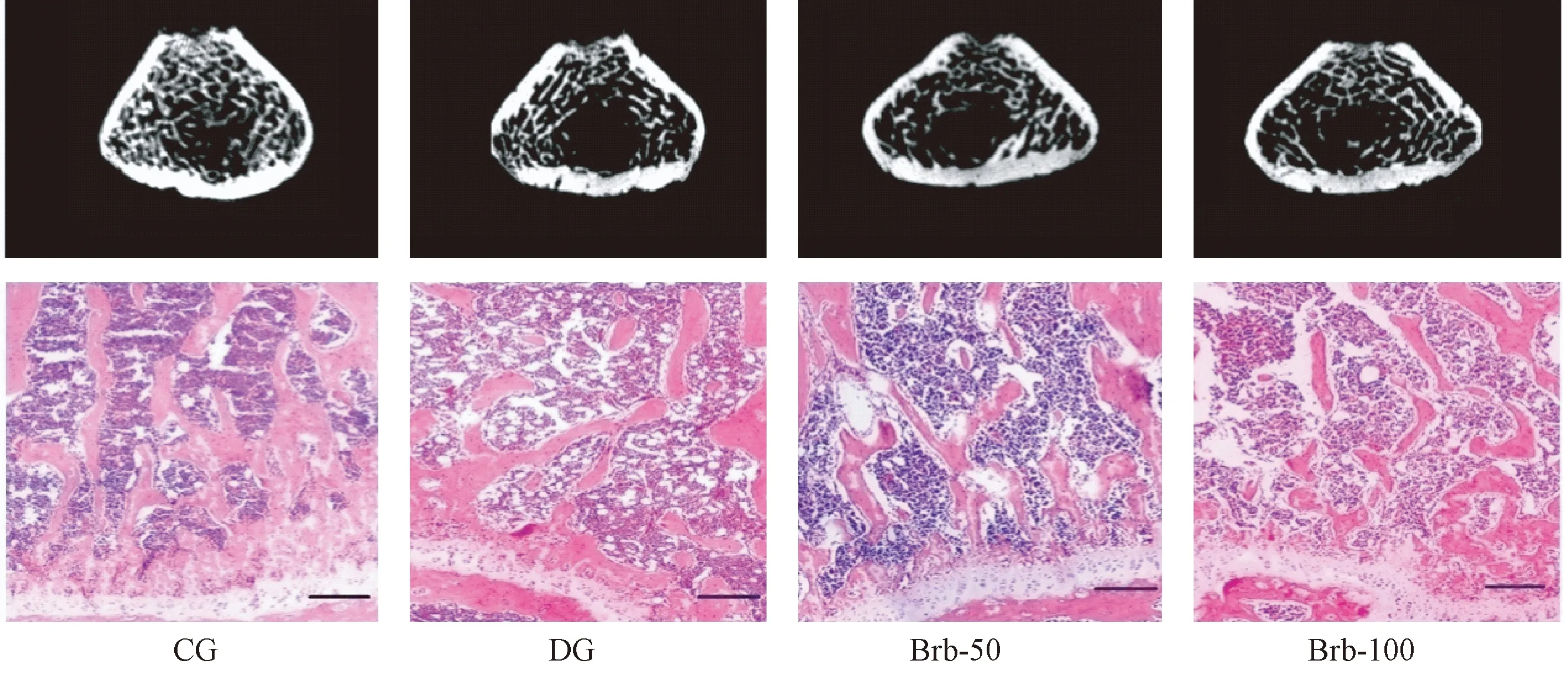
图1 小檗碱治疗12周时各组大鼠股骨干骺端组织学变化(HE染色,10×)和Micro-CT三维重建结果Fig.1 Hematoxylin and eosin staining (magnification 10×) and Micro-CT three-dimensional reconstruction of the femoral metaphysis of rats in each group at 12 weeks of treatment
2.2 股骨干骺端骨小梁微观参数比较
Micro-CT三维重建结果如图1所示;骨小梁定量结果如图2所示;与对照组大鼠相比,糖尿病组大鼠的Tb.Sp和SMI的显著升高,而Tb.Th、Tb.N和BV/TV的水平显著降低(P均<0.05)。在Brb-50组中的发现与糖尿病大鼠相似结果。然而,使用100 mg/(kg.d)小檗碱治疗后的糖尿病大鼠的骨小梁上述指标均表现出显著改善。使用小檗碱100 mg/(kg.d)处理的糖尿病大鼠的BV/TV、Tb.N和Tb.Th显著升高;而Tb.Sp和SMI显著降低。
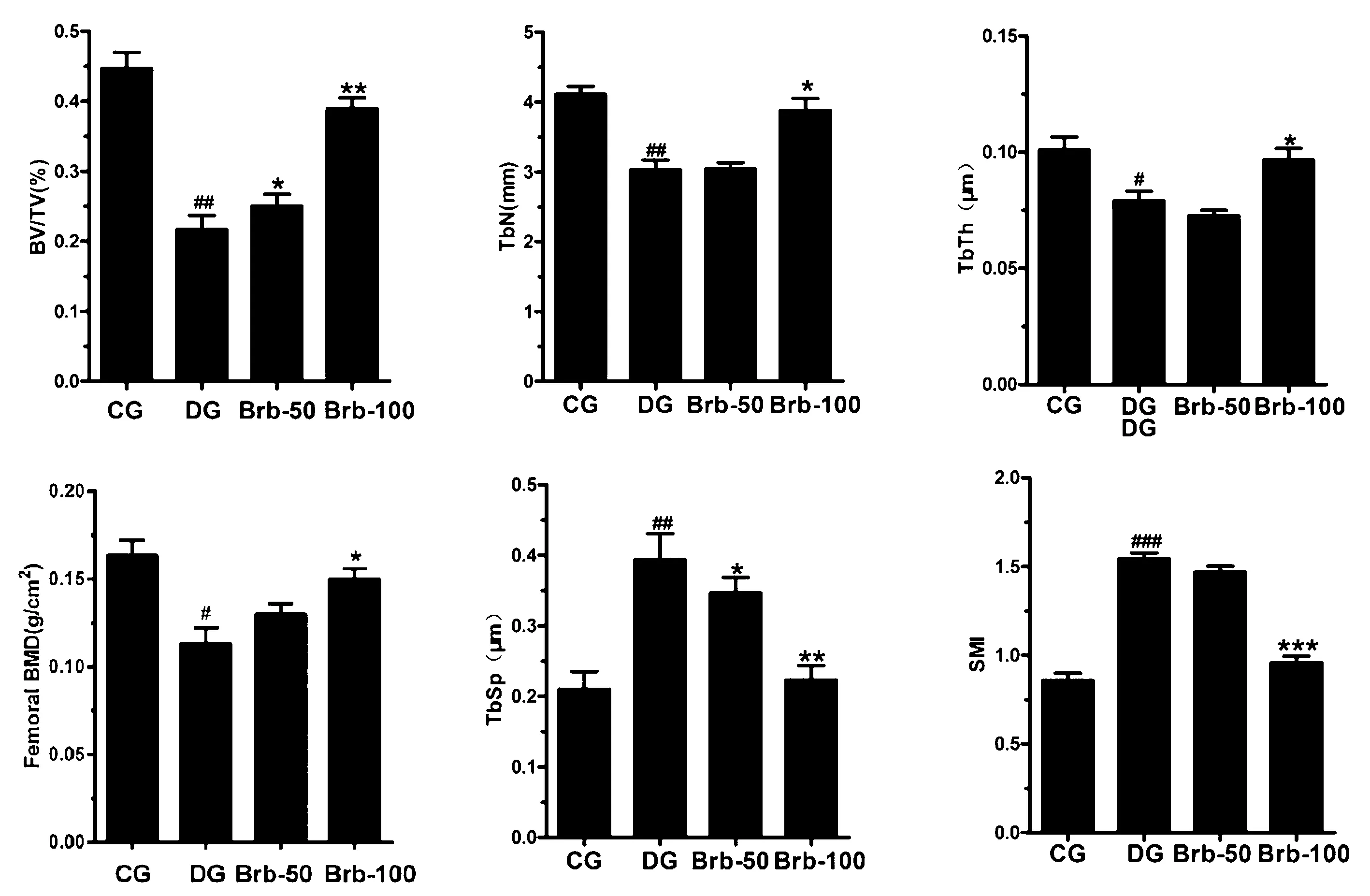
图2 小檗碱对糖尿病大鼠股骨干骺骨微结构和骨密度的影响注:与CG组相比,#P<0.05,##P<0.01,###P<0.001;与DG组相比,*P<0.05,**P<0.01,***P<0.001。Fig.2 The effect of berberine on the femoral metaphysis metatarsal bone microstructure and bone mineral density in diabetic rats
2.3 血清学比较
检测尿8-OHdG观察实验大鼠体内氧化应激的改变;尿8-OHdG检测结果显示,在DG和Brb-50组均表现出显著增加(P<0.05)。然而,当用100 mg/(kg·d)的小檗碱处理后,与对照组相比差异无统计学意义(P>0.05)。当和对照组比较,血清抗氧化剂活性指标SOD、过氧化氢酶、谷胱甘肽过氧化物酶和GST在糖尿病大鼠中显著降低(P均<0.05)。小檗碱100 mg/(kg·d)处理后血清抗氧化水平显著升高,表现为大鼠血清SOD、过氧化氢酶、谷胱甘肽过氧化物酶和GST活性显著升高(P均<0.05)。而Brb-50与糖尿病大鼠之间差异无统计学意义(P>0.05)。

图3 小檗碱治疗12周对糖尿病大鼠尿8-羟基脱氧鸟苷(8-OhdG)、SOD活性、过氧化氢酶活性、谷胱甘肽过氧化物酶活性和GST活性的影响注:与CG组相比,#P <0.05,## P <0.01,###P<0.001;与DG组相比,*P<0.05,**P<0.01,***P<0.001。Fig.3 Effects of berberine treatment on urine 8-hydroxydeoxyguanosine (8-OhdG), SOD activity, catalase activity, glutathione peroxidase activity and GST activity in diabetic rats for 12 weeks
2.4 蛋白印迹分析
蛋白印迹结果如图4所示;与CG组大鼠相比,糖尿病大鼠的Runx2和Osterix的水平显著降低,而PPARγ的水平显著升高(P均<0.05)。在Brb-50组中的发现与糖尿病大鼠相似结果。然而,使用100 mg/(kg.d)小檗碱治疗后的糖尿病大鼠的Runx2和Osterix显著升高;而PPARγ显著降低。表明小檗碱治疗后骨形成能力显著增加,而成脂能力明显降低。
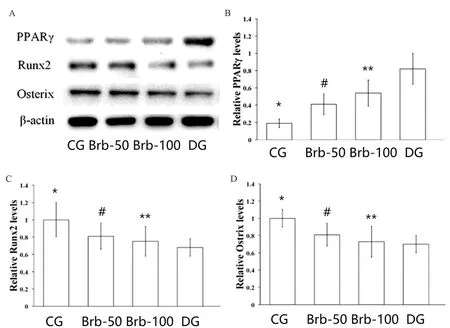
图4 成骨细胞标记基因(Runx2和Osterix)和脂肪细胞标记基因(PPARγ)的蛋白质印迹分析注:* P <0.05,** P <0.01,n=5。Fig.4 Western blot analysis of osteoblast marker genes(Runx2 and Osterix) and adipocytes marker genes (PPARγ)
3 讨论
慢性糖尿病是由高血糖引起的代谢疾病,可以引起多种严重的并发症。据报道,所有类型的糖尿病患者比正常人更容易出现一系列并发症,特别是骨质疏松症。患有糖尿病性骨病的人群处于骨折的高风险类别,甚至导致残疾和死亡[9]。据报道,血糖控制不佳的患者骨折风险增加;与具有良好控制血糖水平和非糖尿病患者的患者相比,风险大约高出47 %~62%[7]。由糖尿病引起的骨病在临床上非常常见,但在骨折发生之前通常无症状,因此给社会和个人带来了巨大的健康和经济负担。
本研究探讨了小檗碱对糖尿病大鼠骨量的影响;结果表明经过小檗碱的治疗可以修复糖尿病大鼠骨微结构的破坏。50 mg/(kg.d)剂量的小檗碱对糖尿病性骨量几乎没有影响,但在100 mg/(kg.d)水平的干预下,糖尿病大鼠的微结构受损和骨微观结构破坏大部分被逆转。以前的研究表明,小檗碱不仅可显著降低尿8-OhdG水平,而且还可上调大鼠血清抗氧化剂的活性[10];因此,提示小檗碱可能有助于改善糖尿病大鼠骨量的流失。糖尿病骨病的病理特征包括骨密度下降和骨微结构改变。这些特征主要是由于高血糖和氧化增加的程度,其与糖尿病性骨病的进展最相关。此外,链脲佐菌素诱导的大鼠受损的β细胞脱颗粒、变性甚至坏死,导致胰岛素分泌减少和血糖浓度增加[11]。小檗碱治疗在一定程度上增加了胰岛素的表达以及β细胞的再生,并发挥了促胰岛素和胰岛素致敏作用[12]。小檗碱可以通过激活各种组织中的AMPK信号通路降低了血糖水平,包括脂肪和肌肉[13]。研究已经表明,血浆葡萄糖水平的变化类似于糖尿病大鼠骨质减少发生率的变化。高葡萄糖水平是糖尿病性骨质疏松症发生的机制之一,高血糖具有引发氧化应激增加的能力,导致包括骨细胞在内的大量细胞类型的细胞功能障碍[14]。
在我们的研究中,糖尿病大鼠的尿中8-OHdG排泄增加,而血清抗氧化剂的活性显著下降。然而,在用100 mg/(kg.d)的小檗碱处理后,8-OhdG水平发生显著改变。尿8-OHdG水平呈现显著下降趋势,血清抗氧化剂活性显著增加。这些结果表明因此,表明小檗碱具有降低糖尿病大鼠的氧化应激程度的能力。已知Runx2和Osterix在成骨分化过程中表达[15],WB检测到Runx2和Osterix的表达在糖尿病大鼠中显著降低。这表明糖尿病大鼠骨形成能力降低。PPARγ是一种配体激活的转录因子,在脂肪细胞基因表达和分化中发挥核心作用[15]。PPARγ靶向在脂肪形成中起关键作用,PPARγ靶基因直接参与成脂途径。研究发现小檗碱处理后,PPARγ的表达明显降低,且呈剂量依赖关系,及使用100 mg/(kg.d)小檗碱效果更佳。
本研究表明小檗碱能够部分逆转糖尿病性骨质降低。在以100 mg(kg.d)给予小檗碱后,由糖尿病引起的骨量减少改善最为明显。但是,我们的研究存在一些局限性。具体而言,实验模型的数量相对较少,因此导致测量数据有限。此外,除了股骨外,我们还没有探讨髋部、脊柱、手腕或其他骨骼的骨质疏松症。最后也是最重要的限制是我们只依靠micro-CT来研究骨量,但是没有进行生物力学测试来测量骨强度。总之,本研究表明小檗碱能够通过促进成骨、抑制成脂和氧化应激来预防糖尿病大鼠的骨量丢失。
