NHL-2010方案治疗儿童淋巴母细胞淋巴瘤临床疗效及安全性分析*
2020-10-28蔡雯雯高举郭霞沈成奇朱易萍彭秋雨唐冰怡
蔡雯雯,高举,郭霞,沈成奇,朱易萍,彭秋雨,唐冰怡
610041 成都,四川大学华西第二医院/出生缺陷与相关妇儿疾病教育部重点实验室 儿科
非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)发病率占儿童期恶性肿瘤第3位,仅次于急性白血病和中枢神经系统(central nervous system,CNS)肿瘤。其中,淋巴母细胞淋巴瘤(lymphoblastic lymphoma,LBL)是儿童、青少年NHL中最常见的病理类型,约占儿童NHL的30%~35%。经过近半个世纪的探索,目前国际上儿童LBL的5年无事件生存率(event free survival,EFS)为70%~90%[1],而我国LBL 5年EFS为60%~85%,水平仍稍落后于发达国家[2-4]。为了解我国西部地区LBL的临床特点和预后,本文回顾性分析我院近5年收治的20例LBL患儿的病历资料,现将研究结果报道如下。
1 对象与方法
1.1 研究对象
选择2009年8月1日至2013年12月30日于四川大学华西第二医院儿童血液肿瘤科收治的初治诊断明确的20例LBL患儿为研究对象 。纳入标准:1)经病理学活检及免疫组化检查确诊LBL;2)年龄≤18岁;3)既往未接受过抗肿瘤治疗;4)病例资料完整,配合随访。排除标准:1)前期接受过抗肿瘤治疗;2)病例资料不完整;3)拒绝随访。
1.2 诊断及分期标准
本研究诊断标准参照WHO-2008诊断分型标准,患儿组织病理学活检及免疫组化结果确诊为LBL,或者细胞学(骨髓/体液)检查结果提示淋巴系肿瘤且免疫表型结果示LBL。LBL免疫组化结果常显示末端脱氧核苷酸转移酶,TdT、白细胞分化抗原99(CD99)呈阳性。其中,急性T淋巴母细胞白血病(T lymphoblastic lymphoma,T-LBL)可不同程度表达CD1a、CD2~5、CD7~8;B淋巴母细胞白血病(B lymphoblastic lymphoma,B-LBL)常表达HLA-DR、CD19~21,而分泌型免疫球蛋白SIg常呈阴性。
本研究LBL临床分期标准参照NHL分期系统[5]。其评估方法包括患儿临床症状、体格检查结果、血常规、乳酸脱氢酶(lactate dehydrogenase,LDH)水平、脑脊液检查、骨髓涂片或活检,以及X线、超声、CT和(或)MRI等影像学检查。其中,合并骨髓浸润的Ⅳ期LBL患儿骨髓幼稚细胞比例≤25%。
LBL患儿CNS累及诊断标准如下(符合以下任何一项)[6]:1)患儿脑脊液细胞学检查发现幼稚淋巴细胞;2)体格检查显示,患儿出现其他原因无法解释的颅神经受累症状和(或)体征;3)影像学结果示颅内占位,或者脊髓内占位性病变。
1.3 治疗方法
本研究LBL患儿治疗方法根据中国儿童NHL-2010方案[6]制定,并且按照临床分期将患儿分为低危组(Ⅰ期+Ⅱ期)和高危组(III期+IV期),其化疗流程见图1。NHL-2010方案参考柏林-法兰克福-蒙斯特(Berlin-Frankfurt-Münster,BFM)90/95方案进行相应修改(表1)。
1.4 治疗相关严重并发症的定义
治疗相关严重并发症定义为出现已确诊的传染病、重症肺炎、脓毒血症/败血症,合并呼吸、循环系统功能衰竭,需依靠辅助通气治疗,或者出现昏迷、颅内出血表现,以及由于其他原因需要转入重症监护病房治疗者[6]。
1.5 疗效评估标准
本研究疗效评估标准[5-6]为:若患儿体格检查、骨髓涂片、脑脊液细胞学及影像学检查等各项指征均提示肿瘤完全消失,则视为完全缓解(complete remission,CR);若患儿肿瘤体积缩小>50%,但未达CR标准,则视为部分缓解(partial remission,PR);若患儿原肿瘤病灶增大,或者病理检查提示新病灶出现,则视为疾病进展/复发。
1.6 随访及预后评价方法
本研究采用门诊、电话、微信等随访方式,随访频率前半年每月1次,半年后每3月1次。随访时间截至2015年6月30日。随访内容包括患儿一般状况,以及血常规、生化、骨髓检查等。失访定义为完成化疗后1年内无任何形式随访记录,以末次随访时间和疾病状态统计。EFS定义为自确诊之日至事件发生的间隔时间,包括疾病进展/复发、 任何原因所致死亡、放弃治疗或者第二肿瘤发生。
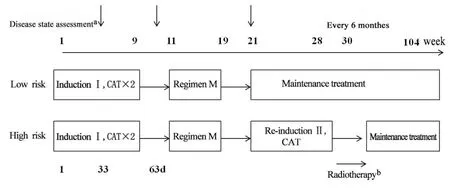
图1 中国儿童NHL- 2010方案[6]化疗流程图
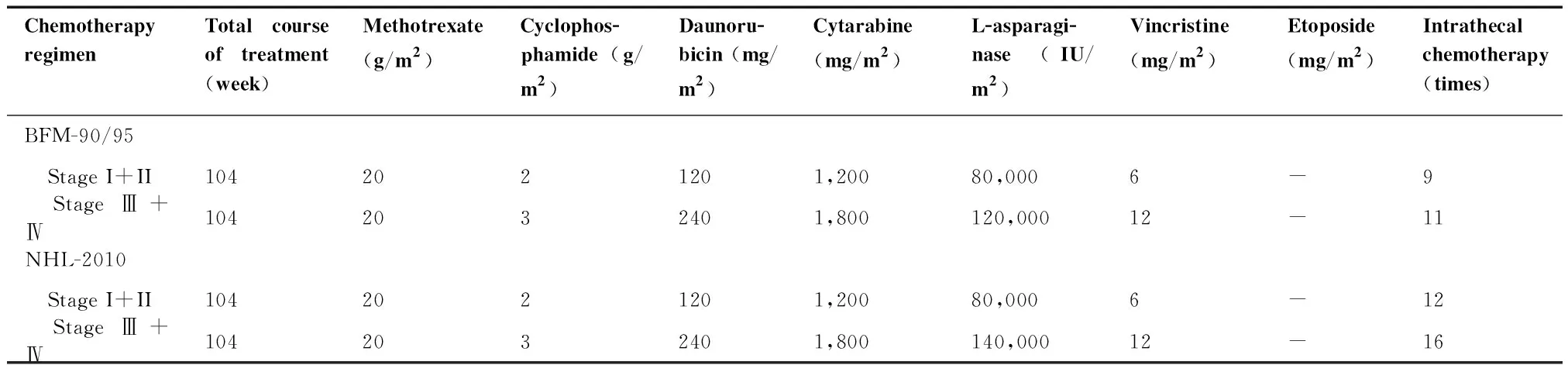
表1 NHL-2010和BFM90、95化疗方案不同化疗药物累积剂量累计剂量比较
1.7 统计学方法
本研究采用Ssize软件,确定满足统计检验的最小样本量。采用SPSS 19.0统计学软件包进行数据处理,样本平均数用中位数表示,计量样本比较用秩和检验,两组率的比较采用卡方检验或Fisher确切概率法。以Kaplan-Meier方法计算LBL患儿总体生存率(overall survival,OS)及EFS,并行Log-rank检验。检验水准为α=0.05。
2 结 果
2.1 一般资料
本研究入组患儿共20例,其中,男性17例,女性3例,男女性别构成比为5.7∶1;患儿中位发病年龄为8.8岁(2.3~ 14.3岁),其中,男性中位发病年龄为8.7岁(2.5~14.3岁),女性为9.0岁(2.3~ 13.0岁),男、女性患儿发病年龄比较,差异无统计学意义(P=0.586)。
2.2 临床资料
2.2.1临床分型及分期 20例LBL患儿中,T细胞型患儿12例(60.0%),B细胞型8例(40.0%)。其中,Ⅰ期2例(10.0%,2/20),Ⅱ期1例(5.0%,1/20),Ⅲ期12例(60.0%,12/20),Ⅳ期5例(25.0%,5/20)。低危组:3例(15.0%,3/20);高危组:17例(85.0%,17/20)。
2.2.2原发部位 12例T细胞型LBL患儿常常以纵隔包块或外周淋巴结肿大为首发临床表现,其中,原发于外周淋巴结肿大者8例(40.0%,8/20),原发于纵隔者4例(20.0%,4/20);8例B细胞型LBL患儿常以皮肤包块、外周淋巴结肿大为主要首发症状,其中,原发于外周淋巴结者3例(15.0%,3/20),原发于皮肤者2例(10.0%,2/20),腹盆腔2例(10.0%,2/20),此外,还可累及睾丸(5.0%,1/20)。
2.3 不良反应
本组3例患儿发生死亡,其中2例复发,均为骨髓复发;1例发生脓毒血症,病原菌为坐皮肤球菌(kytococcussedentarius)。治疗相关死亡率为5.0%(1/20)。1例诱导治疗第33天评估疾病为PR,后于诊断6个月后评估病情仍未达CR放弃治疗。
2.4 预后分析
2.4.1LBL患儿的OS和EFS 本研究中,至末次随访时仍呈无病生存患儿为16例,其中位随访时间为34.8月(2.4~67.4月),3年OS为85.0%,EFS为80.0%(图2)。
2.4.2不同临床因素与LBL患儿的OS和EFS关系分析 根据患儿年龄、性别、LDH水平增高、免疫分型、是否发生纵膈浸润及临床分期等临床因素分别对LBL患儿进行分组,各组患儿累积生存曲线分布与各临床因素的关系见表2。其中,男性、LDH>2N(正常参考值上限的2倍)及临床分期为Ⅲ、Ⅳ期的患儿3年EFS明显低于女性、LDH≤2N及临床分期为Ⅰ、Ⅱ期患儿的趋势,但是差异尚无统计学意义(P>0.05),而患儿年龄、免疫表型、是否发生纵隔浸润对EFS亦无显著影响(P>0.05)。

图2 LBL患儿3年OS和EFS

表2 不同临床因素与NHL患儿累积生存曲线分布的关系

Clinical parameterN3 year-OSχ2P3 year-EFSχ2P B cell type875.0%75.0%LDH >2N850.0%0.2010.19950.0%1.6520.283 ≤2N1288.9%83.3%Mediastinal infiltration Yes1385.7%0.0040.95071.4%0.4700.493 No784.6%84.6%Stage Ⅰ+Ⅱ3100%0.5640.453100%0.7780.378 Ⅲ+Ⅳ1782.4%76.5%
3 讨 论
LBL多见于儿童及青少年,以男性患儿多见,约占儿童NHL的30%~35%。LBL具有儿童NHL共有的多中心起源和远距离播散及结外侵犯等特点,亦具有临床表现特异性和高度侵袭性。儿童LBL疾病进展迅速,常见累及部位包括骨髓、纵膈及CNS,易转化为急性淋巴细胞白血病(acute lymphocytic leukemia,ALL),因此,多数LBL患儿在初诊时即为Ⅲ~Ⅳ期,通常预后较差。其中,T-LBL占85%~90%,多见于青少年,起源于胸腺,常侵犯纵膈,引起上腔静脉压迫综合征,并易累及骨髓和CNS;而B-LBL约占10%,易发生皮肤和骨髓浸润。本组LBL患儿中,原发于纵膈(4例)及伴有纵膈受累(4例)者约占40.0%,略低于国内其它单位报道的50%~70%[2-4],这可能与该类患儿就诊时压迫症状重不能及时手术明确诊断而丧失治疗机会有关。
目前国际上儿童NHL治疗方法主要根据其组织亚型进行分层治疗,并根据患儿分期调整治疗强度。其中,LBL的治疗经过了一个长期探索过程,多种化疗方案曾被尝试用于LBL的治疗中,曾经先后采用过以下几种方案:NHL传统化疗方案(即CHOP方案)、NHL改良化疗方案(即加用门冬酰胺酶的CHOP样方案)及ALL样化疗方案。早在70年代,CHOP方案的缓解率及EFS均不高。Murphy等[7]对Ⅲ期及Ⅳ期LBL患儿在CHOP方案基础上联合颅脑预防性放疗,其2年的EFS也仅为38.8%。随后,研究发现ALL和NK-T细胞淋巴瘤的肿瘤细胞,其门冬酰胺合成酶活性比正常细胞低,必需依赖细胞外门冬酰胺(aspara-ginase,Asn)的供应[8-10]。而左旋门冬酰胺酶(L-asparaginase,L-Asp)能特异性耗竭血浆中Asn,逐渐应用于ALL、LBL及NK-T细胞淋巴瘤治疗中。在采用含有L-Asp的LSA2-L2(环磷酰胺+长春新碱+甲氨蝶呤+多柔比星+泼尼松+阿糖胞苷+硫鸟蝶呤+L-ASP+卡莫司汀)方案时,LBL预后明显提高,其5年EFS为64%,而在COMP(环磷酰胺+长春新碱+甲氨蝶呤+顺铂)方案中LBL预后差,其5年EFS仅35%[11]。即使在COMP基础上联用柔红霉素及L-Asp也不能获得比LSA2-L2方案更好的治疗效果[12]。因此,有学者认识到各种组织学类型NHL采用同一种方案时,不同组织学类型NHL患儿其预后存在明显差异。随着对NHL的生物学表现、细胞遗传学及分子生物学研究的不断深入,发现虽然LBL发生基础及临床表现与ALL有所差别,但是都起源于原始淋巴细胞,从而确认了LBL与ALL之间的紧密关系,因此,欧美发达国家多数协作组逐渐采用类似ALL的含有高剂量L-Asp和甲氨蝶呤(methotrexate,MTX)的长疗程强烈化疗方案,LBL患儿远期生存率得到明显提高,5年EFS可达75%~90%[1,13-14],其中,BFM-90-LBL方案是目前报道过的治疗儿童及青少年LBL疗效最高的方案,5年EFS高达90%。高剂量MTX治疗时,血药浓度高,可以使MTX通过血脑屏障和血睾屏障,从而达到髓外清扫,减少复发的目的。因此,BFM-90方案中,MTX累积使用剂量达到了20g,同时,III期及IV期的患儿加用了预防性颅脑放疗(cranial radiation therapy,CRT)放疗,CNS复发率仅0.95%。但是,研究发现CRT可引起白质脑病、内分泌异常及二次肿瘤等严重的后遗症,因此,BFM-95方案尝试对无CNS受累的晚期LBL患儿不进行常规CRT预防治疗,其5年EFS为88%,CNS复发率为1.90%,与BFM90无明显差异[15]。因此,目前国际上预防性CRT治疗已逐渐减少。
国内各单位多数借鉴BFM90/95方案,在其基础上根据我国国情进行相应的修改,均取消了预防性CRT,所报道的OS和EFS高低不一。其中,北京儿童医院采用改良BFM-90方案的BCH-2003-LBL方案,3年EFS为85.4%[2],广州地区则报道其3年总体生存率为78.3%[3],而上海儿童医学中心报道其LBL患儿的5年EFS为64.1%[4]。本研究采用NHL-2010方案以及微调的BFM-90方案(增加L-Asp的累积剂量和鞘注次数)治疗LBL患儿,结果显示,3年OS为85.0%,EFS为80.0%。该结果接近国内报道的最佳疗效,但是仍然低于BFM-90方案(5年EFS达到了90%)。这提示,虽然采用同样的LBL治疗方案,但我国儿童LBL治疗效果仍未能达到与发达国家一致的疗效,生存率略低于后者。究其原因,可能主要与以下两个因素有关:1)虽然我国医疗体系仍在不断改进中,但全国各地的文化、经济发展仍不一致,西部地区相对落后,部分患儿家庭经济能力低下,无法承担长期化疗所需费用,因此无法按方案要求进行规律强化治疗,使化疗间期延长,影响患儿疗效及预后;2)与ALL相似,LBL维持治疗的持续时间较长,因此,维持治疗的有效性和患者依从性可以直接影响治疗有效性。研究显示,口服巯嘌呤的维持治疗期间,当ALL患儿依从率低于90%时,其复发风险增高[16]。而本研究中,部分LBL患儿家庭文化程度较低,可造成维持治疗期间患儿依从性差、无法定期就诊,或者在口服巯嘌呤的维持治疗过程中,患儿骨髓未达轻度抑制或肝功轻度受损时即自行停药,造成疗效即预后不佳。
目前,儿童LBL仍缺少公认的危险度分层因子。一方面,与儿童LBL预后相关的临床因素国内外研究报道不一。BFM90方案未发现明确与预后相关的因素[1]。也有部分国内外研究显示性别、年龄、原发纵隔肿瘤、免疫表型、巨大瘤块、临床分期、早期缓解情况等因素与其预后密切相关[2,4,17-18]。本研究发现,男性、LDH>2N及临床分期为Ⅲ期和Ⅳ期的患儿3年EFS呈明显低于女性、LDH≤2N及临床分期为Ⅰ、Ⅱ期患儿的趋势,但是差异无统计学意义,而患儿年龄、是否有纵隔浸润及免疫表型对本组患儿的EFS影响不大。但本组患儿样本量小,还有待于进一步扩大样本量进行研究。另一方面,随着对LBL发病机制、治疗和预后的深入研究,许多与预后直接相关的细胞遗传学和分子生物学因素逐渐被发现,但是由于缺乏大样本的临床研究,导致所发现的大多数遗传学异常的临床意义尚不明确且存在争议。那么,早期治疗反应不佳或复发的患者在分子生物学特征上是否具有预后不良的因素或其它独特的特点?解决该问题,可通过不断探索、发现与LBL预后相关遗传学改变,或者通过LBL患儿体内微小弥散病变检测结果以判断其预后,可能是今后LBL的临床研究方向。
对儿童及青少年LBL患儿采用高强度、长疗程、类似ALL的化疗方案,以及采用积极的CNS预防治疗方案,可以显著提高其远期生存率。但是,我国LBL治疗水平仍未达到国际先进水平,因此,如何进一步提高我国LBL患儿的OS,减少疾病复发,仍有待于进一步加强疾病宣教,以及提高患儿及其家属治疗依从性,并增强国内各治疗中心间的协作。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
