预后营养指数对宫颈癌患者同步放化疗疗效及预后的预测价值*
2020-10-28任建兰兰美孙畅徐杰郎锦义
任建兰,兰美,孙畅,徐杰,郎锦义
646000 四川 泸州,西南医科大学附属医院 肿瘤科(任建兰、郎锦义);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 放疗中心(兰美、孙畅、郎锦义);610041成都,四川大学华西第四医院 肿瘤科(徐杰)
宫颈癌作为女性常见妇科恶性肿瘤之一,其在全球的发病率及死亡率居于第4位[1-2],病例主要集中在发展中国家,2015年中国新发宫颈癌98 900例,死亡30 500例[3]。宫颈癌的治疗方式包括手术、放疗及配合化疗的综合治疗,以铂类为基础的同步放化疗是局部晚期及中晚期宫颈癌的主要治疗方式,患者5年生存率可达到60%~70%,但每年仍有近1/3的患者死于疾病复发及进展[4]。 近年来除临床病理因素外,与机体相关的营养和免疫状态等也越来越多地被研究并被认为影响患者预后[5-7]。预后营养指数(prognostic nutritional index,PNI)是一项结合营养与免疫状态的临床复合型血液指数,通过患者外周血淋巴细胞及血清白蛋白值计算得出。较早应用于胃肠道肿瘤患者手术风险及术后并发症预测评估[8]。研究证明,PNI值与食管癌、胃癌、胰腺癌和结直肠癌等恶性肿瘤的预后密切相关[9-12]。目前国内关于PNI对宫颈癌疗效及预后评估价值的研究较少,本研究通过比较治疗前不同PNI组宫颈癌患者的临床特征、疗效及生存差异,分析 PNI在宫颈癌预后评估中的潜在应用价值。
1 资料与方法
1.1 临床资料
回顾分析2015年1月至2016年11月于四川省肿瘤医院行同步放化疗的454例宫颈癌患者临床资料。纳入标准:1)经组织病理学诊断为宫颈癌;2)治疗前1周有完整血液学资料;3)临床资料、随访信息相对完善;4)所有患者均接受以铂类为基础的根治性同步放化疗。 排除标准:1)院外已行抗肿瘤治疗者;2)放化疗后行肿瘤手术切除患者;3)临床资料缺失者;4) 远处转移或合并第二原发肿瘤患者;5)有血液系统或自身免疫系统疾病、严重肝肾功能异常患者;6)拒访者;7)非宫颈癌原因死亡者。患者入组流程图见图1。

图1 患者入组流程图
1.2 治疗方法
1.2.1放疗 所有患者均接受根治性放疗。外照射采用适形调强放射治疗,处方剂量45Gy,25次,每周5次。近距离放射治疗,处方剂量7Gy/次,中危临床靶区(5~6)Gy/次,共5次,每周2次。
1.2.2化疗 所有患者均接受以铂类为基础的同步化疗,采用双药联合方案:紫杉醇135~150 mg/m2,多西他赛60~75 mg/m2;卡铂300~400 mg/m2,顺铂60~75 mg/m2,21天一个周期,共化疗3周期以上。
1.3 患者基本信息
患者临床资料包括年龄、病理类型、淋巴结转移情况、FIGO分期、肿瘤直径、身高、体重、放化疗前1周血液学资料(淋巴细胞、白蛋白、血红蛋白)。PNI值=5×淋巴细胞计数(×109/L)+血清白蛋白(g/L)。血红蛋白(hemoglobin,Hb)<110g/L定义为贫血。体重指数(body mass index,BMI)= 体重/身高的平方(kg/m2),分为体重过轻组(BMI<18.5 kg/m2),体重正常组(BMI:18.5~23.9 kg/m2),超重组及肥胖组(BMI:24.0~27.9kg/m2,BMI≥28.0 kg/m2)。
1.4 疗效评价
治疗结束后3个月行疗效评价,根据WHO实体瘤疗效评价标准:1)完全缓解(complete response,CR):所有病灶完全消失,维持≥4周;2)部分缓解 (partial response,PR):病灶最大径乘积缩小≥50%,维持≥4周;3)病变稳定(stable disease,SD):介于PR及PD之间;4)病变进展(progressive disease PD):1个或多个病灶增大增加>25%,或者出现新病灶。客观缓解率(objective response rate,ORR)=(CR+PR)/例数×100%。
1.5 随访
末次随访时间为2019年11月,随访方式包括门诊复查、住院复查和电话、短信随访等。所有患者在放化疗结束后2年内每3个月随访1次,2年后每6个月随访1次。随访内容包括:门诊查体、血液学检查、宫颈液基细胞学检查、盆腔核磁共振、胸片等。无进展生存期(progression-free survival,PFS)定义为患者明确诊断至疾病复发或转移的时间。总生存期(overall survival,OS)定义为患者明确诊断至死亡或末次随访时间。
1.6 统计学分析

2 结 果
2.1 患者临床特征
共324位患者符合纳入标准。根据FIGO分期共有Ib期患者18例(5.6%),II期169例(52.2%),III期127例(39.2%),IVA期10例(3.1%)。患者平均年龄(51.60±9.46)岁(25~84岁),平均随访时间(39.18±13.15)个月(4~59个月)。共有失访4例(1.2%),死亡71例(21.9%)。病情进展117例(36.1%),其中局部复发65例(20.7%),远处转移52例(15.4%),生存249例(76.9%)。体重过轻者19例(5.9%),体重正常183例(56.5%),超重92例(28.4%),肥胖30例(9.3%)。平均淋巴细胞计数为(1.55±0.50)×109/L,平均白蛋白值为(42.77±3.40)g/L,平均PNI为50.53±4.30(表1)。

表1 324例宫颈癌患者基本情况
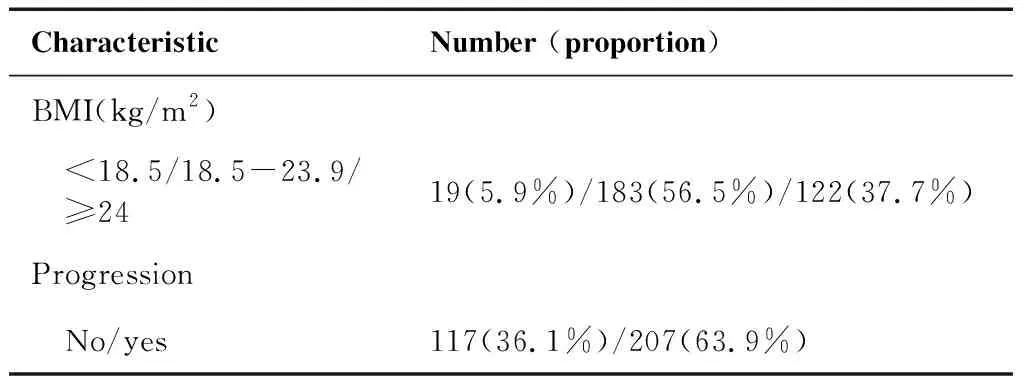
CharacteristicNumber (proportion)BMI(kg/m2) <18.5/18.5-23.9/ ≥2419(5.9%)/183(56.5%)/122(37.7%)Progression No/yes117(36.1%)/207(63.9%)
2.2 ROC曲线
以OS为状态变量,治疗前PNI为检验变量,绘制ROC曲线(图2)。PNI的最佳截断值为49.55,约登指数为0.410,敏感度71.83%,特异度69.17%;AUC为0.717(P<0.001)。将患者分为高PNI组(PNI>49.55)195例(60.2%),低PNI组(PNI≤49.55)129例(39.8%)。
2.3 PNI与宫颈癌患者临床特征的相关性分析
高PNI组及低PNI组宫颈癌患者之间PNI值、年龄、病理类型、贫血、BMI值之间差异有统计学意义(P<0.05)。两组患者间FIGO分期、淋巴结转移、肿瘤直径差异无统计学意义(P>0.05)(表2)。

图2 治疗前PNI的ROC曲线

表2 宫颈癌患者PNI值与临床特征的关系
2.4 PNI与宫颈癌患者疗效的关系
所有患者均参加疗效评价,其中达到CR 211例(65.1%),PR 72例(22.2%),SD 12例(3.7%),PD 29例(9.0%),ORR为87.3%。高PNI组(PNI>49.55)的ORR为93.85%(183/195),低PNI组(PNI≤49.55)ORR为77.52%(100/129),两组间差异具有统计学意义(χ2=18.724,P<0.001)。
2.5 生存分析
截止末次随访,全组患者的中位OS及PFS未达到,其3年OS及PFS分别为79.3%、67.2%。高PNI组(PNI>49.55)与低PNI组(PNI≤49.55)患者3年OS之比为90.3%vs62.8%(P<0.001),3年PFS之比为79.9%vs48.1%(P<0.001)(图3)。
2.6 影响宫颈癌患者预后因素的COX回归分析
COX单因素分析结果显示影响患者OS的危险因素有:年龄、淋巴结转移情况、肿瘤最大径>4 cm、病理类型、治疗前的PNI值<49.55、贫血(Hg<110 g/L)、体重过轻(BMI<18.5 kg/m2)。Cox多因素回归分析提示PNI值≤49.55、病理类型为非鳞癌、淋巴结转移、肿瘤最大径>4 cm是影响宫颈癌患者OS的独立不良预后因素(表3)。同样的方法可得出影响患者PFS的独立预后危险因素为PNI值≤49.55、病理类型为非鳞癌、淋巴结转移(表4)。
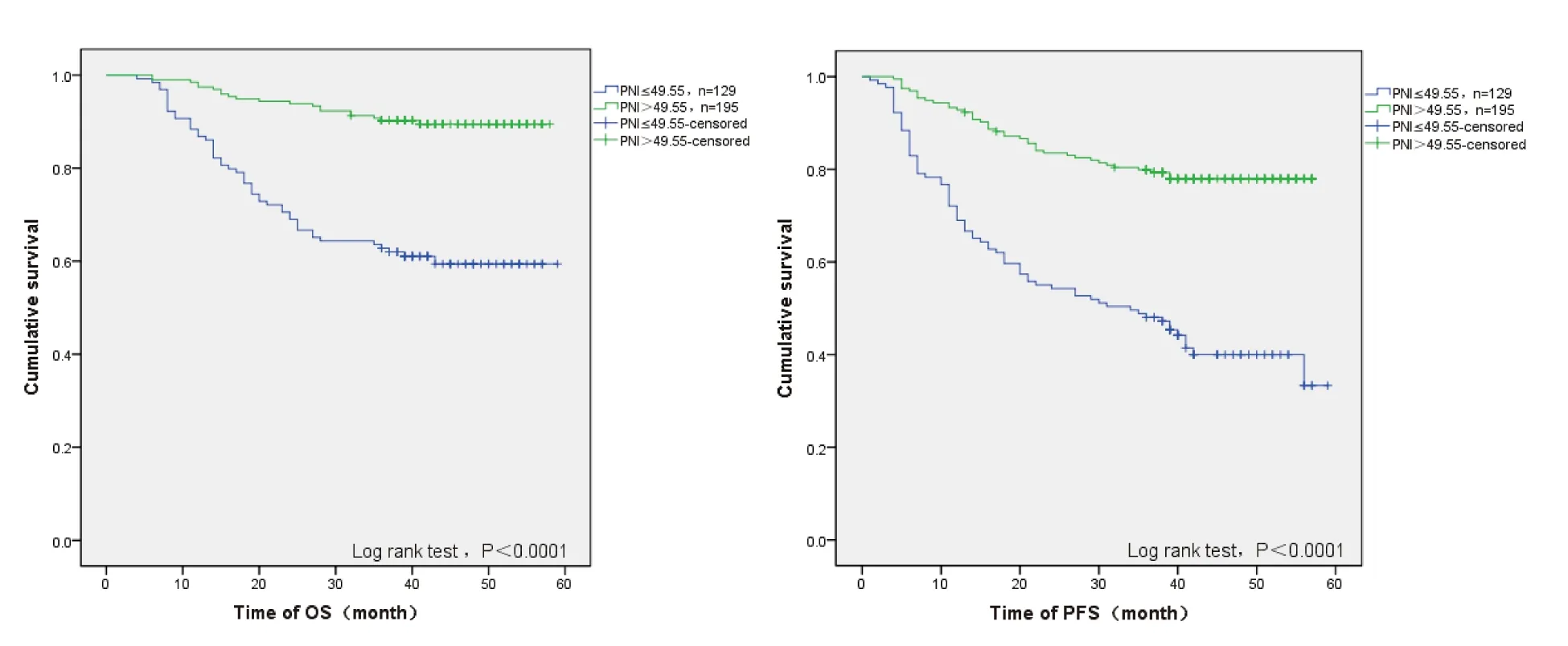
图3 患者的Kaplan-Meier生存曲线图

表3 影响患者OS的单因素及多因素分析

VariableUnivariate analysisMultivariate analysisHR95%CIPHR95%CIPHistology SCC11 Non-SCC3.5241.748-7.105<0.0012.9821.436-6.1950.003Maximum tumor size(cm) ≤411 >42.4351.334-4.4440.0042.1071.103-4.0260.024PNI ≤49.551 >49.550.2130.127-0.358<0.0010.2390.138-0.416<0.001Hb(g/L) <11011 ≥1100.5220.326-0.8370.0071.1300.650-1.9670.665BMI (kg/m2) <18.511 18.5-23.90.3210.154-0.6790.0020.5730.269-1.2230.150 ≥24.00.4070.192-0.8640.0190.8850.404-1.9390.760

表4 影响患者PFS的单因素及多因素分析
3 讨 论
目前,临床医师多采用分期、淋巴结转移情况、组织学分级和浸润深度等因素来判断疾病的预后[13],但其敏感性及特异性仍有所欠缺[14-15],除分期外其余因素只能在手术后评估,不适用于放化疗患者。此外,人乳头瘤病毒、某些RNA及miRNA[16-17]表达也被证明可以用于宫颈癌患者预后评估,但因其检测复杂且费用昂贵,临床实际应用受限。因此寻找更加便捷有效的预测指标对改善患者疗效及预后具有重大意义。在宫颈癌众多预后因素中,患者治疗前营养及免疫状态是重要因素之一。
PNI最早是由Onodera等[8]提出,创造性地结合了血清白蛋白和外周血淋巴细胞数目两项血液指标。血清白蛋白常用于评估机体营养状况,恶性肿瘤患者因肿瘤高负荷及治疗引起的副反应常常合并有营养不良,导致其治疗耐受性差,疗效欠佳,预后不良[18-19]。低蛋白血症已被证明与肺癌、结直肠癌、胃癌、淋巴瘤等多种癌症患者不良预后相关[20-23]。淋巴细胞可以通过激活细胞毒性淋巴细胞增殖以遏制机体中恶性肿瘤细胞的增殖与迁移,减少肿瘤的进展与复发[24-25]。营养不良时,患者淋巴细胞减少提示机体抗肿瘤免疫力降低。因此,PNI能同时反应患者的营养状态及免疫功能,其对疗效及预后的评估作用越来越受重视。2016年,日本学者Haraga等[26]研究发现同步放化疗宫颈癌患者预处理PNI值与分期、淋巴结转移、宫旁浸润相关,且PNI值降低是患者OS及PFS的独立不良预后因素。Ida等[27]研究发现,复发宫颈癌患者复发时PNI值越高患者生存时间越长。本研究纳入324例同步放化疗宫颈癌患者,关注PNI值与患者临床特征之间的关系,结果显示PNI值与患者年龄、病理类型、是否贫血(Hb<110g/L)、体重过轻(BMI<18.5kg/m2)相关。COX单因素及多因素分析均提示治疗前PNI值是评估宫颈癌预后的独立危险因素。高PNI组患者放疗客观缓解率(93.85%)明显高于低PNI组(77.52%),高PNI组3年生存率及无进展生存率明显高于低PNI组,提示治疗前PNI值越高,患者的放化疗疗效及预后越好。
综上所述,营养预后指数获取可行性好,简单便捷、可作为评估宫颈癌患者疗效及预后的预测指标。本研究为单一机构回顾性分析,样本量偏小且随访时间短,相关结论可能需要多中心大样本量的前瞻性研究证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
