飞燕草素抑制大鼠乳腺癌发生的机制探索*
2020-10-28白金玉宋慧敏徐苗徐嘉琪韩彬彭晓莉
白金玉,宋慧敏,徐苗,徐嘉琪,韩彬,彭晓莉
610500 成都,成都医学院 公共卫生学院
近二十年来,全球乳腺癌的发病率不断上升,成为很多地区女性最常见的恶性肿瘤,威胁女性的身心健康[1]。植物化学物抗癌研究成为乳腺癌防治研究的方向之一[2]。花青素属黄酮类化合物,在植物中花青素以花色苷的形式存在,具有抗炎、抗氧化等多种生物学活性,对多种疾病具有防治作用,如肿瘤、心血管疾病等[3]。飞燕草素是花青素中常见的一种单体,生物学活性较强,研究发现飞燕草素能抑制肿瘤细胞增殖、血管生成和侵袭转移,诱导肿瘤细胞凋亡,具有抗乳腺癌的作用[4-6]。乳腺癌是激素依赖性肿瘤,雌激素受体表达是乳腺癌内分泌治疗的一项重要指标。雌激素通过与雌激素受体结合发挥生理效应。雌激素受体包括核受体和膜受体。雌激素受体-α(estrogen receptor-α,ER-α)属核受体,位于细胞核中,与其配体结合后通过调节下游靶基因转录发挥作用。乳腺癌内分泌治疗的雌激素替代疗法就是以ER-α作为治疗指标[7]。G蛋白偶联雌激素受体(G protein coupled estrogen receptor,GPER)属膜受体,与配体结合后能快速调节细胞内信号级联反应,在乳腺癌的发生中也发挥着重要作用[8]。
本课题组前期通过建立甲基亚硝基脲(1-methyl-1-nitrosourea,MNU)诱导的大鼠乳腺癌发生模型,发现飞燕草素能显著抑制大鼠乳腺癌发生[9]。为进一步探讨飞燕草素抑制乳腺癌发生的分子机制,本实验取飞燕草素膳食干预致癌物诱导乳腺癌发生的大鼠模型乳腺组织,检测大鼠乳腺组织中ER-α的表达水平,并通过乳腺癌MCF-7细胞实验,探索飞燕草素是否通过调节ER-α和GPER的表达而抑制乳腺癌的发生。另外,ER-α对Notch信号通路有调节作用[10],而Notch信号通路在细胞增殖、凋亡中发挥重要作用,并且通过诱导乳腺癌细胞上皮间充质转变,促进乳腺癌细胞迁移和侵袭,是促进乳腺癌发生发展的重要通路之一[11]。因此,本研究亦尝试探讨飞燕草素对乳腺癌MCF-7细胞Notch信号通路的影响,为飞燕草素抗乳腺癌的机制探索提供研究基础。
1 材料与方法
1.1 试剂
飞燕草素(纯度25%)购于中国大兴安岭林格贝寒带生物科技股份有限公司。ER-α和GPER抗体购自美国Abcam公司。MNU和雌二醇购于美国Sigma公司。
1.2 仪器
主要使用仪器包括日本Olympus公司的IX71型倒置荧光相差显微镜;美国Thermo公司的Biofuge stratos台式高速冷冻离心机和ND-2000微量紫外可见光分光光度计;Bio-Rad伯乐公司PCR仪,石蜡切片仪。
1.3 实验动物
清洁级 Sprague-Dawley(SD)大鼠:40~50 d,体重140~160 g,大鼠饲养于SPF级动物实验室,常规饮食,环境湿度保持40%~50%,环境温度保持(22±2)℃。
1.4 飞燕草素干预大鼠乳腺癌发生模型的建立
动物分组及处理方式:雌性SD大鼠随机分为3组:正常对照组12只;对照组16只;飞燕草素干预组16只。大鼠分组后,适应饲养7 d,对照组和飞燕草素干预组给予MNU注射,正常对照组给予等体积生理盐水注射。MNU临用前,使用含0.05%冰醋酸的无菌生理盐水配制成10 mg/mL的溶液,以50 mg/kg体重的剂量,对大鼠进行单次腹腔注射。实验过程中,飞燕草素干预组以灌胃方式给予飞燕草素,灌胃剂量为100mg/kg/d,;对照组和正常对照组组给予等体积生理盐水灌胃。大鼠每周称重1次,自由饮食和饮水。实验结束后,取大鼠乳腺组织石蜡切片。
1.5 免疫组化染色
乳腺组织石蜡包埋,切片后进行免疫组化染色,辣根过氧化物酶显色试剂盒进行显色处理,用PBS缓冲液作为阴性对照,雌激素受体抗体免疫组化染色后以细胞核呈中等强度棕黄色判定为阳性细胞,在低倍镜下(×10)浏览整张切片选择热点区域,用高倍(×40)对阳性细胞进行计数,结果表示为阳性细胞在整张切片中同类型细胞中的百分比。
1.6 细胞培养
人乳腺癌MCF-7细胞培养在37℃、5% CO2培养箱中,使用10%胎牛血清的DMEM培养基,常规方法进行传代。实验开始前4 d将细胞用PBS洗涤后,改用无酚红DMEM培养液中培养。选择对数生长期的细胞进行实验。
MCF-7细胞细胞消化后计数,以5×104个/mL细胞的密度接种至细胞培养瓶中。待细胞贴壁生长至80%左右,以0、10、20、40 μM飞燕草素作用细胞24 h后收集细胞,加入细胞裂解液,120 000×g离心,取上清液,测定蛋白含量后用于分析。探讨雌二醇存在时,飞燕草素对乳腺癌MCF-7细胞ER-α和GPER蛋白表达的影响,加入1×10-8mol/L雌二醇12 h以后,再加入40 μM飞燕草素作用MCF-7细胞24 h后提取蛋白。
1.7 细胞划痕试验
对数期的MCF-7细胞以1×105/mL密度接种于12孔培养板。细胞生长至75%密度,分别以0、20、40 μM飞燕草素作用细胞,24 h后用20 μL枪头沿线垂直划痕,PBS冲洗除去悬浮细胞,加入无血清培养基,在划痕0、24 h和48 h拍照,每个实验组随机取5个视野。计算迁移率,计算公式为:迁移率(%)=划痕后某时间点测得的无细胞区域面积/划痕后测得的划痕面积×100%。
1.8 Western blot检测乳腺癌MCF-7细胞ER-α、GPER、Notch-1和 PTEN蛋白表达
调节蛋白样品浓度,保证每个样品上样量为35 μg。采用聚丙烯酰胺凝胶电泳进行蛋白分离,半干电转膜仪转膜,BSA封闭非特异结合位点,ER-α和GPER抗体4℃孵育过夜;二抗孵育后,化学试剂显色发光,采用多功能成像系统进行曝光。
1.9 荧光实时定量PCR(Quantitative Real-Time PCR,qRT-PCR)检测ER-α和GPER mRNA水平
飞燕草素作用乳腺癌MCF-7细胞48 h后,收集细胞,Trizol法提取总RNA,反转录为cDNA。RT-qPCR方法检测ER-α和GPER mRNA水平。采用ΔΔCt法进行相对定量。调节样品cDNA浓度后,加入4 μg cDNA、12.5 μL SYBR混合物和1 μL引物组成25μL反应体系。首先在95℃下变性10 min,并进行30个循环的扩增(95℃15 s,60℃ 1 min)。按体系进行反应,各基因分别设3孔平行。采用结果进行分析统计,将GAPDH作为内参照的基因。所用的引物见表1。

表1 qPCR引物序列
1.10 数据统计学处理方法
2 结 果
2.1 飞燕草素对乳腺癌组织雌激素受体表达的影响
实验采用免疫组化方法检测大鼠乳腺组织ER-α表达。结果发现正常对照组、对照组和飞燕草素干预组大鼠乳腺组织ER-α均有阳性表达。与正常对照组比较,MNU致癌组大鼠乳腺组织ER-α表达显著增高(P<0.01),飞燕草素干预大鼠能明显降低大鼠乳腺组织ER-α的表达(P<0.01)。

图1 飞燕草素对致癌物诱导大鼠乳腺组织ER-α表达的影响 (×400)
2.2 飞燕草素对乳腺癌细胞MCF-7迁移能力的影响
划痕试验结果显示,24 h时,40 μM飞燕草素作用后细胞划痕面积明显高于0 μM和20μM飞燕草素作用后的细胞(P<0.01,P<0.05);48 h时,40 μM飞燕草素作用后细胞划痕面积明显高于0 μM和20 μM飞燕草素作用后的细胞(P<0.01)。结果表明40 μM飞燕草素作用细胞后,能显著抑制MCF-7细胞的迁移能力(图2),提示飞燕草素对MCF-7细胞的迁移能力具有抑制作用。
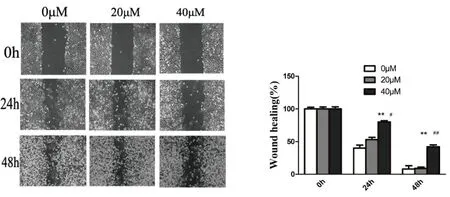
图2 飞燕草素对MCF-7细胞迁移的影响
2.3 飞燕草素对乳腺癌MCF-7细胞ER-α和GPER蛋白表达的影响
根据CCK-8预实验,实验采用0、10、20、40 μM飞燕草素作用乳腺癌MCF-7细胞,通过Western blot检测飞燕草素对乳腺癌MCF-7细胞ER-α和GPER蛋白表达的影响。由图3可见,飞燕草素能明显降低MCF-7细胞ER-α和GPER蛋白表达水平。qRT-PCR结果也显示,飞燕草素能显著降低MCF-7细胞中ER-α和GPER mRNA水平(P<0.01)(图4,图5)。

图3 飞燕草素对乳腺癌MCF-7细胞ER-α和GPER蛋白表达的影响
2.4 雌二醇存在条件下飞燕草素对乳腺癌MCF-7细胞ER-α和GPER蛋白表达的影响
为了进一步探讨飞燕草素对ER-α和EPER蛋白表达是否与雌激素有关。实验在飞燕草素作用MCF-7细胞以前,在培养液中加入1×10-8mol/L雌二醇,再检测ER-α和EPER蛋白表达。由图6可见,雌二醇作用后的MCF-7细胞,40 μM飞燕草素仍能降低ER-α和EPER蛋白表达水平,提示飞燕草素在雌二醇环境下仍能抑制ER-α和EPER蛋白表达。
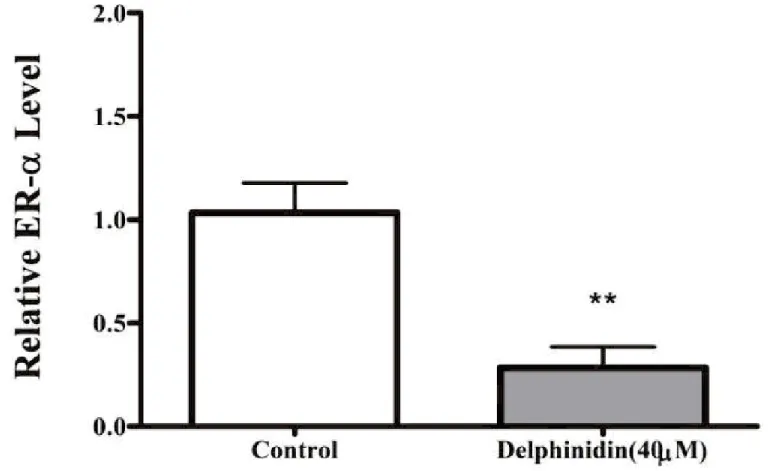
图4 飞燕草素对乳腺癌MCF-7细胞ER-α mRNA水平的影响

图5 飞燕草素对乳腺癌MCF-7细胞GPER mRNA水平的影响

图6 雌二醇环境下飞燕草素对乳腺癌MCF-7细胞ER-α和EPER蛋白表达的影响
2.5 飞燕草素对乳腺癌MCF-7细胞Notch-1/PTEN信号通路的影响
飞燕草素作用乳腺癌MCF-7细胞24 h后检测飞燕草素对Notch通路的Notch-1和PTEN蛋白表达的影响。由WB实验结果(图7)可见,20 μM和40 μM飞燕草素作用乳腺癌MCF-7细胞能显著降低细胞Notch-1蛋白表达,提高PTEN蛋白表达水平。
3 讨 论
雌激素在体内与雌激素受体结合,发生雌激素受体二聚化后,与靶基因的雌激素反应元件结合,继而激活Notch、MAPK、PI3K和JNK等信号转导通路,促进细胞生长和增殖,抑制细胞凋亡,促进乳腺癌的发生[12]。人工合成的纯雌激素拮抗剂氟维司群就是利用其可与ER-α结合的能力,阻断雌激素受体的信号途径,而成为抗乳腺癌的药物[13]。GPER是一种新型雌激素受体,能够在多种乳腺癌细胞中介导雌激素效应,促进乳腺癌细胞增殖,研究GPER与乳腺癌内分泌治疗有关[14]。有研究报道海南蒲桃(SyzygiumcuminiL,即印度称为jamun的浆果)富含花色苷,能抑制雌激素诱导的大鼠乳腺癌发生,并能降低ER-α蛋白表达水平[15]。本课题组前期研究发现飞燕草素能显著抑制致癌物诱导的大鼠乳腺癌发生[9]。在本研究中,我们发现飞燕草素能抑制大鼠乳腺组织内ER-α水平的升高,细胞实验也证实飞燕草素能明显降低乳腺癌MCF-7细胞ER-α和GPER的蛋白表达水平,提示飞燕草素作用于雌激素受体通路可能是其发挥抑制乳腺癌作用的机制之一。
研究发现,Notch信号通路异常在肿瘤的发生发展中发挥重要作用,而雌激素可通过Notch信号通路调节乳腺癌血管的生成,促进乳腺癌生长,阻断Notch信号通路的表达或可成为肿瘤治疗的新方向[16]。研究证实抑制乳腺癌细胞中的Notch-1通路,能降低其下游蛋白的表达,从而有效地抑制细胞增殖并促进细胞凋亡[17]。抑癌基因PTEN可通过促进乳腺癌细胞的凋亡、抑制肿瘤细胞迁移、抑制肿瘤血管生成等途径,阻遏抑制乳腺癌发生发展[18]。研究发现激活Notch信号通路引起PTEN蛋白表达下调是乳腺癌干细胞发生耐药的重要分子机制,抑制Notch-1,促进PTEN的表达,可以提高乳腺癌干细胞对药物敏感性[19]。我们实验发现飞燕草素能明显降低乳腺癌MCF-7细胞Notch1蛋白表达,提高PTEN蛋白表达水平。结果提示飞燕草素可能通过雌激素受体,调节Notch-1/PTEN信号通路,从而发挥抑制乳腺癌的作用。
综上所述,本研究初步发现飞燕草素能抑制致癌物诱导大鼠乳腺癌组织ER-α的表达增高,对乳腺癌MCF-7细胞ER-α和GPER的蛋白表达具有抑制作用,进一步发现飞燕草素能调节乳腺癌MCF-7细胞Notch-1/PTEN信号通路。飞燕草素是否通过ER-α调节Notch-1/PTEN信号通路,还需要进一步实验证实。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
