芝麻繁育特性研究Ⅴ:花粉活力与柱头可授性
2020-10-28乐美旺饶月亮颜廷献颜小文梁俊超周红英
孙 建,魏 星,乐美旺,饶月亮,颜廷献,颜小文,梁俊超,周红英
(1.江西省农业科学院 作物研究所,国家油料改良中心南昌分中心,江西省油料作物生物学重点实验室,南昌 330200;2.华中农业大学 生命科学技术学院,武汉 430070)
芝麻(SesamumindicumL.)隶属于胡麻科胡麻属,是古老而优质的重要油料作物,分布非常广泛,热带、亚热带、温带等区域均有种植,几乎栽培于中国所有省份。有活力的花粉、有效的媒介和有可授性的柱头是植物生殖成功,实现有性繁殖的前提条件,也是植物生殖生物学的重要研究内容[1-3]。已有的研究表明,芝麻是以自交为主的具有较高天然异交率的植物,异交率为5%~23%[4-5],特殊情况高达65%[6]。以蜜蜂为主的传粉昆虫是芝麻异花授粉的主要媒介[7-8]。芝麻花粉与柱头接触后5~10 min开始萌发,15~30 min大量萌发,2 h后生长最快的花粉管抵达花柱基部,花粉管伸长速度约3.0~4.7 mm/h,授粉后4~6 h大量花粉管进入子房完成受精[9-10]。理论上,一粒花粉即能够让一个胚珠受精发育成一粒种子[11]。然而,关于芝麻花粉活力和柱头可授性这两个生殖生物学重要内容的研究报道很少。仅仅在花粉育性的检测上参考其他作物采用了I2-KI染色法[12-13]、醋酸洋红染色法[14]等方法,尚未有较系统的研究。本研究比较分析直接观察法、醋酸洋红染色法、I2-KI染色法、无机酸法、MTT染色法、TTC染色法和FDA荧光检测法等7种方法在芝麻花粉活力上的检测效果,并监测花粉活力的日变化情况,采用联苯胺-过氧化氢法和不同时间直接授粉法对芝麻柱头可授性的日变化进行研究,以期丰富芝麻繁育和生殖生物学内容,为芝麻种子繁育及生殖发育等相关研究提供了理论参考。
1 材料与方法
1.1 材 料
试验材料为芝麻品系‘赣芝928’,夏季种植于江西省农科院作物研究所试验基地,种植行距40 cm,株距15 cm,田间管理如常。种子均由江西省农业科学院作物研究所提供。
1.2 方 法
1.2.1 花粉活力的不同检测方法 试验采取以下7种花粉活力检测方法,花粉采集于盛花期 8:00-11:00。显微观察在OLYMPUS BX51荧光生物显微镜下进行,在200×视野下观察并计算花粉数目,每个样品随机观察10个视野以上,累计观测花粉粒200粒以上,重复3次。
花粉活力=具有活力花粉数量/总花粉数 量×100%
(1)直接观察法:将采取的花粉直接置于载玻片上,滴加1滴清水后盖上盖玻片,直接置于显微镜下观察,形态皱缩不规则的为没有活力花粉。
(2)醋酸洋红染色法:该方法的染色原理是靠花粉中的脱氢辅酶而染色,有活力的花粉被染成红色,无活力或败育的花粉染色浅或无色[15]。采取的新鲜花粉置于载玻片,滴加φ=1%醋酸洋红染色液盖片后置于显微镜下观察[16]。染色液配制方法为将1 g洋红加入到100 mLφ=45%的醋酸溶液中,煮沸后将生锈铁钉放入10~30 s左右取出,冷却过滤,遮光保存,备用[17-18]。
(3)I2-KI染色法:淀粉遇碘变蓝,根据染色程度判断花粉粒中的淀粉含量,从而确定花粉活性。采取新鲜花粉置于双凹载玻片,滴加I2-KI染色液后,于30 ℃恒温箱培养30 min后,在显微镜下观察,有活力的花粉染色较深,呈蓝褐色,活力衰弱或内含物少的着色较浅,呈黄褐色。I2-KI染色液的配制方法为取1.3 g KI溶于水,再加0.3 g碘,定容至100 mL,置棕色瓶,备用[19]。
(4)无机酸法:由于酸对花粉粒质膜的刺激作用,使质膜变得非常脆弱,通透性增大,以致大量地吸收H+,使内压迅速升高并导致质膜膨胀,最后活性花粉的胞质内含物喷射出来,形成“瞬时花粉管”[20-21]。取新鲜花粉置于双凹载玻片上,滴加0.8 mol/L的硝酸溶液,室温放置5~10 min后显微镜观察,有活力的花粉胞质内含物喷射而形成瞬时花粉管[21]。
(5)MTT(噻唑蓝)染色法:有活力花粉细胞中的脱氢酶将MTT染色液还原成蓝紫色或红褐色结晶并沉积在细胞中,而无活力或败育的花粉则染色浅或无色[22]。利用w=5%的蔗糖溶液配制w=1%的噻唑蓝染色液,采取新鲜花粉置于双凹载玻片上,滴加MTT染色液后,室温放置30 min后显微镜观察,花粉着色深,呈红褐色的为有活力花粉[18,22]。
(6)TTC(氯化三苯基四氮唑)染色法:氯化三苯基四氮唑是氧化还原色素,其水溶液无色,遇到活细胞中的脱氢酶(NADH和NADPH)而接受氢离子还原后生成不溶于水的三苯甲酯,呈红色[23-24]。采取新鲜花粉置于双凹载玻片上,滴加φ=0.5%TTC溶液,35 ℃恒温箱培养15 min后显微镜观察,着色为红色或红褐色的为有活力花粉,着色浅和不着色的为无活力或不育花粉[25]。0.5%TTC溶液的配制方法为0.5 g TTC加少许φ=95%酒精溶解后,用蒸馏水稀释至100 mL,遮光保存,备用[25]。
(7)荧光检测法(FDA法):荧光素二醋酸酯(FDA)本身不产生荧光,可以自由透过完整的原生质膜,进入有活性的细胞原生质后能被酯酶分解形成能产生荧光的荧光素,荧光素不能自由出入原生质膜,便在有活性的细胞内积累,而无活性的细胞则不产生荧光[23,26]。用0.5 mol/L的蔗糖溶液配制0.1 g/L的FDA溶液,采取新鲜花粉置于双凹载玻片上,滴加FDA溶液后,于30 ℃恒温箱培养15~20 min后在荧光显微镜下观察,有活力的花粉将发出荧光[27]。
1.2.2 花粉活力日变化检测方法 于盛花期选择晴好天气的7:30-17:30每隔2 h采集新鲜花粉进行花粉活力的日变化观测,采用MTT染色法,在200×显微镜下随机观察10个视野以上,观察并计算花粉数目,累计观测花粉粒200粒以上,共观测3 d,视为3次重复。
1.2.3 柱头可授性的测定方法 采用联苯胺-过氧化氢法测定柱头可授性[28-30]。选取当天开放的花朵,取柱头前段,放入200 μL离心管中,加入50 μL联苯胺-过氧化氢反应液[1%联苯胺∶3%过氧化氢∶水=4∶11∶22(体积比)]。若柱头具可授性,呈现出过氧化物酶活性,则过氧化氢分解,联苯胺被氧化,则柱头周围的反应液有气泡出现,根据气泡产生的快慢和多少确定柱头可授性等级,并记录相应得分[2]。分级标准为:1级,有较少气泡,具有低可授性,计1分;2级,具有较多气泡,具有中等可授性,计2分;3级,有连续大量气泡,具有高可授性,计3分(图1所示)。测定时间为芝麻盛花期的7:30-17:30,每隔2 h测1次,每次测10个正在开放花朵的柱头,共观察 3 d,视为3次重复。

A为3级,具有大量气泡,计3分;B为2级,具有较多气泡,计2分;C为1级,具有较少气泡,计1分
1.2.4 不同授粉时间下的相对结实率日变化监测方法 于盛花期选择晴好天气,于前一天傍晚17:00左右对芝麻次日即将开放的花朵进行去雄去花冠处理,并吊牌做好标记。次日清晨7:30左右收集刚开放的新鲜花粉(带花冠一起采集),放置于垫有湿纸巾的密封盒内,再将密封盒放在 10~15 ℃保存(笔者课题组实验证明该方法可以高活力保存芝麻花粉12 h以上)。将采集的花粉于 7:30-17:30时每隔2 h对前一天已去雄的柱头进行授粉,每次授粉柱头数30个左右,并在吊牌上标记好授粉时间和授粉柱头数。共重复3 d该试验,视为3次重复。待蒴果成熟后,收获标记了的蒴果,统计蒴果数和每蒴粒数,计算结蒴率和相对结实率。计算公式为:结蒴率=(有效蒴果数/标记授粉柱头数)×100%,有效蒴果是指含有正常籽粒的蒴果;相对结实率=(测定粒数/蒴果数)/对照的每蒴粒数×100%,对照的每蒴粒数是指自然授粉状态下的每蒴粒数。
1.3 数据分析
数据分析均在Excel 2007和SPSS 18.0软件上进行,图表制作在Excel 2007和Adobe Photoshop CS2软件上完成。
2 结果与分析
2.1 芝麻花粉活力不同检测方法的比较
(1)不作处理的直接观察法的结果如图2-A所示,芝麻花粉主要呈颜色较深且形状圆形或卵圆形、颜色浅且形态圆形或卵圆形、颜色浅且形态不规则等3种类型,难以判定花粉活力,因此,该方法不适合芝麻花粉活力检测。
(2)醋酸洋红染色法染色效果十分明显,如图2-B,具活力的花粉被染成红褐色,形状呈圆形或卵圆形,而形状不规则且不着色或着色浅的花粉即为不具活力的花粉粒。该方法操作简单,染色效果好,容易判别。试验中测定花粉活力为 93.89%。
(3)I2-KI染色法在芝麻花粉活力检测中出现着色深且形状圆形或卵圆形、着色浅且形状圆形或卵圆形、不着色或着色浅且形状不规则等3种类型的花粉粒(图2-C),第一种着色深且形状规则的可视为有活力花粉,后一种类型可以判定为没有活力花粉,但中间类型的着色深浅则较难判别。因此,该方法可以用来测定芝麻花粉活力,但判定标准难以把握。试验中以着色深和着色浅且形状规则的花粉粒视为有活力花粉粒,测定的花粉活力为94.87%。
(4)无机酸法在芝麻花粉粒活力检测中的结果显示(图2-D),在无机酸溶液处理下,花粉粒胞质内含物喷射形成“瞬时花粉管”,是一种可行的花粉活力检测方法。但观察时间受到限制,时间过短还没有形成“瞬时花粉管”而无法观察,时间过长则花粉胞质内含物喷射过多而无法判定。因此,无机酸法可以检测芝麻花粉粒活力,但操作不方便,不是最佳选择。试验中测定的花粉活力为93.18%。
(5)MTT法在芝麻花粉粒检测中的染色效果如图2-E所示,供试花粉粒出现着色深且形状圆形或卵圆形、着色浅且形状圆形或卵圆形、不着色或着色浅且形状不规则等3种类型的花粉粒,第一种着色深且形状规则的花粉类型可视为有活力花粉,后一种类型可判定为没有活力花粉,而中间类型则难以判别。因此,该方法可以用来测定芝麻花粉活力,但判定标准难以统一把握,结果准确性存在偏差。试验中以着色深和着色浅且形状规则的花粉粒为有活力的花粉粒,测定的花粉活力为94.63%。
(6)TTC法在芝麻花粉活力检测时出现所有花粉粒着色均匀一致,如图2-F,从颜色上难以判定花粉着色差异,但花粉形状上有差异,与未作处理直接观察的方法类似,因此该方法不适合芝麻花粉粒活力检测。
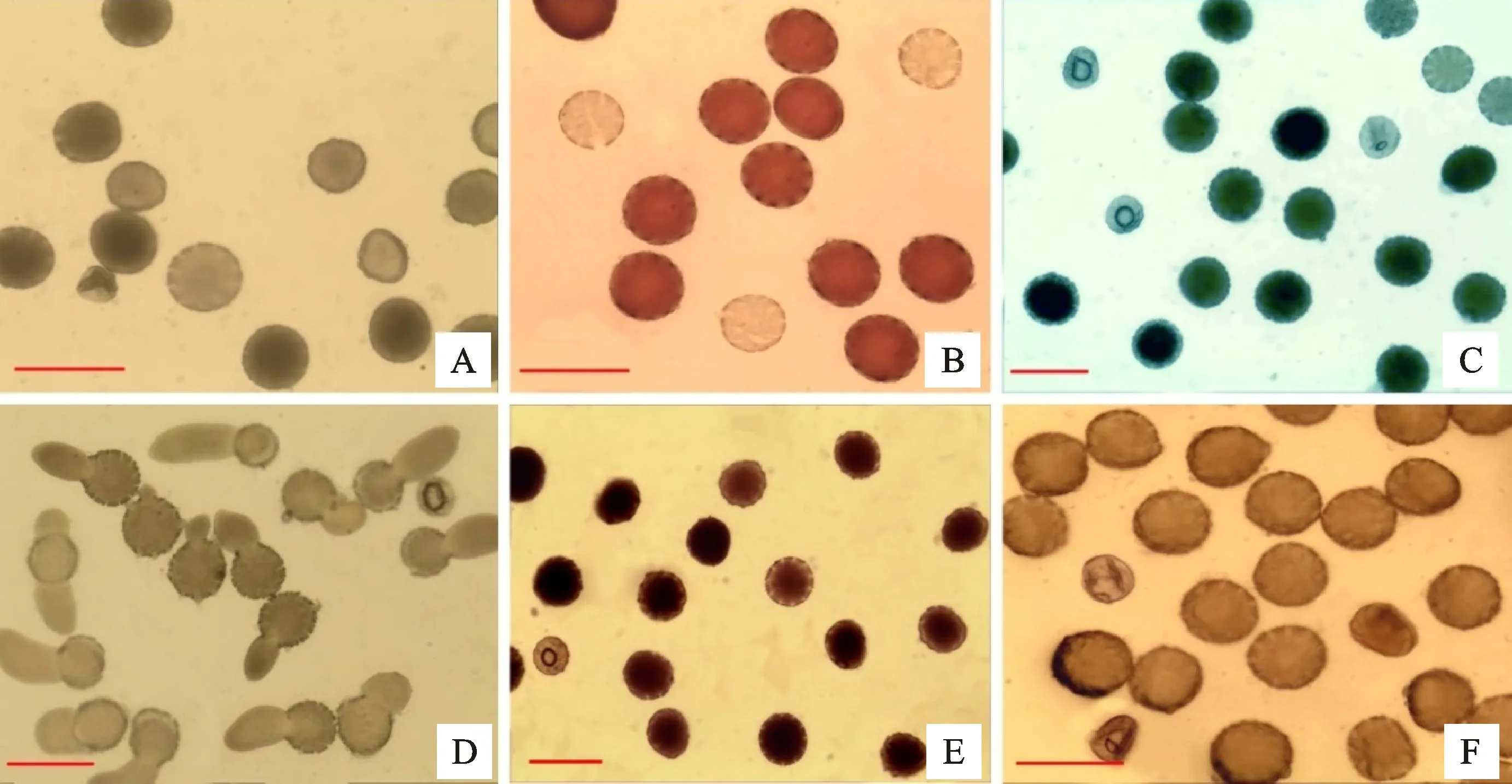
A.直接观察法;B.醋酸洋红染色法;C.I2-KI染色法;D.无机酸法;E.MTT染色法;F.TTC染色法。标尺.100 μm
(7)FDA荧光检测法在芝麻花粉活力的检测中的结果显示(图3),所有花粉粒均有荧光发出,形状明显皱缩不规则的花粉粒发射的荧光亮度比正常花粉粒偏强,可能是由于花粉壁皱缩重叠使FDA溶液蓄积偏多所致。因此,FDA荧光检测法不适合芝麻花粉粒活力的检测。
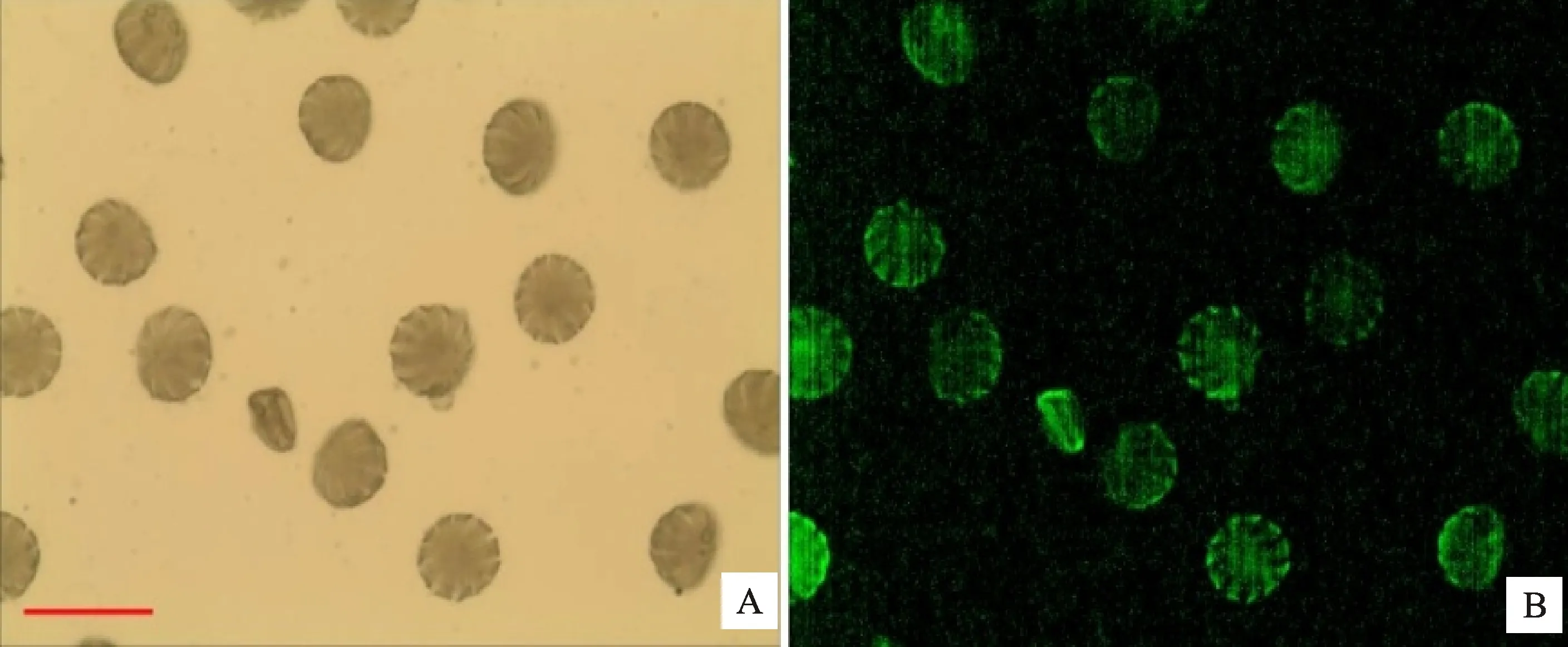
A.普通光学视野下的花粉粒;B.荧光视野下的花粉粒;标尺:100 μm
综上,直接观察法、TTC染色法和FDA荧光检测法均不能用于芝麻花粉活力的检测。在用醋酸洋红染色法、I2-KI 染色法、无机酸法和MTT染色法获得的花粉粒活力的结果分别是 93.89%、94.87%、93.18%和94.63%,数据差别不大,差异主要来自着色深浅标准的把握上。可见,以上4种方法均能用于芝麻花粉活力检测,其中,无机酸法操作不简便,I2-KI 染色法和MTT染色法存在一定的着色深浅标准的判别差异,而醋酸洋红法操作简单、判别标准明显。
2.2 芝麻花粉活力的日变化动态
盛花期的芝麻雄蕊散粉时间与温度、湿度等天气情况有关,一般温度较高的晴朗天气散粉时间较早,早晨6:00以后就开始散粉,至7:30花药已经完全裂开;空气湿度较大的阴雨天气,花药开裂散粉的时间较晚,有时延迟到9:00。选择3个晴朗的天气测定的花粉活力日变化结果显示,如图4所示,芝麻花粉活力在7:30-9:30最高,达到93.04%和92.06%,11:30后开始显著下降,从80.49%(11:30)逐渐下降到40.30%(17:30)。同时,在检测过程中发现,芝麻花粉量在7:30-9:30时最大,随后由于昆虫活动和自身散落的原因开始不断减少,11:30时花粉大量散失,13:30时花粉剩余量较少,15:30时仅在花药壁和花粉囊两端存在部分花粉,在17:30时剩余花粉数量很少,绝大部分花粉散失贻尽。而且芝麻花粉散失的时间与空气湿度、气温等关系很大,阴雨高湿天气时,17:30时花药上的花粉量依然很大。
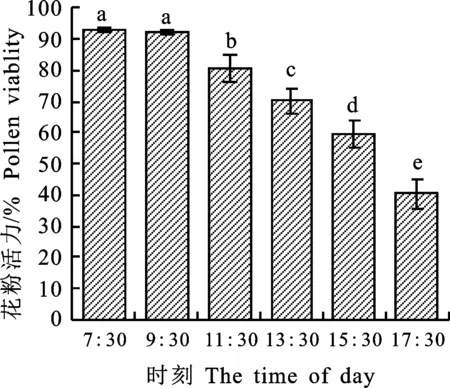
不同小写字母表示在0.05水平上的差异显著。下同
2.3 基于联苯胺-过氧化氢法测定的柱头可授性日变化动态
根据柱头与联苯胺-过氧化氢反应后出现气泡的速度和数量,以1~3级来评价芝麻柱头可授性检测日变化情况,结果如图5所示。芝麻柱头可授性总体呈先升后降的趋势,7:30时柱头已经具备较高的可授性,评分达2.77,随后继续升高至9:30的2.80,在11:30以后表现出随时间推延显著下降的趋势,由11:30的2.73下降到 13:30的2.47,随后急剧下降至15:30的1.67和17:30的1.27。发育过程中,芝麻在开花前12 h已经具备比较高的可授性,此时授粉能够有较高的结实率。另外,授粉后的芝麻柱头在下午时就开始出现不同程度的自然脱落,且受天气因素的影响较为明显。而未授粉的柱头自然脱落的时间要晚很多,当天脱落的概率较小,同样受天气影响较大。

图5 芝麻柱头可授性的日变化进程
2.4 不同时间授粉的结实率日变化动态
一般情况下,芝麻花粉在柱头萌发并成功受精发育成种子时,子房才能生长膨大发育成蒴果,而在没有花粉萌发受精或柱头没有可授性的情况下,子房不会膨大生长成蒴果,而是自然脱落。因此,结蒴率和相对结实率均与柱头可授性有直接关系。芝麻不同时间授粉的结蒴率和相对结实率的日变化结果如图6显示,芝麻的结蒴率随时间推延而不断下降,早上7:30具有最高的结蒴率(97.38%),17:30时结蒴率下降至68.51%。而相对结实率在7:30-11:30差异不明显,均处在较高状态,为91.76%~92.52%,13:30后开始显著下降,由13:30的84.46%下降到17:30的 59.37%。试验中,对开花前12 h左右,即开花前一天的17:30左右在柱头上也进行了授粉,结果发现结蒴率在71.67%,相对结实率可以达到 54.42%,这为科研中特殊情况下的应急授粉提供了参考。
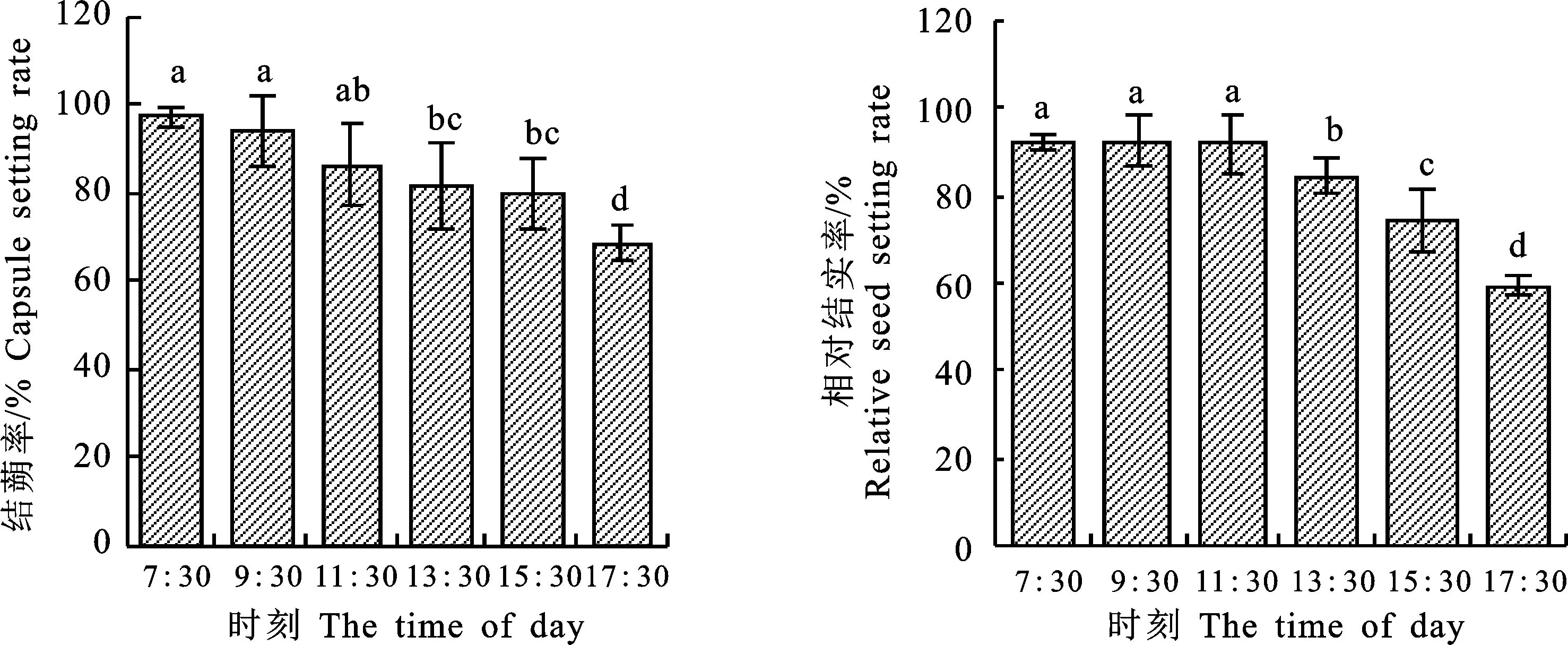
图6 芝麻不同时间授粉的结蒴率和相对结实率的日变化进程
2.5 相关分析
对花粉活力、柱头可授性、结蒴率和相对结实率的日变化数据进行了相关分析,结果显示(表1),4个指标之间的相关性均呈极显著正相关,其中柱头可授性与相对结实率的相关系数最大,达0.940。可见,本试验中测定的芝麻4个指标的日变化趋势高度一致,均随时间的推延而降低,上午是芝麻传粉受精的最佳时间。
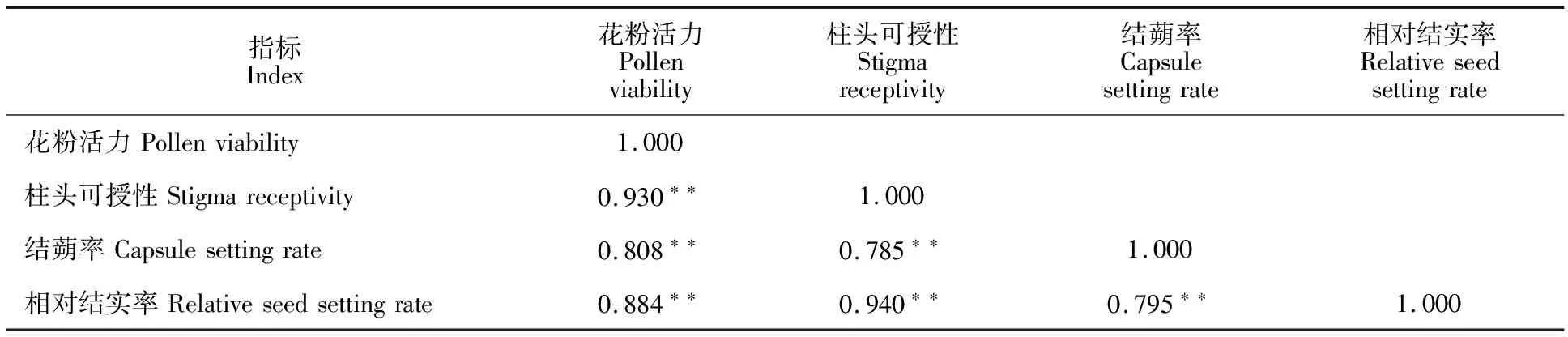
表1 芝麻4个日变化指标的相关分析结果
3 讨 论
3.1 芝麻花粉活力检测方法与日变化
植物花粉活力的测定方法很多,染色法和无机酸法等快速测定法无疑是最为简单而常用的方法。但是不同方法的检测原理不同[31-32],适用的范围也不同,不同种类植物的花粉自身结构特性和内含物也存在较大差异,因此,不同植物需要根据自身的特征特性选择合适的花粉活力检测方法[21,33-34]。在菊属植物中的研究认为I2-KI染色法、TTC染色法、无机酸法和荧光染色法都不适合其花粉活力检测[27]。苎麻的花粉活力检测方法比较研究认为,I2-KI染色法、TTC染色法和醋酸洋红染色法的检测结果不理想[35]。在玉米花粉检测时,认为I2-KI染色法不适合玉米花粉活力检测,TTC染色法最为简单、准确[36]。油菜花粉活力的检测方法研究显示,I2-KI染色法和TTC染色法测定结果可靠性低,醋酸洋红染色法是油菜花粉活力最佳的检测方法[15-16]。大花三色堇花粉活力测定研究认为,I2-KI和醋酸洋红适宜花粉活力的染色鉴定,而TTC则不能使花粉着色[37]。本研究结果显示,直接观察法、TTC染色法和FDA荧光检测法均不能用于芝麻花粉活力的检测,醋酸洋红染色法、I2-KI 染色法、无机酸法和MTT染色法等4种方法均能用于芝麻花粉活力检测,其中,无机酸法操作不简便,I2-KI 染色法和MTT染色法存在一定的着色深浅标准的判别差异,而醋酸洋红法操作简单、判别标准明显。这是因为I2-KI 和MTT染色效果受花粉壁结构、内含物含量等因素影响[22,38-39],而存在花粉粒着色深浅有差异。
不同种类植物花粉活力与寿命也完全不同,如甘蔗的花粉活力在7:00-7:30时最高,13:00后活力丧失[40];野生烟草和栽培烟草品种的花粉活力最高峰值均在13:00-15:00[2];万寿菊的花粉日变化为先升后降,11:00-13:00期间的活力最高[41]。本研究结果显示,芝麻花粉活力在 7:30-9:30最高,11:30后开始显著下降,傍晚花冠(含雄蕊)自行脱落,花粉活力基本丧失。另外,观察发现,芝麻花粉活力的日变化也受天气条件影响。该结果丰富了芝麻生殖生物学内容,为良种繁育研究提供了参考。
3.2 芝麻柱头可授性
柱头是雌蕊接受花粉的重要部位,其表面形态和生理特征影响着花粉能否成功粘附、萌发和花粉管伸长,具有可授性的柱头能够粘附花粉,并为花粉萌发和花粉管伸长生长提供物质供应[42-43]。联苯胺-过氧化氢法和直接授粉法是植物柱头可授性研究的主要方法,已经在很多植物中广泛应用[1-3,40-41]。本研究采用联苯胺-过氧化氢法测定的芝麻柱头可授性的日变化表现为先升后降,且早晨7:30时已有很高的可授性,9:30时达到最高值,11:30后开始显著下降。采用直接授粉法测得芝麻7:30时具有最高的结蒴率,7:30-11:30的相对结实率高,13:30后开始不断显著下降。联苯胺-过氧化氢法测定的柱头可授性和直接授粉法测定的结蒴率、相对结实率均呈极显著正相关,两种方法测定的结果完全一致,说明联苯胺-过氧化氢法测定的芝麻柱头可授性方法可行、结果可靠。同时,本研究认为芝麻开花后直至上午11:30均是柱头可授性最强的时期,中午后柱头可授性快速下降,且芝麻柱头在开花前 12 h左右已经具有较好的可授性,这与前人的研究结果基本一致[44]。这为芝麻繁育和种子生产中的一些技术研究提供了理论参考。
