基于直接涂抹法的基质辅助激光解吸电离飞行时间质谱鉴定常见酵母样真菌截断值的确定及验证
2020-10-27李艳君赵强元
李艳君,薛 珊,董 蓉,赵强元
解放军总医院第六医学中心 检验科,北京 100048
近年来,随着肿瘤、艾滋病等免疫受损患者的增多,免疫抑制剂及广谱抗生素的长期使用,介入治疗手段的开展,真菌感染发病率呈现上升趋势,尤其是侵袭性真菌感染,是感染性疾病死亡的主要原因之一[1-3]。真菌感染病原的快速鉴定对于临床抢先实施抗真菌治疗,降低病死率至关重要。近年来,基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption ionization timeof-flight mass spectrometry,MALDI-TOF MS) 突 破传统方法鉴定耗时长、鉴定能力不足等弊端,在临床得以广泛应用[4-6]。然而由于前处理方法不同,仪器推荐的甲酸萃取法的截断值一般不适用于常规直接涂抹法的真菌鉴定,给鉴定结果的判断带来一定困扰,因此有必要在各自实验室条件下评价适宜的真菌鉴定截断值。本研究对直接涂抹法进行酵母样真菌MALDI-TOF-MS 鉴定的截断值进行评价,详述如下。
资料与方法
1 标本来源 2018 年1 月- 2019 年6 月我中心临床送检真菌培养样本中分离培养出的酵母样真菌共计494 株。
2 仪器与试剂 德国Bruker 公司的Microflex 系列MALDI-TOF 质谱仪及配套的标准品、基质液;法国梅里埃沙保罗真菌培养基;上海一恒MJ-II 霉菌培养箱。
3 真菌分离培养 临床送检样本以三区划线方式接种于沙保罗培养基,28℃培养48 h,挑选乳酪样纯菌落进行后续实验。
4 样品制备 将纯培养菌落用牙签均匀涂抹于靶板上,加1μl 甲酸覆盖,晾干后滴加1μl 基质液,待其干燥后上机鉴定。
5 MALDI-TOF-MS 鉴定 打开Flexcontrol3.4 软件,调节仪器参数,选择377 nm 氮气激光,线性阳离子检测模式,质荷比采集范围2 000 ~ 20 000 Da,激光强度30%,每个样本击打5 个点,每点激光轰击100 次,记录鉴定结果和分值。
6 真菌18SrDNA 测序鉴定 所有菌株DNA 通过酵母菌基因组DNA 提取试剂盒进行提取,扩增引物序列为ITS1:5'-TCCGTAGGTGAACCTGCGG-3';ITS4:5'-TCCTCCGCTTATTGATATGC-3';扩增条件为95℃ 5 min,(95℃ 30 s,55℃ 30 s,72℃1 min)×30 循环,72℃ 10 min。扩增产物上机测序,序列结果登录NCBI 网站进行比对,获得菌种鉴定结果。以18SrDNA 测序鉴定结果为金标准,质谱鉴定结果与其一致时定义为鉴定正确。
7 数据分析 以质谱鉴定分值为输入数据,应用SPSS17.0 软件进行统计分析。绘制ROC 曲线,计算曲线下面积和约登指数,约登指数最大时对应的数值即为最佳截断值。应用χ2检验比较不同截断值鉴定的正确率和错误率。检验水准α=0.05。
结 果
1 MALDI-TOF MS 鉴定结果分析 与测序结果进行比对,494 株酵母样真菌中,MALDI-TOF MS 鉴定正确27 种,463 株,正确率93.7%,鉴定分值1.301 ~ 2.235,见表1,鉴定错误31 株,占比6.3%,鉴定分值1.11~1.810,见表2。

表1 463 株鉴定正确的酵母菌种类及鉴定分值Tab. 1 Classification and identification scores of 463 corrected identified yeasts
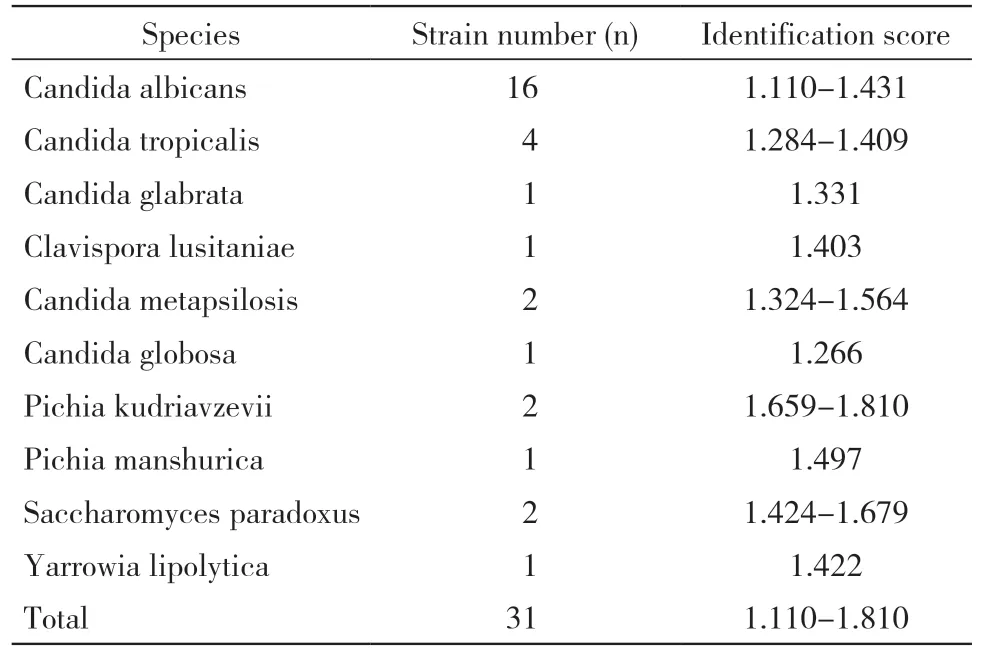
表2 31 株鉴定错误的酵母菌种类及鉴定分值Tab. 2 Classification and values of 31 uncorrected identified yeasts
2 ROC 曲线分析结果 由上述资料知,鉴定正确的分值较高,错误的相对较低,提示鉴定分值的水平分布,可能与鉴定正确程度(正确率)有关。故进一步探讨之。以鉴定正确的资料为阳性样本(n=463),以鉴定错误的资料为阴性样本(n=31),建立接收者工作特征曲线(receiver operation characteristic,ROC)诊断分析模型。并以质谱鉴定分值为数据绘制ROC 曲线。结果:酵母样真菌鉴定在不同临界值时的敏感度、特异性及约登指数见表3。鉴定分值为1.6 时约登指数最大,为0.722,其对应的敏感度为0.86,特异性为0.88,ROC 曲线下面积为0.929,见图1,故1.6 为最适宜截断值。
3 不同截断值鉴定结果的比较 经实际测试,截断值为2.0 时,鉴定正确正确率为7.5%。截断值为1.6 时鉴定正确率77.7%。经χ2检验,鉴定正确率差异有统计学意义,P <0.001,见表4。
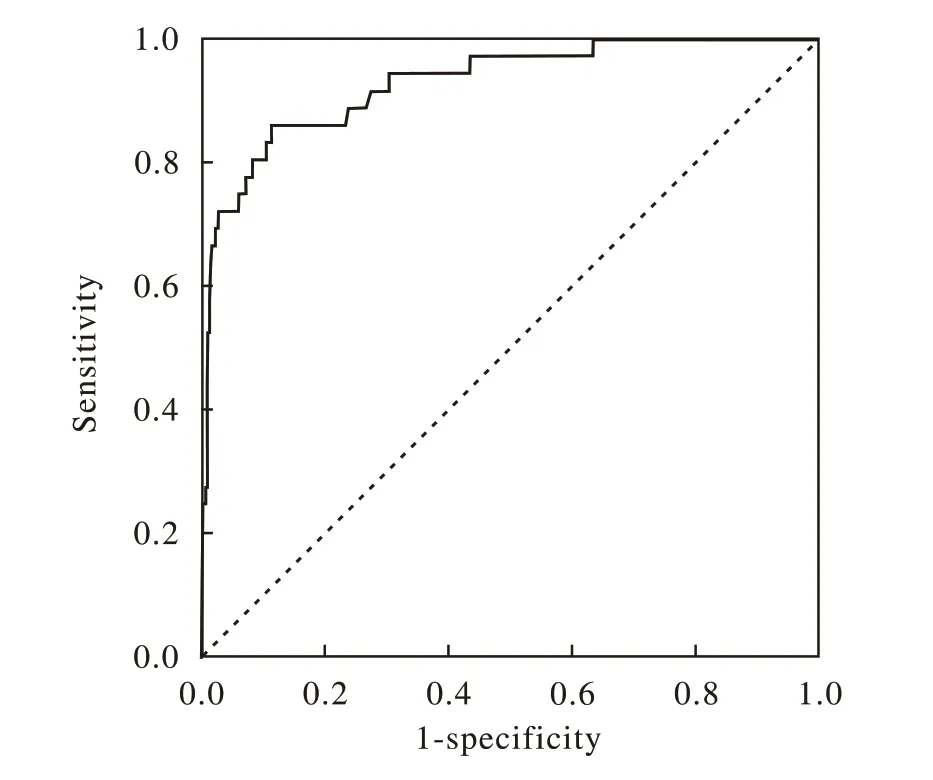
图 1 MALDI-TOF-MS鉴定酵母样真菌的ROC曲线Fig. 1 ROC curve of yeast identification using MALDI-TOF-MS
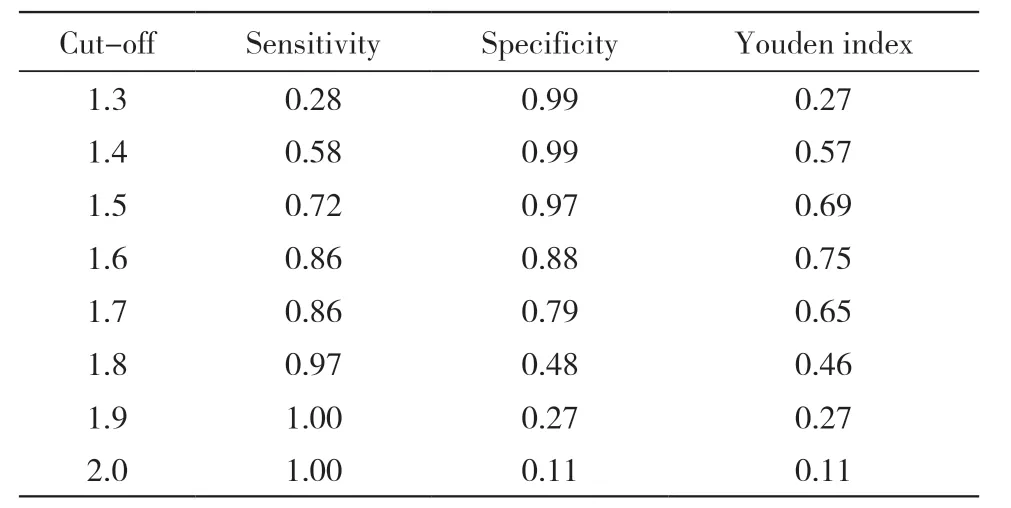
表3 不同截断值的敏感度和特异性Tab. 3 Sensitivities and specificities according to different cut-off values
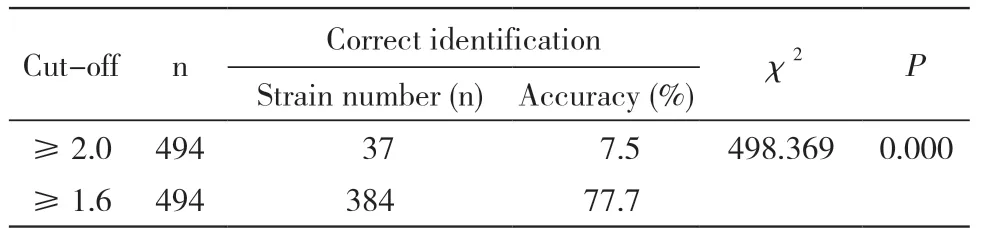
表4 不同截断值鉴定结果比较Tab. 4 Comparison of identification results with different cut-off values
讨 论
近年来随着抗生素、激素类药物及免疫抑制剂的广泛应用,免疫功能受损患者不断增加,真菌感染已成为临床抗感染治疗中较为棘手的问题[7],不同真菌对抗真菌药物的敏感度差异较大,因此在感染早期快速准确地鉴定出病原真菌的种类已经成为临床诊断和治疗的关键[8-9]。
MALDI-TOF MS 是一种新型软电离生物质谱仪,主要由两部分组成,即基质辅助激光解吸电离离子源(MALDI)和飞行时间质量分析器(TOF)。其原理是菌体蛋白在基质液作用下带电荷,在激光光源轰击下解离,带电荷的蛋白分子经电场加速,在真空飞行管中飞行,进入飞行时间质谱分析器进行质量分析,检测器检测到不同质荷比(m/z)的离子,并以离子质荷比为横坐标,以离子峰为纵坐标形成特异性的蛋白质组指纹图谱,进而与数据库中图谱进行对比,得到鉴定结果并最终确定细菌种类。MALDI-TOF MS 具有快速、准确、高通量、操作简便、成本低廉等优点,近年来越来越广泛用于临床各种感染病原的鉴定[10-12],尤其在酵母样真菌鉴定中优于传统生化反应的方法,大大提高了真菌的鉴定能力[13-16]。
对于真菌的鉴定,目前采用甲酸萃取法进行标本的前处理,通过甲酸和乙腈溶液的萃取,使菌体蛋白释放,从而获得高质量的蛋白谱峰。对于布鲁克Microflex 系列质谱仪,真菌鉴定的截断值设定在2.0 以上。然而在常规工作中,甲酸萃取法比较耗时,单个标本大约用时10 min 左右,如果日常真菌鉴定样本量较大,甲酸萃取法将不利于快速检测,并且由于酵母样真菌细胞壁较厚,即使采用甲酸萃取后检测,鉴定分值也很难达到2.0 以上,致使种水平的鉴定率较低。相对于甲酸萃取法,直接涂抹法更加简便省时,即将纯培养菌落直接涂抹于靶板上,加1μl 甲酸覆盖后再加1μl 基质液即可上机检测。国外有研究报道多中心联合进行MALDI-TOF MS 真菌鉴定流程的优化,发现与甲酸萃取法相比,直接涂抹法并未明显降低蛋白谱峰的质量,而且适当降低截断值对鉴定准确性的影响不大,且可以提高种水平的鉴定率[17-19]。
本研究对27 个菌种,494 株临床常见酵母菌,采用直接涂抹法制备样本,并对该方法的截断值进行评价。结果显示,与测序结果进行比对,直接涂抹法进行酵母样真菌的鉴定具有较高的正确率,可达93.7%。对于31 株鉴定错误的菌株,除前处理方法的影响外,还可能由于某些菌种的谱图未存在于商品化的数据库中,如库德里阿兹威氏毕赤酵母菌和奇异酵母菌,尽管鉴定分值不低,但却未得到正确的鉴定结果,对于这一类菌株的鉴定,可通过在开放的数据库中增加更多菌种的谱图来完善。
以质谱鉴定分值为数据绘制ROC 曲线,本研究确定的直接涂抹法进行酵母菌鉴定的截断值为1.6。按照原采用的甲酸萃取法截断值,鉴定分值大于2.0 为可信的种水平株鉴定结果,494 株菌中只有37 株的鉴定结果可信,采用1.6 为阈值,384株菌获得可信的鉴定结果,所以与原截断值相比,大大提高了菌种的鉴定正确率,经分析,差异有统计学意义。
综上所述,通过对494 株临床常见酵母菌鉴定数据的分析,采用直接涂抹法进行标本前处理具有较高的正确率,截断值1.6 是较为适宜的鉴定阈值,可提高酵母样真菌的鉴定率。由于不同国家、地域真菌感染类型和菌种分布不同,确定的截断值可能会有所差异,实验室可收集各自医院的临床菌株进行评估,选取适宜的截断值进行基于MALDI-TOF MS 的酵母菌的鉴定。
