生物活性多甲氧基黄酮羧酸和氨基酸衍生物的合成及其结构表征
2020-10-27李雪丽汪秋安杨1
刘 伟, 李雪丽, 汪秋安, 单 杨1,,4,*
(1.湖南省农业科学院 农产品加工研究所, 湖南 长沙 410125;2.湖南大学 研究生院 隆平分院, 湖南 长沙 410125;3.湖南大学 化学化工学院, 湖南 长沙 410082;4.果蔬贮藏加工与质量安全湖南省重点实验室, 湖南 长沙 410125)
多甲氧基黄酮(polymethoxy flavonoids,PMFs)是存在于芸香科柑橘属植物中的天然产物。目前已从柑橘属植物中分离鉴定出40余种多甲氧基类黄酮类化合物,以柑橘(CitrusreticulataBlanco)和甜橙[Citrussinensis(Linn.) Osbeck]中的含量较高。橘皮素(tangeretin)和川陈皮素(nobiletin)是多甲氧基类黄酮类的代表性化合物。
PMFs是具有平面结构和低极性的一类脂溶性黄酮化合物,具有显著的抗癌、抗炎、抗氧化和防动脉粥样硬化等广泛的生物活性[1-3]。它们对HL-60白血病细胞、乳腺肿瘤细胞、小鼠皮肤癌等多种癌细胞具有非同寻常的抗癌抗肿瘤活性。研究发现,川陈皮素在所比较的42种黄酮中显示出最强的抗增殖活性,其影响范围包括肺癌、前列腺癌、结肠癌、黑素瘤、雌激素阳性受体乳腺癌和雌激素阴性受体乳腺癌6种癌细胞[4]。橘皮素可以在人类结肠肿瘤细胞内通过抑制周期蛋白依赖性激酶 CdK2 和CdK4活动与提升CdK抑制剂 P21和P27的数量双重机制抵御癌细胞的影响。研究也表明,橘皮素在人类肺癌细胞中抑制诱导和结构性地表达环氧酶2(COX-2)来发挥抗癌作用[5]。
柑橘类果皮提取物中的多甲氧基黄酮物对促炎介质前列腺E2(PGE2)和一氧化氮含量的抑制作用显著,被视为抗炎成分的主要来源[6]。川陈皮素可以调节环氧酶2(COX-2)的活动,从而调节基质金属蛋白酶(MMP-1、MMP-3和MMP-9)和PGE2的合成,其效果表现为缓解风湿性关节炎的出现[7]。橘皮素和川陈皮素具有较强的抗亚油酸氧化作用。川陈皮素的抗过氧化和清除羟基自由基的能力最强。由于PMFs 的重要生理功能,美国Source One公司已商品化生产一种基于柑橘PMFs和棕榈果萃取物的保健品,产品名为Sytrinol,该产品具强抗氧化性并兼有抗炎症效果,该产品全球销售额每年高达数亿美元[8]。
柑橘多甲氧基黄酮类化合物在实际应用中存在水溶性差,生物利用度低的缺点。若在黄酮引入羧基这种亲水性集团, 可以增加其亲水性,使其容易被人体吸收,更容易发挥药效,生物活性提高,应用范围也得到拓宽。因此通过化学合成在黄酮结构上引入羧基制备黄酮羧酸化合物具有重要应用价值[9]。氨基酸是构成生物体蛋白质最基本的物质,亲水性强,生物相容性好,在人体内具有重要的生理性能,氨基酸可以对很多生物活性物质进行修饰[10]。黄酮氨基酸类衍生物是通过在黄酮分子中引入氨基酸对其结构进行合理的修饰和改造,使其水溶性和对肿瘤细胞的选择性和抑制活性增强,更容易被肿瘤细胞摄取,同时药物的毒性降低。Kim等[11]通过物理化学分析显示,槲皮素谷氨酸衍生物显著改善了槲皮素的溶解性、稳定性和细胞摄取能力,并证明槲皮素-氨基酸缀合物是一种安全的多药耐药性(multiple drug resistance,MDR)调节剂。Song等[12]研究结果显示,白杨素氨基酸类衍生物的抗人类肝癌和胃癌细胞的活性比母体白杨素都好。另有研究表明,麦黄酮的氨基酸类衍生物可大大提高其生物利用度[13]。
为了提高多甲氧基黄酮类化合物的水溶性和药用价值,本研究在查阅大量文献并结合实验室前期研究工作的基础上,利用橘皮素和川陈皮素作为反应原料,以较低的成本、相对简单的方法及较高的产率合成2种水溶性的多甲氧基黄酮羧酸衍生物和4种水溶性的多甲氧基黄酮氨基酸衍生物,采用多种分析测试方法对目标化合物进行了结构表征。
1 实验部分
1.1 仪器与试剂
XRC-1型显微熔点仪,北京泰克有限公司;AV-400型核磁共振仪,德国Bruker公司;1100型液-质联用仪,美国安捷伦科技有限公司;LCQ-Advantage型离子阱质谱,赛默飞世尔科技有限公司;MAT95XP型高分辨质谱,美国Finnigan公司;薄层色谱(TLC)和柱层析用硅胶,青岛海洋化工厂。
实验所用试剂均为分析纯,无水溶剂经去水和重蒸处理。
1.2 实验方法
以橘皮素和川陈皮素为原料,经过氧丙酮氧化反应、Williamson反应和羧酸与氨基酸的缩合反应,合成目标化合物,合成路线见图1。
1.2.13-羟基橘皮素(7)和3-羟基川陈皮素(8)的合成
a为过硫酸氢钾复合盐, CH2Cl2/NaHCO3/Na2CO3, 室温;b为ClCH2CO2C2H5, K2CO3, DMF, 加热; c为NaOH水溶液, CH3OH,室温;d为H2NCH2CO2CH3 或H2NCH(CHC6H5)CO2CH3, EDCI, CH2Cl2, 室温;e为①NaOH水溶液, CH3OH, 室温, ②1 mol/L HCl 水溶液, 室温。图1 多甲氧基黄酮羧酸和氨基酸衍生物的合成路线Fig.1 Synthesis route of polymethoxy flavonoids carboxylic acid and amino acid derivatives
在1 000 mL的三口烧瓶中,将橘皮素(500 mg,1.34 mmol)或川陈皮素 (500 mg, 1.2 mmol)溶于75 mLV(CH2Cl2)∶V(丙酮)=6∶5的混合溶剂中,加入100 mL弱碱性缓冲溶液 (Na2CO38.0 g,NaHCO33.80 g,水100 mL),在0 ℃下剧烈搅拌,慢慢加入w=20%过硫酸氢钾复合盐的水溶液70 mL,2 h滴完,在0 ℃冰水浴中反应15 h。然后再逐滴加入w=20%过硫酸氢钾复合盐的水溶液70 mL,2 h滴完,在0 ℃下继续反应15 h(整个反应过程维持pH=8)。TLC追踪至原料点完全消失,停止反应,反应液静置分层。水相用CH2Cl220 mL萃取3次,将其与有机相合并,加入适量无水Na2SO4对有机相进行干燥。于滤液中添加5 mg对甲苯磺酸,在室温下继续搅拌反应1 h,用紫外灯能观察到反应液的表面有一层绿色的荧光,减压蒸除反应溶剂,残留物经硅胶柱层析分离提纯[洗脱剂为V(石油醚)∶V(乙酸乙酯)=10∶1至8∶1],分别得3-羟基橘皮素淡黄色固体370 mg(产率为71%)或3-羟基川陈皮素淡黄色固体385 mg(产率为74%)。
1.2.2橘皮素-3-O-乙酸乙酯(9)的合成
称取精制的3-羟基橘皮素(500 mg,1.29 mmol)和无水碳酸钾(200 mg,1.45 mmol),置于100 mL圆底烧瓶中,加入6 mLN,N-二甲基甲酰胺(DMF),将反应混合物加热在40 ℃下搅拌反应0.5 h,再缓慢滴加氯乙酸乙酯 (1.0 g,8.16 mmol),将反应混合物在40 ℃下继续反应4 h,TLC追踪反应进程。反应结束后将反应液冷却至室温,向反应液中加入冷水,静置沉淀,将分离的固体过滤,用水洗涤并干燥,得粗产品,用硅胶柱层析进行分离提纯[洗脱剂为V(石油醚)∶V(乙酸乙酯)=4∶1],得到白色固体360 mg,产率为73%。
1.2.3川陈皮素-3-O-乙酸乙酯(10)的合成
以3-羟基川陈皮素(500 mg,1.20 mmol)为反应底物,与化合物9的合成方法相同,得到白色固体340 mg,收率为70%。
1.2.4橘皮素-3-O-乙酸(1)的合成
将化合物9(500 mg,1.05 mmol)置于100 mL圆底烧瓶中,用甲醇溶解,在室温搅拌下向混合物中滴加5% NaOH水溶液1.5 mL。将反应混合物在室温下搅拌2 h,TLC追踪反应进程,反应结束后,旋出溶剂,得到白色液体。用6 mol/L的盐酸调节液体pH至2~3,并用CH2Cl2萃取3次,合并有机相,用无水Na2SO4干燥,除去溶剂,得粗产品,用硅胶柱层析进行分离提纯[洗脱剂为V(石油醚)∶V(乙酸乙酯)=1∶1,洗脱剂中加入少量乙酸],得到白色固体370 mg,产率为78%。
1.2.5川陈皮素-3-O-乙酸(2)的合成
以化合物10(500 mg,1.13 mmol)为反应底物,与化合物1的合成方法相同,得到白色固体380 mg,产率为76%。
1.2.6橘皮素-3-O-乙酰甘氨酸甲酯(11)的合成
称取化合物1(200 mg,0.44 mmol)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)(130 mg,0.66 mmol)、4-N,N-二甲氨基吡啶(DMAP,110 mg,0.88 mmol)和甘氨酸甲酯盐酸盐(70 mg,0.53 mmol)至100 mL圆底烧瓶中混合,加入20 mL二氯甲烷,在室温条件下进行反应,TLC追踪反应进程。待反应结束后,旋除溶剂,向圆底烧瓶中缓慢倒入50 mL HCl(1 mol/L)溶液中,并用CH2Cl220 mL萃取3次,合并有机相,并用无水Na2SO4干燥,过滤后旋除溶剂,得到粗品。经硅胶柱层析分离纯化[洗脱剂为V(石油醚)∶V(乙酸乙酯)=2∶1],得白色固体210 mg,产率93%。
1.2.7川陈皮素-3-O-乙酰甘氨酸甲酯(12)的合成
以化合物2(200 mg,0.42 mmol)为反应底物,与化合物11的合成方法相同,得白色固体160 mg,产率92%。
1.2.8橘皮素-3-O-乙酰苯丙氨酸甲酯(13)的合成
称取化合物1(200 mg,0.44 mmol)、EDCI(130 mg,0.66 mmol)、4-N,N-二甲氨基吡啶(DMAP,110 mg,0.88 mmol)和苯丙氨酸甲酯盐酸盐(150 mg,0.53 mmol)至100 mL圆底烧瓶中混合,加入20 mL二氯甲烷,在室温条件下进行反应,TLC追踪反应进程。待反应结束后,旋除溶剂,向圆底烧瓶中缓慢倒入50 mL HCl(1 mol/L)溶液中,并用CH2Cl2萃取(3×20 mL)3次,合并有机相,并用无水Na2SO4干燥,过滤后旋除溶剂,得到粗品。经硅胶柱层析分离纯化[洗脱剂为V(石油醚)∶V(乙酸乙酯)= 2∶1],得到白色固体230 mg,产率87%。
1.2.9川陈皮素-3-O-乙酰苯丙氨酸甲酯(14)的合成
以化合物2(200 mg,0.42 mmol)为反应底物,与化合物13的合成方法相同,得到白色固体220 mg,产率83%。
1.2.10橘皮素-3-O-乙酰甘氨酸(3)的合成
称取化合物11(100 mg,0.19 mmol)在100 mL圆底烧瓶中溶于10 mL甲醇,滴加4 mL NaOH(1 mol/L)溶液,在室温条件下进行反应,TLC追踪反应进程。反应结束后,将反应液中溶剂旋除,加蒸馏水,然后用HCl(1 mol/L)调节pH值至2~3,放入冰箱中静置,抽滤,滤饼干燥后用无水C2H5OH进行重结晶提纯,得到白色固体90 mg,产率93%。
1.2.11川陈皮素-3-O-乙酰甘氨酸(4)的合成
以化合物12(100 mg,0.18 mmol)为反应底物,与化合物3的合成方法相同,得到白色固体89 mg,产率91%。
1.2.12橘皮素-3-O-乙酰苯丙氨酸(5)的合成
称取化合物13(100 mg,0.16 mmol)在100 mL圆底烧瓶中溶于10 mL甲醇,滴加4 mL NaOH(1 mol/L)溶液,在室温条件下进行反应,TLC追踪反应进程。反应结束后,将反应液中溶剂旋除,加蒸馏水,然后用HCl(1 mol/L)调节pH值至2~3,放入冰箱中静置,抽滤,滤饼干燥后用无水C2H5OH进行重结晶提纯,得到黄色固体84 mg,产率86%。
1.2.13川陈皮素-3-O-乙酰苯丙氨酸(6)的合成
以化合物14(100 mg,0.16 mmol)为反应底物,与化合物5的合成方法相同,得黄色固体86 mg,产率88%。
1.3 结构测定
对所合成化合物的结构都通过核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)、质谱进行表征。
2 结果与讨论
2.1 合成方法的优化
以橘皮素和川陈皮素为原料,首先进行过氧丙酮(DMDO)氧化反应,分别得到3-羟基橘皮素(7)和3-羟基川陈皮素(8),在该步氧化反应中,应保持反应体系的pH=8,给反应提供一个弱碱性环境,在此条件下,丙酮和过硫酸氢钾复合盐制备过氧丙酮。制备过氧丙酮的过程中,需在低温下进行,最好是0~5 ℃,主要是因为在室温下过氧丙酮不能稳定存在,当温度高于40 ℃时会发生分解。滴加过硫酸氢钾复合盐时,其滴加速度也不宜过快,若滴加太快,会造成过氧丙酮的生成速率比环氧化速率大很多,使新生成的过氧丙酮与橘皮素或川陈皮素反应不充分,因而浪费原料。本文参考了有关文献并结合Han等[14]的方法,确定以N,N-二甲基甲酰胺(DMF)做溶剂,先加入碳酸钾混合加热搅拌反应0.5 h左右,以便形成酚氧负离子,然后再缓慢滴加氯乙酸乙酯进行Williamson反应,制得的多甲氧基黄酮羧酸酯类衍生物在碱性条件下室温搅拌水解即可得到多甲氧基黄酮羧酸类衍生物1和2。
氨基酸既含有氨基又含有羧基,两基团相互影响使得其几乎不溶于有机溶剂,对反应条件要求较高,普通酰化反应在反应活性及后期产物的提纯等方面受到诸多限制。因此,采用氨基酸甲酯盐酸盐与多甲氧基黄酮羧酸衍生物进行缩合反应,将氨基酸中的羧基变成酯基进行保护,最后水解去保护得到目标化合物。对氨基酸中的羧基进行保护也避免了其自身的缩合反应,减少副产物的生成,提高了中间产物多甲氧基黄酮氨基酸甲酯类化合物的产率。在选择缩合剂时,通过查阅文献[15]发现DCC虽然价格便宜,但作为缩合剂与氨基酸甲酯反应时,很难除尽其副产物N,N-二环己基脲(DCU);而用EDCI作缩合剂,其副产物1-乙基-3-(3-二甲基氨基丙基)脲(EDU)为水溶性的,水洗即可除去。反应产率较高[16]。因此,综合各方面因素,本研究采用EDCI作缩合剂,4-二甲氨基吡啶(DMAP)作为辅助试剂,二氯甲烷作溶剂来进行缩合反应制备多甲氧基黄酮氨基酸甲酯类化合物11至化合物14。使用具有亲核性的DMAP作为辅助试剂,可以转移酰基,减少副反应的发生,缩短反应时间,提高反应收率。
最后在水解制备目标化合物的过程中,采用碱性条件进行水解,但是化合物11至化合物14既含有羧酸酯键又含有酰胺键,想要合成多甲氧基黄酮氨基酸衍生物就需要控制好实验条件。研究中发现在室温条件下,pH保持在10~11进行水解可以使酰胺键保留而酯键水解。因此,多甲氧基黄酮氨基酸甲酯类化合物水解的条件对目标产物的合成及收率有直接影响,要严格进行规范的操作来合成多甲氧基黄酮氨基酸衍生物3至6。
2.2 化合物的结构表征
对所合成化合物的结构通过1H NMR、13C NMR、质谱的方法进行了表征。以化合物川陈皮素-3-O-乙酰甘氨酸(4)为例,高分辨质谱(EI-HRMS) 测得分子离子峰为533.152 8,查拜隆表可知分子式为C25H27O12N,与实际分子式符合。
1H NMR (400 MHz, DMSO-d6)谱图解析:化学位移(δ)值为8.93处,积分面积为1,耦合常数为5.7 Hz的三重峰为酰胺键上的氢;化学位移为7.77处,积分面积为1,耦合常数为8.5和1.7 Hz的dd峰为黄酮B环6′位上的氢;化学位移为7.65处,积分面积为1耦合常数为1.6 Hz的双重峰为B环2′位上的氢;化学位移为7.05处,积分面积为1,耦合常数为8.6 Hz的双重峰为B环5′位上的氢;化学位移为4.38处,积分面积为2的单峰为与氧相连的亚甲基上的氢;化学位移为4.14和4.02处,两个积分面积均为3的单峰为B环3′位和4′位上甲氧基的氢;化学位移为4.23处,积分面积为2,耦合常数为5.5 Hz的双重峰为与羧基相连的亚甲基上的氢;化学位移为4.00, 3.99, 3.98,3.97处,积分面积均为3的4个单峰为黄酮A环5位、6位、7位及8位上甲氧基的氢。由以上的氢谱分析可知,谱图中氢的积分面积及化学位移值与预测川陈皮素-3-O-乙酰甘氨酸的氢谱相一致。
13C NMR (101 MHz, DMSO-d6) 谱图分析。化学位移(δ)值为172.66处是羧基碳的特征峰,化学位移值为171.41处是酰胺基碳的特征峰,化学位移值为169.53处是黄酮中羰基碳的特征峰,化学位移值为153.34, 151.55, 148.98, 147.83, 146.71, 143.91, 138.65, 137.91, 122.65, 122.05, 114.70, 112.17, 111.51处是芳香碳的信号峰,化学位移值为70.22处是与氧相连的亚甲基碳的信号峰,化学位移值为62.44, 62.28, 62.03, 61.90, 56.10,55.93处是6个甲氧基的信号峰,化学位移值为40.87处是与羧基相连的亚甲基碳的信号峰。由以上的碳谱分析可知,谱图中碳的化学位移值与预测的川陈皮素-3-O-乙酰甘氨酸的碳谱相一致。
2.2.1橘皮素-3-O-乙酸(1)的表征
白色固体,产率为78%,熔点为120~122 ℃。1H NMR (400 MHz, CDCl3)δ8.03 (d,J=8.4 Hz, 2H, 2′-H 和 6′-H), 6.99 (d,J=8.4 Hz, 2H, 3′-H和5′-H), 4.27 (s, 2H, OCH2), 4.06(s, 3H, OCH3), 3.93(s, 3H, OCH3), 3.89(s, 3H, OCH3), 3.88(s, 3H, OCH3), 3.84(s, 3H, OCH3)。13C NMR (100 MHz, CDCl3)δ176.94, 175.48, 171.13, 162.39, 155.53, 152.46, 148.12, 144.52, 140.12, 137.81, 130.30, 121.60, 114.63, 113.54, 72.17, 62.45, 62.16, 61.85, 61.73, 55.55。MS(ESI) m/z 469.0[M+Na]+。核磁谱图见图2。
图2 橘皮素-3-O-乙酸(1)核磁图谱Fig.2 NMR spectra of tangerine-3-O-acetic acid (1)
2.2.2川陈皮素-3-O-乙酸(2)的表征
白色固体,产率为76%,熔点为150~152 ℃。1H NMR (400 MHz, CDCl3)δ7.74 (d,J=8.5 Hz, 1H, 6′-H), 7.62 (s, 1H, 2′-H), 6.97 (d,J=8.5 Hz, 1H, 5′-H), 4.30 (s, 2H, OCH2), 4.06(s, 3H, OCH3), 3.94(s, 3H, OCH3), 3.92(s, 3H, OCH3), 3.90 (s, 6H, 2OCH3), 3.89 (s, H, OCH3)。13C NMR (100 MHz, CDCl3)δ175.62, 170.42, 155.40, 152.60, 152.21, 149.25, 148.24, 146.85, 144.63, 140.42, 137.75, 122.65, 121.71, 113.48, 111.34, 110.75, 72.62, 62.49, 62.10, 61.87, 61.76, 56.13, 56.07。MS(ESI) m/z 499.0[M+Na]+。核磁谱图见图3。
图3 川陈皮素-3-O-乙酸(2)核磁图谱Fig.3 NMR spectra of nobiletin-3-O-acetic acid (2)
2.2.3橘皮素-3-O-乙酰甘氨酸(3)的表征
白色固体,产率93%,熔点为146~148 ℃。1H NMR (400 MHz, DMSO-d6)δ8.51 (t,J=5.7 Hz, 1H, CONH), 8.11 (d,J=8.4 Hz, 2H, 2′-H和6′-H), 7.15 (d,J=8.4 Hz, 2H, 3′-H和5′-H), 4.46 (s, 2H, OCH2), 4.03(s, 3H, OCH3), 3.95(s, 3H, OCH3), 3.88 (d,J=5.6 Hz, 2H, CH2COOH), 3.86(s, 3H, OCH3), 3.85(s, 3H, OCH3), 3.82 (s, 3H, OCH3)。13C NMR (100 MHz, DMSO-d6)δ172.74, 171.44, 168.60, 161.75, 153.53, 151.50, 147.83, 146.72, 143.93, 138.77, 137.98, 130.41, 122.66, 114.84, 114.76, 70.49, 62.44, 62.32, 62.03, 61.90, 55.90, 40.90。MS (EI) m/z 503.2 [M]+。HRMS (EI) m/z [M+] calcd for C24H25O11N 503.142 8, found 503.140 8。核磁谱图见图4。
图4 橘皮素-3-O-乙酰甘氨酸(3)核磁图谱Fig.4 NMR spectra of tangerine-3-O-acetylglycine (3)
2.2.4川陈皮素-3-O-乙酰甘氨酸(4)的表征
白色固体,产率91%,熔点为150~152 ℃。1H NMR (400 MHz, DMSO-d6)δ8.93 (t,J=5.4 Hz, 1H,CONH), 7.77 (dd,J=8.5, 1.7 Hz, 1H,H-6′ ), 7.65 (d,J=1.6 Hz, 1H,2′-H), 7.05 (d,J=8.6 Hz, 1H, 5′-H), 4.38 (s, 2H, OCH2), 4.23 (d,J=5.5 Hz, 2H, NCH2), 4.14 (s, 3H, OCH3), 4.02 (s, 3H, OCH3), 4.00 (s, 3H, OCH3), 3.99 (s,3H, OCH3), 3.98 (s, 3H, OCH3), 3.97 (s, 3H, OCH3)。13C NMR (100 MHz, DMSO-d6)δ172.66, 171.41, 168.53, 153.34, 151.55, 148.98, 147.83, 146.71, 143.91, 138.65, 137.91, 122.65, 122.05, 114.70, 112.17, 111.51, 70.22, 62.44, 62.28, 62.03, 61.90, 56.10, 55.93, 40.87。MS (EI) m/z 533.2 [M]+。HRMS (EI) m/z [M+] calcd for C25H27O12N 533.153 3, found 533.152 8。核磁谱图见图5。
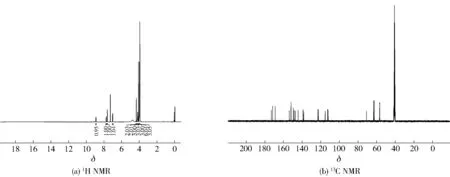
图5 川陈皮素-3-O-乙酰甘氨酸(4)核磁图谱Fig.5 NMR spectra of nobiletin-3-O-acetylglycine (4)
2.2.5橘皮素-3-O-乙酰苯丙氨酸(5)的表征
黄色固体,产率86%,熔点为170~172 ℃。1H NMR (400 MHz, DMSO-d6)δ12.68 (s, 1H, COOH), 8.50 (d,J=8.0 Hz, 1H, CONH), 8.07 (d,J=8.6 Hz, 2H, 2′-H 和6′-H), 7.31-7.19 (m, 5H, C6H5), 7.09 (d,J=8.6 Hz, 2H, 3′-H和5′-H), 4.61~4.56 (m, 1H, CH), 4.42 (s, 2H, OCH2), 4.04 (s, 3H, OCH3), 3.95 (s, 3H, OCH3), 3.87 (s, 3H, OCH3), 3.86 (s, 3H, OCH3), 3.85 (s, 3H, OCH3), 3.17 (dd,J=
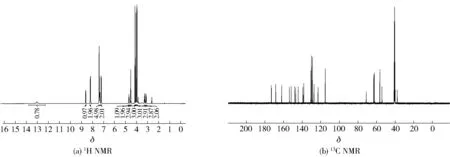
图6 橘皮素-3-O-乙酰苯丙氨酸(5)核磁图谱Fig.6 NMR spectra of tangerine-3-O-acetylphenylalanine (5)
2.2.6川陈皮素-3-O-乙酰苯丙氨酸(6)的表征

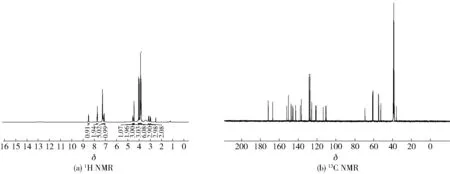
图7 川陈皮素-3-O-乙酰苯丙氨酸(6)核磁图谱Fig.7 NMR spectra of nobiletin-3-O-acetylphenylalanine (6)
2.2.73-羟基橘皮素(7)的表征
淡黄色固体,产率71%,熔点为130~132 ℃。1H NMR (400 MHz,CDCl3)δ8.25 (d,J=9.1 Hz, 2H, 2′-H和6′-H), 7.31 (s, 1H, 3-OH), 7.06 (d,J=9.1 Hz, 2H, 3′-H和5′-H), 4.13 (s, 3H), 4.04 (s, 3H), 3.99 (s, 3H), 3.96 (s, 3H), 3.90 (s, 3H)。13C NMR (100 MHz, CDCl3)δ170.83, 159.85, 150.53, 146.50, 145.85, 142.45, 142.23, 136.86, 136.22, 128.06, 122.56, 113.11, 110.70, 61.30, 61.00, 60.83, 60.67, 54.36。HRMS (EI) m/z [M+] calcd for C20H20O8388.115 8, found 388.114 6。数据与文献[17]报道基本一致,确证为3-羟基橘皮素。核磁谱图见图8。
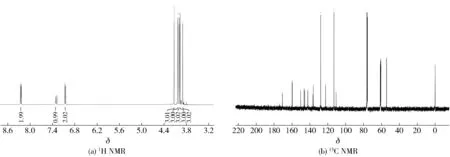
图8 3-羟基橘皮素(7)核磁图谱Fig.8 NMR spectra of 3-hydroxytangerine (7)
2.2.83-羟基川陈皮素(8)的表征
淡黄色固体,产率74%,熔点为160~162 ℃。1H NMR (400 MHz,CDCl3)δ12.31(s, 1H, 3-OH), 7.77 (dd,J=8.6和1.8 Hz, 1H, 6′-H), 7.72 (d,J=1.6 Hz, 1H, 2′-H), 6.94 (d,J=8.6 Hz, 1H, 5′-H), 4.03 (s, 3H), 3.90 (s, 3H), 3.89 (s, 3H), 3.88 (s, 3H), 3.87 (s, 3H)。13C NMR (100 MHz, CDCl3)δ178.24, 154.79, 151.87, 150.55, 148.13, 147.82, 143.84, 137.72, 135.12, 131.77, 121.98, 121.33, 110.08, 110.00, 106.43, 61.02, 60.70, 60.13, 59.10, 55.00, 54.91。MS (m/z, EI) 418 (M+), 403 (100), 373, 357, 345, 317, 289, 273, 233, 211, 183, 165, 149, 137, 92, 77, 57。HRMS (EI) m/z [M+] calcd for C21H22O9418.126 4, found 418.125 4。数据与文献[17-18]报道基本一致,确证为3-羟基川陈皮素。核磁谱图见图9。
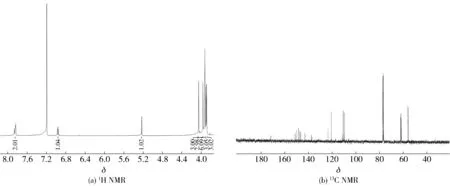
图9 3-羟基川陈皮素(8)核磁图谱Fig.9 NMR spectra of 3-hydroxynobiletin (8)
2.2.9橘皮素-3-O-乙酸乙酯(9)的表征
白色固体,产率为73%,熔点为120~122 ℃。1H NMR (400 MHz, CDCl3)δ8.19 (d,J=8.4 Hz, 2H, 2′-H和6′-H), 6.96 (d,J=8.4 Hz, 2H, 3′-H和5′-H), 4.77 (s, 2H, OCH2), 4.10 (q,J=6.9 Hz, 2H, CH2), 4.02(s, 3H, OCH3), 3.93(s, 3H, OCH3), 3.89(s, 3H, OCH3), 3.87(s, 3H, OCH3), 3.82 (s, 3H, OCH3), 1.15 (t,J=7.0 Hz, 3H, CH3)。13C NMR (100 MHz, CDCl3)δ172.34, 168.09, 160.49, 152.39, 150.30, 147.06, 145.64, 142.87, 137.59, 136.85, 129.42, 122.07, 113.86, 112.94, 67.10, 61.26, 61.02, 60.72, 59.89, 54.38, 13.10。核磁谱图见图10。
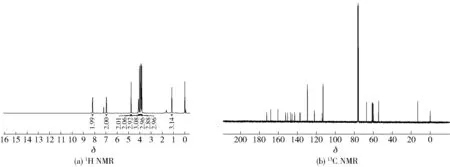
图10 橘皮素-3-O-乙酸乙酯(9)核磁图谱Fig.10 NMR spectra of tangerine-3-O-ethyl acetate (9)
2.2.10川陈皮素-3-O-乙酸乙酯(10)的表征
白色固体,收率为70%,熔点为116~118 ℃。1H NMR (400 MHz, CDCl3)δ7.88 (s, 1H, 2′-H), 7.85 (d,J=8.7 Hz, 1H, 6′-H), 6.93 (d,J=8.4 Hz, 1H, 5′-H), 4.75 (s, 2H, OCH2), 4.10 (q,J=6.8 Hz, 2H, CH2), 4.02(s, 3H, OCH3), 3.93(s, 3H, OCH3), 3.91(s, 3H, OCH3), 3.88 (s, 6H, 2OCH3), 3.86 (s, 3H, OCH3), 1.15 (t,J=6.9 Hz, 3H, CH3)。13C NMR (100 MHz, CDCl3)δ172.31, 167.92, 152.12, 150.37, 150.14, 147.61, 147.07, 145.60, 142.89, 137.65, 136.78, 122.17, 121.19, 113.79, 110.54, 109.77, 67.08, 61.25, 60.95, 60.80, 60.64, 59.91, 54.93, 13.11。核磁谱图见图11。
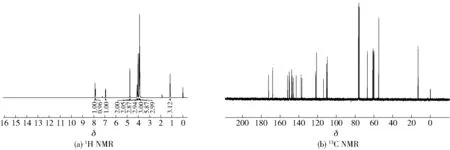
图11 川陈皮素-3-O-乙酸乙酯(10)核磁图谱Fig.11 NMR spectra of nobiletin-3-O-ethyl acetate (10)
2.2.11橘皮素-3-O-乙酰甘氨酸甲酯(11)的表征
白色固体,产率93%,熔点为110~112 ℃。1H NMR (400 MHz, CDCl3)δ8.81 (t,J=5.7 Hz, 1H, CONH), 7.96 (d,J=8.2 Hz, 2H, 2′-H和6′-H), 6.97 (d,J=8.2 Hz, 2H, 3′-H和5′-H), 4.26 (s, 2H, OCH2), 4.09 (d,J=5.6 Hz, 2H, CH2COOCH3), 4.03 (s, 3H, OCH3), 3.91 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 3.87 (s, 3H, OCH3), 3.82 (s, 3H, OCH3), 3.69 (s, 3H, CH3)。13C NMR (100 MHz, CDCl3)δ173.98, 169.98, 169.53, 161.93, 154.43, 151.73, 148.20, 146.84, 144.10, 139.97, 137.91, 130.02, 122.25, 114.56, 114.52, 72.37, 62.32, 62.05, 61.83, 61.67, 55.48, 52.20, 40.93。核磁谱图见图12。
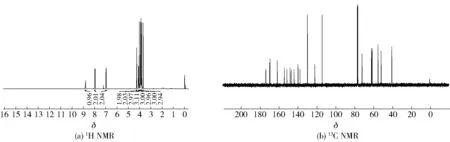
图12 橘皮素-3-O-乙酰甘氨酸甲酯(11)核磁图谱Fig.12 NMR spectra of tangerine-3-O-acetylglycine methyl ester (11)
2.2.12川陈皮素-3-O-乙酰甘氨酸甲酯(12)的表征
白色固体,产率92%,熔点为122~124 ℃。1H NMR (400 MHz, CDCl3)δ8.82 (t,J=5.7 Hz, 1H, CONH), 7.67 (d,J=8.5 Hz, 1H, 6′-H), 7.55 (s, 1H, 2′-H), 6.95 (d,J=8.6 Hz, 1H, 5′-H), 4.28 (s, 2H, OCH2), 4.09 (d,J=5.7 Hz, 2H, CH2COOCH3), 4.03 (s, 3H, OCH3), 3.93 (s, 3H, OCH3), 3.90 (s, 3H, OCH3), 3.88 (s, 3H, OCH3), 3.69 (s, 3H, CH3)。13C NMR (100 MHz, CDCl3)δ172.97, 168.96, 168.45, 153.22, 150.79, 150.63, 148.16, 147.23, 145.79, 143.12, 139.04, 136.82, 121.39, 121.21, 113.51, 110.29, 109.69, 71.39, 61.31, 60.98, 60.82, 60.68, 55.05, 55.02, 51.20, 39.90。核磁谱图见图13。
2.2.13橘皮素-3-O-乙酰苯丙氨酸甲酯(13)的表征

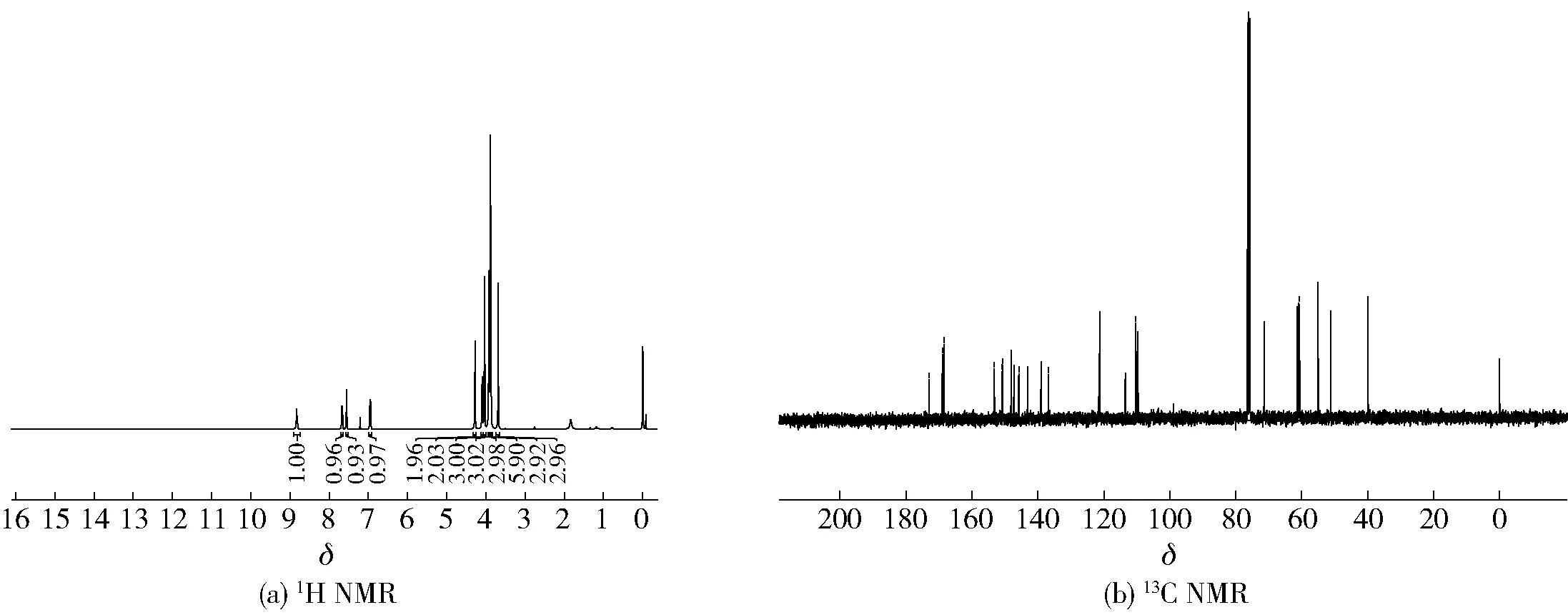
图13 川陈皮素-3-O-乙酰甘氨酸甲酯(12)核磁图谱Fig.13 NMR spectra of nobiletin-3-O-acetylglycine methyl ester (12)
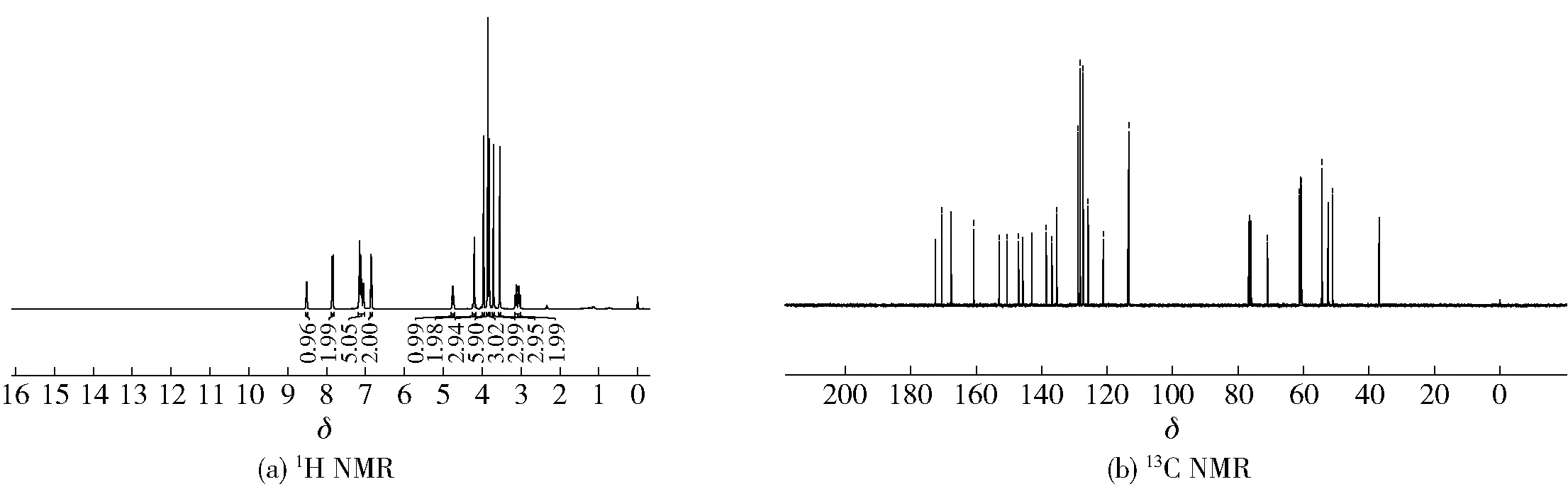
图14 橘皮素-3-O-乙酰苯丙氨酸甲酯(13)核磁图谱Fig.14 NMR spectra of tangerine-3-O-acetylphenylalanine methyl ester(13)
2.2.14川陈皮素-3-O-乙酰苯丙氨酸甲酯(14)的表征

3 结 论
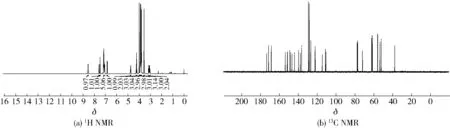
图15 川陈皮素-3-O-乙酰苯丙氨酸甲酯(14)核磁图谱Fig.15 NMR spectra of nobiletin-3-O-acetylphenylalanine methyl ester(14)
以柑橘多甲氧基黄酮橘皮素和川陈皮素为原料,分别经过氧丙酮氧化得到2种多甲氧基黄酮醇(化合物7和化合物8),化合物7和化合物8分别与氯乙酸乙酯进行Williamson反应,生成的多甲氧基黄酮羧酸酯类衍生物,然后在碱性条件下水解,合成了2种未见文献报道的多甲氧基黄酮羧酸衍生物(化合物1和化合物2)。以这2种橘皮素和川陈皮素羧酸衍生物为原料,以二氯甲烷作溶剂、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)为缩合剂、4-N,N-二甲氨基吡啶(DMAP)为辅助剂的条件下,分别与两种不同的氨基酸甲酯盐酸盐发生缩合反应,合成得到橘皮素和川陈皮素的氨基酸甲酯衍生物,再经水解反应,合成了4种水溶性的多甲氧基黄酮氨基酸衍生物(化合物3至化合物6)。并对所合成的化合物进行了结构表征。该合成方法原料易得、工艺简便、收率较高,具有较高的实用价值。
