大豆肽对果蝇睡眠的影响
2020-10-27易国富刘新旗尹利端
易国富, 张 健, 李 赫, 刘新旗,*, 尹利端
(1.北京工商大学 北京市食品添加剂工程技术研究中心/北京食品营养与人类健康高精尖创新中心/食品与健康学院, 北京 100048; 2.烟台新时代健康产业有限公司, 山东 烟台 264006)
人类三分之一的时间是在睡眠中度过的,睡眠是人体的一种主动过程,可以恢复精神和解除疲劳。充足的睡眠、均衡的饮食和适当的运动,是国际社会公认的三项健康标准。目前全球有三分之一的人患有睡眠障碍[1]。据2019年3月21日“世界睡眠日”的报道,我国目前约有38.5%的人患有睡眠障碍,并且睡眠障碍人群中女性是男性的1.5~2.0倍,而40%~70%的老年人患有睡眠障碍[2]。中国已经步入老龄化社会,研究报道老年人相较于年轻时候,其消化和吸收的蛋白酶下降了30%~50%[3-4],而作为宏观营养素的蛋白质在人体承担着各种生理活性的调节作用,其摄入不足容易引起人体“负氮平衡”,最终导致各种常见的老年人健康问题,如睡眠障碍、记忆力下降、肌肉萎缩、免疫力下降等[5-9]。
大豆蛋白质是优质蛋白质,其所含的必需氨基酸种类齐全、比例适当,经过蛋白酶水解或微生物发酵,再经过超滤膜分离和喷雾干燥等工艺处理得到肽的混合物,其平均分子质量分布低于1 000 Da[10]。大豆肽(soybean peptides, SBP)相较于大豆蛋白和游离氨基酸,在提供氨基酸方面具有吸收速度快、载体不饱和、易溶于水、无抗原性、生物活性高等特点[11]。生物活性肽具有抗氧化、降血压、减脂、免疫调节、降糖、抗癌等功能特性,是目前研究的一个热点[12-13]。
自Morgan首创性地在遗传学上研究果蝇[14],如今,果蝇已成为遗传学研究的新宠。与其他模式生物相比,果蝇易繁殖、操作便捷、生命周期短(25 ℃,40~60 d),且果蝇的基因与人类的基因同源性高达80%[15]。果蝇在20 d以后,表现出老年人的睡眠特征[16],因此,利用果蝇遗传学的优势,在20 d时研究果蝇的睡眠对老年人睡眠具有重要的参考意义。果蝇睡眠的调控是通过生物钟系统和神经递质系统协同作用完成的[17]。目前,研究报道了果蝇的十多个生物钟基因,其中period(per)、timeless(tim)、clock(clk)、cycle(cyc)4个为核心的钟基因[18]。调控睡眠的神经递质,主要有促进睡眠的γ-氨基丁酸(GABA)、五羟色胺(5-HT),促进觉醒的谷氨酸(Glu)和组胺(His)[19-21],以及果蝇脑内GABA的限速酶——谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)、5-HT的限速酶——色氨酸羟化酶(tryptophan hydroxylase,TPH)、Glu的限速酶——谷氨酸脱氢酶(glutamic dehydrogenase,GDH)、His的限速酶——组氨酸脱羧酶(histidine decarboxylase,HDC)[22]。
本研究以果蝇为实验模型,采用动物行为分析系统监测SBP对20日龄雄性处女果蝇睡眠行为的影响,并检测SBP对生物钟基因(per、tim、clk、cyc)与参与调控睡眠神经递质合成限速酶的基因(gad、tph、gdh、hdc)的影响,旨在探索SBP对老年果蝇睡眠营养干预的影响。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,山东御馨生物科技有限公司;碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg),上海源叶生物科技有限公司;野生型Canton S品系黑腹果蝇(Drosophilamelanogaster),北京大学生命科学学院;TRIzol试剂,美国Life Technologies公司;M-MLV逆转录酶试剂盒,美国Progema公司;5-HT ELISA试剂盒,中国江莱生物;SYBR Green Mix PCR试剂盒,赛默飞世尔(中国)公司。
1.2 仪器与设备
人工气候培养箱,德国Binder公司;VideoTrack动物行为分析系统,法国Viewpoint公司;Milli- Q Integral 5型纯水仪,美国Millipore公司;Alpha1- 2LD型冷冻干燥机,德国Christ公司;LightCycler96型RT-qPCR仪,瑞士Roche公司;LC20A液相(色谱柱为TSK-GEL G2000SWXL,(7.8 mm×300 mm×5 μm)),日本Shimadzu公司;0.22 μm陶瓷微滤膜、2 000 Da超滤膜,江苏久吾高科技股份有限公司;YXQ- LS- 75SⅡ型高压灭菌器,上海博讯实业有限公司;Infinite 200 Pro Nanoquant型酶标仪,瑞士Tecan公司。
1.3 实验方法
1.3.1SBP的制备
配置w=2%大豆分离蛋白(soybean protein isolate,SPI)水溶液,按照4 000 U/g的加酶量添加酶,分别添加碱性蛋白酶和中性蛋白酶,反应温度55 ℃、pH值为7、反应时间4 h。然后在温度85 ℃的条件下灭活15 min,用陶瓷微滤膜和超滤膜过滤,在40 ℃、60 MPa条件下过滤,得到的滤液在-40 ℃、压强12 Pa、时长30 h的条件下冷冻干燥,得到SBP。SBP的制备过程见图1。
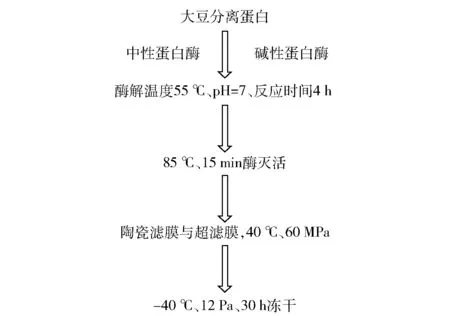
图1 大豆肽的制备流程Fig.1 Preparation process of soybean peptides
1.3.2SBP分子量分布的测定
通过凝胶过滤色谱法在LC20A上进行测量。使用的色谱柱为TSK-GEL G2000SWXL(300 mm×7.8 mm×5 μm)。制备的肽质量浓度为1 mg/mL,所有用于测量分子量的标准品质量浓度均为1 mg/mL。进样前,样品和标准品均通过0.22 μm过滤器过滤。进样量为20 μL,流动相V(水)∶V(乙腈)∶V(三氯乙酸)= 80∶20∶0.1,流速为0.5 mL/min,检测波长为220 nm。
1.3.3果蝇基础培养基的配置
将培养瓶和指管清洗干净,与橡胶塞一同放入灭菌锅中灭菌,温度120 ℃,时间30 min。冷却后在紫外灯下照射30 min。在5 L的电饭煲中首先加入蒸馏水1.65 L,加入蔗糖31.62 g、葡萄糖63.24 g、酵母32.19 g、琼脂10.6 g,并不断搅拌升温煮沸,加入玉米粉77.7 g,再煮15~20 min,保温15 min(保温13 min时加入山梨酸钾2 g,无水氯化钙0.726 g),充分搅匀,并将其通过食物注入枪注入指管中,每个指管装6.5 mL,在紫外灯下照射30 min;注入培养瓶中,每个培养瓶25 mL,在紫外灯下照射30 min。然后盖上橡胶塞,并放在4 ℃的冰箱中待用[23]。
1.3.4果蝇的睡眠监控
取20日龄雄性果蝇在二氧化碳麻醉台上麻醉后,分为4组,每组32只,其中一组为空白组,另外3组添加2、4、8 mg/mL的大豆低聚肽。剂量设定是根据成年人体重70 kg的每日蛋白质需求是60~70 g粗蛋白,作为优质蛋白源营养补充约每日需要10 g/d的量,优质蛋白补充系数为1/7[10]。培养基配方中蛋白质的含量约为29 mg/mL,故大豆低聚肽作为优质蛋白源添加到培养基的量为4 mg/mL的剂量,在4 mg/mL的基础上试验添加了2 mg/mL和8 mg/mL浓度梯度进行研究[24-25],分别为高剂量组(8 mg/mL)、中剂量组(4 mg/mL)、低剂量组(2 mg/mL)。每个监测管中装1只果蝇,一端塞上能透气的海绵,另一端附上0.5 cm的培养基或额外添加SBP的培养基并用蜡封以防止失水风干。采用动物行为分析系统VideoTrack,在12/12 h明暗的条件下监测果蝇睡眠,20日龄21:00放入检测管中,先让果蝇适应12 h,分析数据从第21日9:00至第26日9:00的睡眠数据,把监测玻璃管固定到检测板上,每5 min记录一次数据,如图2。
图2 果蝇在动物行为分析系统中的睡眠监控图Fig.2 Drosophila sleep monitoring chart in animal behavior analysis system
1.3.5果蝇头部取样
选取日龄20日雄性果蝇,在当日21:00,在培养基中(共4个组:空白组和SBP的3个剂量组,每组50只)培养48 h后,即22日晚上21:00,取待测果蝇通过二氧化碳麻醉,并装在冻存管,迅速放入液氮罐中,5 min后取出迅速用力摇晃,使其充分破碎,倒入40目的实验室标准筛(筛子提前用液氮冷却),筛子截留的就是果蝇的躯体,筛子下方放白纸,白纸上面就是果蝇的头、腿、翅、触角,再将白纸上的样品倒入20目的筛子,筛子截留果蝇的头部。将果蝇头部置于冻存管中,放入液氮备用。
1.3.6果蝇头部RNA提取和RT-qPCR测量
将收集的果蝇头部样品每组30只,使用液氮研磨,加入TRIzol试剂裂解样品并根据试剂盒说明书提取果蝇头部总RNA。将RNA样品1 μg用M-MLV逆转录酶试剂盒反转录为cDNA,进一步使用SYBR Green Mix试剂盒进行荧光定量PCR,使用RT-qPCR仪检测目的基因mRNA表达水平。RT-qPCR反应程序为:95 ℃下预变性10 min(1个循环),在95 ℃下10 s,60 ℃下1 min条件下进行40个循环扩增,收集Ct值数据后采用2^-ΔΔCt法进行数据分析[26],使用GAPDH基因作为内参。表1为检测使用的引物信息[27]。

表1 果蝇基因引物序列Tab.1 Drosophila gene primer sequences
1.3.7果蝇头部5-HT的测量
从液氮罐中取出装有果蝇头的冻存管,每组30只,加入0.5 mL的生理盐水,匀浆,3 000 r/min离心10 min,取上清,使用5-HT ELISA试剂盒,每组3个平行,在酶标仪450 nm的波长下测量。
1.4 统计分析方法
所有实验重复3次,结果表示为平均值±标准偏差。使用SPSS 16软件通过单向方差分析所有数据。统计学分析时,认为P<0.05为显著差异,P<0.01为较显著差异,P<0.001为极显著差异。
2 结果与分析
2.1 SBP的分子量分布
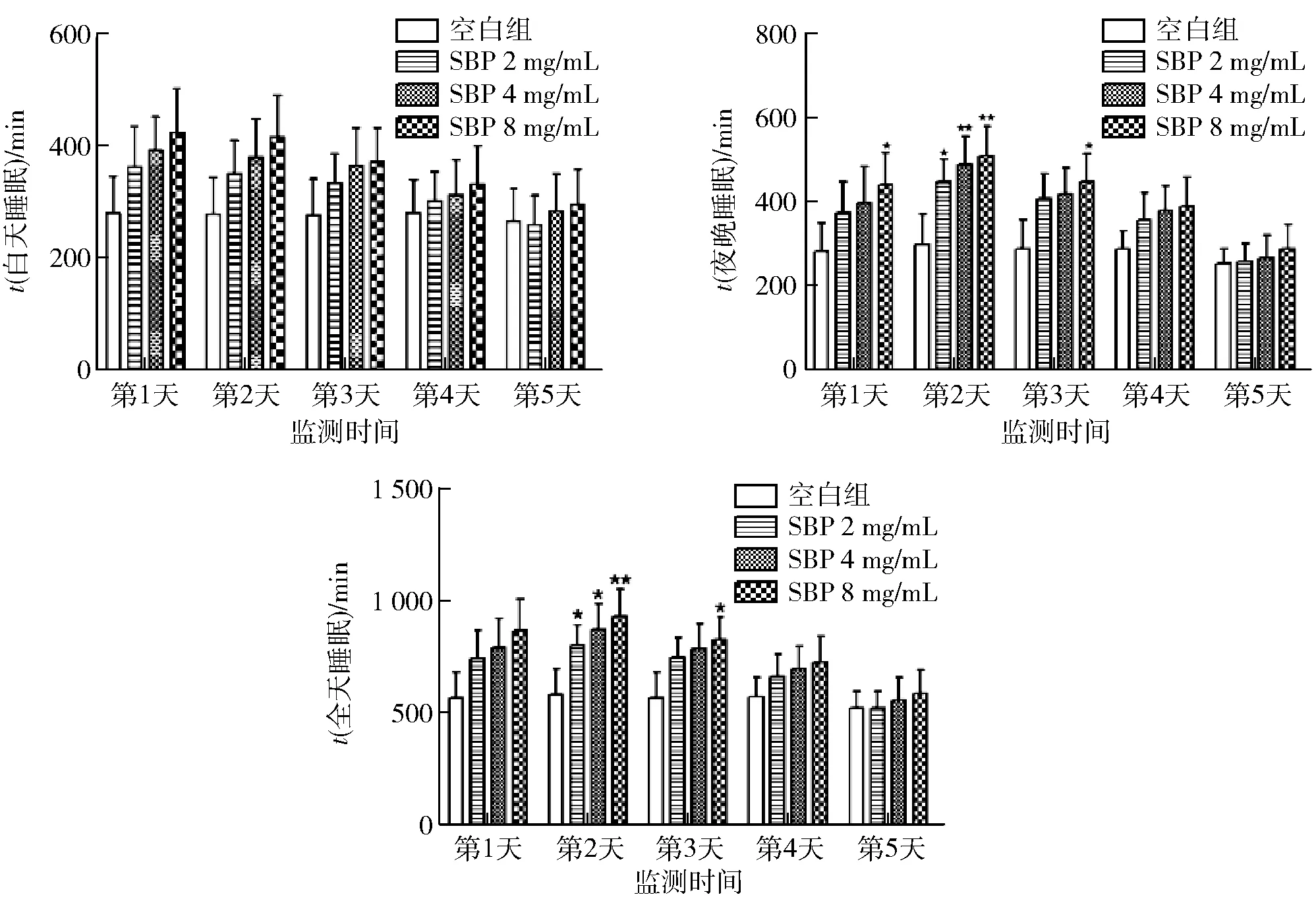
与空白组比较,*表示显著差异P<0.05,**表示较显著差异P<0.01。图3 大豆肽对果蝇睡眠时长的影响Fig.3 Effect of soybean peptides on sleep duration of Drosophila
通过凝胶过滤色谱法测定SBP的分子量分布。见表2,观察到分子量186~1 000 Da的比例为84.58%,平均分子量约为722.37 Da,由约2~5个氨基酸组成。
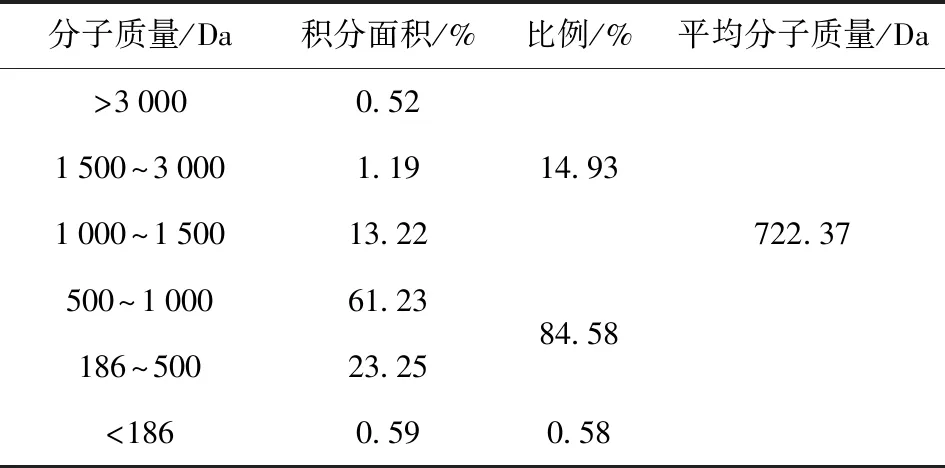
表2 大豆肽的分子质量分布Tab.2 Molecular weight distribution of soybean peptides
2.2 SBP对果蝇睡眠时长的影响
以没有添加SBP的培养基喂养的果蝇为空白组,在空白组中额外加入SBP(2、4、8 mg/mL),研究对雄性果蝇睡眠时长的影响,见图3。由图3a可知,与空白组相比,SBP的3个剂量组均能延长果蝇白天的睡眠时长且随剂量的升高而升延长,呈现浓度依赖性,尤其是高剂量组延长效果最好,但3个剂量组相对于空白组都无显著性差异。由图3b可知,与空白组相比,第2天,SBP的低、中、高三个剂量组均能显著(P<0.05)提高睡眠时长,中剂量、高剂量能较显著(P<0.01)提高睡眠时长。在第1天、第3天高剂量显著(P<0.05)提高睡眠时长。由图3c可知,果蝇全天睡眠的分析中,与空白组相比,SBP的低剂量和中剂量组显著(P<0.05)延长果蝇的睡眠时长,高剂量组较显著(P<0.01)延长了果蝇的睡眠时长,第3天高剂量组显著(P<0.05)延长了果蝇的睡眠时长。
在添加SBP之后的前3天中,第2天效果最显著能延长睡眠时长,随着时间的延长,到了第4天、第5天SBP不再延长果蝇的睡眠时长,这可能是由于SBP在潮湿的环境下已经变质,有文献报道肽类物质相较于蛋白质和氨基酸更易被微生物利用[28]。因此,在20日额外添加SBP,睡眠时长延长,最佳时效是48~60 h,最佳剂量为8 mg/mL。
2.3 SBP对果蝇生物钟基因的营养调节
果蝇的睡眠4个核心钟基因(per、tim、clk、cyc)和其他钟基因及其编码蛋白组成了互相转录- 翻译反馈环路以驱动其昼夜节律,并且在果蝇和哺乳动物之间保持一致,见图4[29]。图4显示,首先DNA结合异二聚体CLK/CYC(clk和cyc转录而来)与靶标启动子中的E-box序列(通常为CACGTG)结合以激活基因per/tim,并转录表达形成PER/TIM蛋白二聚体,在傍晚光线消失后开始大量转录形成,到午夜的时候,达到顶峰,随后,PER/TIM蛋白二聚体,慢慢解离,并进入细胞核中,通过CK2、SGG、PP2A、PP1,调节形成PER和TIM的磷酸化并与DBT结合抑制DNA结合CLK/CYC,并与靶标启动子中的E-box序列结合,抑制激活per/tim基因的转录。抑制CLK/CYC转录激活(白天)和抑制PER/TIM(夜晚),完成整个昼夜的睡眠/觉醒的调节循环[29]。

图4 cyc/clk和per/tim的调节反馈回路图Fig.4 Feedback loop of cyc/clk and per/tim
SBP对果蝇睡眠调控生物基因的影响见图5,SBP的3个剂量组均显著上调per、tim、clk、cyc基因的表达水平。SBP的中剂量组对果蝇的4个核心钟基因均较显著上调(P<0.01),低剂量组只对tim基因较显著上调(P<0.01),对per、clk、cyc这3个基因只是显著上调;相较于空白组,果蝇睡眠基因的影响尤其是tim基因上调效果最好,低剂量和中剂量SBP均较显著上调(P< 0.01),尤其是高剂量SBP极显著上调了tim基因(P<0.001)。这说明SBP的摄入可能对果蝇的tim基因影响更敏感,从而促进PER/TIM蛋白二聚体的形成,以延长睡眠时长。
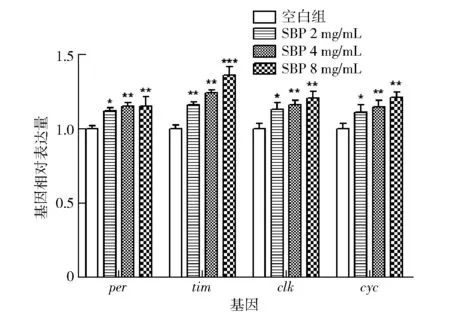
与空白组比较,*表示显著差异P<0.05,**表示较显著差异P<0.01,***表示极显著差异P<0.001。图5 大豆肽对果蝇睡眠调控生物基因的影响Fig.5 Effect of soybean peptides on sleep-regulating biological genes of Drosophila
2.4 SBP对果蝇睡眠调控相关神经递质合成基因的营养调节
SBP对果蝇睡眠调控相关神经递质合成基因的影响见图6,相较于空白组,SBP的高剂量组对gdh和hdc的基因表达水平均显著上调(P<0.05),对gad的基因表达水平较显著上调(P<0.01),对tph的基因表达水平极显著上调(P<0.001)。
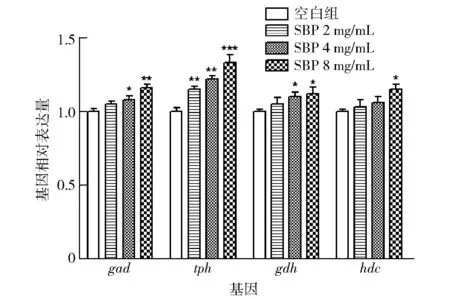
与空白组比较,*表示显著差异P<0.05,**表示较显著差异P<0.01,***表示极显著差异P<0.001。图6 大豆肽对果蝇睡眠调控相关神经递质 合成基因的影响Fig.6 Effect of soybean peptides on sleep regulation-related neurotransmitter synthesis genes of Drosophila
大豆肽对果蝇脑部五羟色胺含量的影响见图7,SBP的中剂量组对gad和gdh均显著上调(P<0.05),tph较显著(P<0.01)上调,而对hdc的影响无统计学意义。SBP的低剂量组只对tph基因上调较显著(P<0.01),其他3个基因影响无差异,结合图3b,第2天晚上SBP的低剂量组是显著性促进果蝇睡眠延的。因此,SBP对果蝇睡眠延长是通过上调tph基因的表达完成的。因此,为了进一步验证,测量了tph调节相关的神经递质五羟色胺的含量。由图7可知,相较于空白组,SBP高剂量组对果蝇的5-HT含量显著性升高(P<0.05),而低剂量和中剂量组对五羟色胺含量都有升高。SBP在对小鼠睡眠延长实验中,促进了五羟色胺的分泌并显著提高了小鼠的褪黑素含量导致小鼠睡眠延长[30],这与SBP对果蝇睡眠延长影响一致,又据文献报道,升高果蝇五羟色胺的含量可较大程度促进果蝇睡眠[31-32]。故而,SBP是通过上调果蝇脑内5-HT的限速酶TPH表达,进而提高5-HT含量来促进果蝇睡眠。
3 结 论
在研究老年果蝇睡眠实验中,研究发现SBP的3个剂量组(2、4、8 mg/mL)对其睡眠时长上调最佳的时间为第2日的晚上,即加入SBP后的48~60 h之间,最佳剂量8 mg/mL。通过核心钟基因(per、tim、clk、cyc)的测定,得到响应最强的是tim基因,因此,SBP促进果蝇睡眠是上调了tim基因表达提高PER/TIM蛋白二聚体含量来促进果蝇夜晚睡眠的。SBP对果蝇脑中γ-氨基丁酸、五羟色胺、组胺和谷氨酸合酶基因gad、tph、gdh、hdc的表达水平的影响中,只有低剂量组显著上调了tph基因表达,进而又测定了5-HT的含量,研究表明,SBP提高了果蝇脑内5-HT的含量。因此SBP是通过上调tim基因,提高转录形成PER/TIM蛋白二聚体,进而上调TPH的酶活,增加5-HT的含量来延长果蝇的睡眠。后续将SBP对果蝇的睡眠影响机制进行更深入的研究,为SBP对睡眠的影响提供更多的科学依据。
