偏甘油酯脂肪酶PrLip的重组表达及酶学性质表征
2020-10-27刘晓慧蓝东明王永华
刘晓慧, 蓝东明, 王永华
(华南理工大学 食品科学与工程学院, 广东 广州 510641)
偏甘油酯脂肪酶催化甘油与脂肪酸反应时,只合成甘油单酯(MAG)和甘油二酯(DAG),无甘油三酯(TAG)产生。作为具有独特底物特异性的脂肪酶,其催化生成产物单一,可实现目标化合物的高效合成,一直以来被生物催化领域青睐[1-2]。
近年来,偏甘油酯脂肪酶在功能性结构酯制备、油脂改性及油脂精炼等领域获得了广泛关注。例如:在油脂脱酸中,偏甘油酯脂肪酶SMG1-F278N可以实现高达99.88%的脱酸效率;结合分子蒸馏,偏甘油酯脂肪酶可以高效合成甘油二酯,含量最高可达99.28%[3-6];高纯度PUFA甘油三酯制备中使用偏甘油酯脂肪酶SMG1去除甘油酯中非甘油三酯组分,获得95%~100%的PUFA甘油三酯[7]。尽管偏甘油酯脂肪酶有非常诱人的应用前景,但当前只有5种偏甘油酯脂肪酶被报道[8-12]。Yamaguchi等[8]首次报道了偏甘油酯脂肪酶PCL的分离纯化及酶学性质。Toida等[9]从米曲霉(Aspergillusoryzae)发酵液中分离纯化得到脂肪酶AOL,并表征其偏好MAG和DAG的底物特异性,而对TAG不反应。Xu等[10]在毕赤酵母X33中重组表达脂肪酶SMG1,解析其三维结构并阐释底物选择及激活机制[11-12]。Tan等[13]从圆弧青霉PG37(Penicilliumcyclopium)中克隆了偏甘油酯脂肪酶PcMdl的基因,并在毕赤酵母GS115中异源表达。Xu等[14]在毕赤酵母X33中异源表达了来源于球形马拉色菌(Malasseziaglobose)的低温偏甘油酯脂肪酶MgMDL2。目前,已表征的偏甘油酯脂肪酶最适温度在15~40 ℃,但中低温的酶会限制其在工业上的广泛应用,因此,挖掘更多新型的偏甘油酯脂肪酶并深入研究其特性,无论是在丰富酶制剂的种类,还是在提升其工业应用中的催化能力方面都具有重要的意义。
娄地青霉(Penicilliumroqueforti)是一种广泛存在于自然界的真菌,可用于生产蓝纹奶酪,为食品安全级的菌株,近年来已被全基因测序[15]。研究从其基因组筛选出一个脂肪酶基因,命名为prlip,对其进行重组表达、纯化及酶学性质表征,旨在丰富工业用脂肪酶的资源并提供脂肪酶研究基础。
1 材料与方法
1.1 材料与试剂
毕赤酵母(Pichiapastoris)X33及表达载体pGAPZαA,本实验室保存;基因引物、质粒提取试剂盒、Bradford蛋白检测试剂盒、博来霉素、蛋白marker,生工生物工程(上海)股份有限公司。Q Sepharose层析填料,瑞典GE Healthcare公司(中国广州);三月桂酸甘油酯(质量分数95%)、α,α’-二月桂精(质量分数95%)、单月桂酸甘油酯(质量分数90%)、亚麻酸(质量分数约70%),美国Sigma-Aldrich公司;甘油二酯油(质量分数51.4% TAG、48.6% DAG),实验室自制。其他试剂皆为分析纯。
1.2 仪器与设备
Waters 1525型高效液相色谱仪,美国Waters公司;AKTA Purifier蛋白纯化系统,瑞典GE Healthcare公司;Spectral Max M2e型多功能酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1重组毕赤酵母的构建
根据Gene Bank数据库中公开的娄地青霉(Penicilliumroqueforti)编码的prlip基因(CDM30754.1),委托生工生物工程(上海)股份有限公司合成基因序列,并克隆到表达载体pGAPZαA中。重组质粒pGAPZαA-prlip线性化后电转化至毕赤酵母X33感受态,通过博来霉素抗性YPD(yeast extract peptone glucose)培养基(10 g/L酵母提取物、20 g/L蛋白胨、20 g/L葡萄糖)培养平板筛选转化子,利用菌落PCR鉴定获得阳性菌株。将阳性菌株接种到5 mL含100 μg/mL博来霉素的YPD液体培养基中,30 ℃、200 r/min振荡培养60 h后,进行SDS-PAGE电泳检测及酶活鉴定,获取重组pGAPZαA-prlip-X33酵母表达菌株。
1.3.2重组脂肪酶PrLip的表达及纯化
从甘油管中吸取200 μL菌液接种于50 mL YPD种子培养基中,于30 ℃、200 r/min恒温摇床中培养至生长对数期中期,按照体积比1∶10进行扩大培养,相同条件下培养60 h。
在4 ℃下,10 000 r/min离心20 min,收集发酵上清液,获得粗酶液;用0.45 μm微孔滤膜过滤粗酶液,将过滤后的上清液置于冰上,用10 kDa的膜包浓缩,并用20 mmol/L Tris-HCl(pH值8.0)缓冲液等体积换盐5次。使用Q Sepharose Fast Flow阴离子交换柱对粗酶液进行纯化,用20 mmol/L Tris-HCl缓冲液(pH值8.0)平衡,将换盐后的粗酶液上样,先用含80 mmol/L氯化钠的20 mmol/L Tris-HCl缓冲液(pH值8.0)洗脱,去除杂蛋白,再用含250 mmol/L氯化钠的20 mmol/L Tris-HCl缓冲液(pH值8.0)将目的蛋白质洗脱。利用12% SDS-PAGE凝胶电泳分析重组PrLip的纯化情况。
1.3.3脂肪酶PrLip酶活力测定
采用滴定甘油二酯乳化液的方法测定脂肪酶水解活力[16]。取5 mL 0.02 mol/L缓冲液及4 g甘油二酯乳化液(1 g的甘油二酯和3 g质量分数4%聚乙烯醇,用均质机均质至体系均一)于50 mL锥形瓶中,45 ℃恒温水浴锅中预热5 min,加入适量酶液,恒温反应5 min后马上加入15 mL 体积分数95%乙醇破乳,终止反应。加入3滴酚酞指示剂,用0.05 mol/L氢氧化钠溶液滴定游离脂肪酸,记录消耗的氢氧化钠体积。空白对照为反应体系预热后不加酶液,同样操作后加入15 mL 95%乙醇及等体积的灭活酶液。
脂肪酶酶活力定义为:在上述测定条件下,单位时间(1 min)水解甘油二酯产生1 μmol游离脂肪酸所需要的酶量,为一个酶活力单位,U。
1.3.4脂肪酶PrLip酶学性质测定
1) 脂肪酶PrLip最适pH值及pH耐受性的测定。选择pH值4.0、5.0、6.0、7.0、8.0、9.0六个测试点(pH值4.0、5.0为柠檬酸盐缓冲液,pH值6.0、7.0为磷酸盐缓冲液,pH值8.0为Tris-HCl溶液,pH值9.0为甘氨酸-氢氧化钠溶液),30 ℃下测定酶活力,以相应pH值下的最高酶活力为100%,其余以相对酶活力表示。将脂肪酶PrLip置于不同pH值(4.0~9.0)的缓冲液中,4 ℃孵育2 h后测定残余酶活力,检测脂肪酶PrLip的pH耐受性。以孵育前的酶活力为100%,其余以相对酶活力表示。
2) 脂肪酶PrLip最适温度及热稳定性的测定。在最适pH值,不同温度(20~60 ℃)条件下检测脂肪酶PrLip的酶活力。以相应温度下的最高酶活力为100%,其余以相对酶活力表示。将适量的脂肪酶PrLip置于不同温度(35、40、45 ℃)的油浴锅,每隔一定的时间取样测定残余酶活力,检测脂肪酶PrLip的热稳定性。以热处理前的酶活力为100%,其余以相对酶活力表示。
3) 金属离子、有机溶剂及表面活性剂对脂肪酶PrLip酶活力的影响。将脂肪酶PrLip分别孵育在终浓度为5 mmol/L金属离子(NiCl、ZnSO4、CuSO4、MgCl2、CaCl2、MnCl2、CoCl2、FeCl3)溶液、体积分数30%有机溶剂(甲醇、乙醇、异丙醇)、体积分数1%表面活性剂(SDS、曲通X-100、吐温20、吐温80)中,4 ℃孵育2 h后测定残余活力。以不添加其他离子或分子的酶活力为100%。
4) 脂肪酶PrLip对甘油酯的底物特异性测定。通过分别水解三月桂酸甘油酯、α,α’-二月桂精、单月桂酸甘油酯3种标准品来检验其底物特异性。取0.5 g甘油酯乳化液(1 g甘油二酯和3 g质量分数4%聚乙烯醇,均质至体系均一)于4 mL螺口瓶,加入450 μL缓冲液(20 mmol/L,pH值7.0)和100 U酶液。在40 ℃、500 r/min的油浴锅中水解反应24 h,脂肪酸产物通过高效液相色谱(high performance liquid chromatography, HPLC)检测。此外,通过亚麻酸和甘油进行酯化反应,进一步验证其底物特异性。反应总体系为2 g(甘油与亚麻酸摩尔比为4∶1),200 U冻干PrLip酶粉,在40 ℃、500 r/min的油浴锅中反应,每隔一段时间取样,进行HPLC分析。
1.3.5水解及酯化反应产物的测定
水解及酯化反应后的脂肪酸及甘油酯由配备Waters 2414型示差折光检测器的高效液相色谱仪进行检测,液相色谱柱购于美国Phenomenex Corporation公司,规格为250 mm×4.6 mm,5 μm。色谱条件为:流速1 mL/min,进样体积10 μL,柱温箱温度30 ℃,流动相为正己烷- 异丙醇- 甲酸(体积比18∶1∶0.003)
1.3.6脂肪酶PrLip同源建模
采用Swiss-Model在线网站(https:∥swissmodel.expasy.org/),以PCL(PDB ID:5CH8)为模板预测脂肪酶PrLip的三维结构,从结构上分析蛋白质稳定性。
1.4 数据处理
实验数据为3次平行实验的平均值,所有数据由Origin Pro 8.0软件处理和分析。
2 结果与分析
2.1 脂肪酶PrLip的序列分析
根据脂肪酶G-X-S-X-G保守五肽等序列特征,从娄地青霉基因组中发现了一个假定的脂肪酶序列命名prlip[17]。该序列包含一个完整的开放阅读框,由849 bp核苷酸组成,编码283个氨基酸,预测蛋白质分子质量为31 kDa。通过序列比对分析,PrLip与其他偏甘油酯脂肪酶PCL、PcMdl和AOL的相似度分别为80.65%、81%和60.85%,提示它可能具有类似偏甘油酯脂肪酶的催化功能;但其与偏甘油酯脂肪酶SMG1和MgMDL2的序列相似度较低,仅为19.86%和22.11%。PrLip与已报道的偏甘油酯脂肪酶的序列比对结果见图1。PrLip与其他偏甘油酯脂肪酶有一致的保守五肽序列(GHSLG),预测其催化三联体为Ser145、Asp199、His259,其中活性位点Ser145位于保守五肽序列中。
2.2 脂肪酶PrLip表达与纯化结果分析
利用基因工程使毕赤酵母(pGAPZαA-prlip)胞外高效表达重组脂肪酶PrLip,通过Q Sepharose Fast Flow阴离子交换层析柱,利用不同浓度的氯化钠洗脱液分离,获得目的蛋白质。PrLip蛋白质表达与纯化结果见图2及表1。SDS-PAGE检测显示,重组脂肪酶PrLip分子质量约为31 kDa,与预测的分子质量一致,同时表明重组PrLip在细胞内翻译过程没有发生明显的糖基化修饰。1.5 L发酵液最终可纯化得到蛋白质49 mg,回收率为38.89%,纯化倍数为4.37倍(表1)。纯化的重组蛋白质应用于后续的生化性质研究。
2.3 脂肪酶PrLip的酶学性质分析
2.3.1pH值对PrLip酶活力的影响
pH值对PrLip酶活力的影响见图3(a)。在pH值7.0时活性最高,而在pH值4.0和9.0的溶液中,酶活力受抑制。研究PrLip对不同pH值的耐受性,结果发现在pH值4.0和5.0孵育2 h后,其相对残余酶活低于60%,在pH值8.0和9.0中残留活性超过90%,这说明PrLip在碱性环境中的稳定性要优于酸性环境(图3(b))。该结果与其他已报道的偏甘油酯脂肪酶性质相似(表2),已报道的偏甘油酯脂肪酶最适pH值均在6.0~7.5,且大部分在碱性环境中更稳定。

图1 脂肪酶PrLip与5种已报道脂肪酶的序列比对Fig.1 Multiple alignment of lipase PrLip and five reported lipase
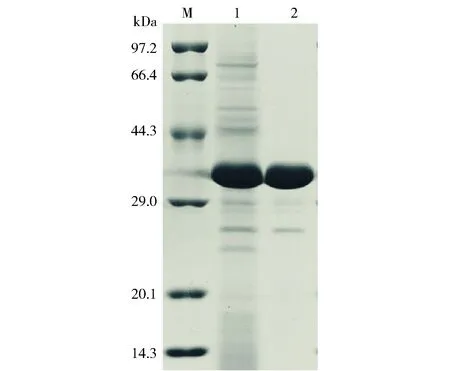
泳道M: 蛋白质marker;泳道1:PrLip的发酵上清液;泳道2:Q柱纯化后PrLip。图2 SDS-PAGE分析脂肪酶PrLip的表达及纯化结果Fig.2 SDS-PAGE analysis of expression and purification of lipase PrLip
2.3.2温度对PrLip酶活力的影响
温度对PrLip酶活力的影响如图4。由图4(a)可知,脂肪酶PrLip在20~50 ℃时均保持较好的催化活性,水解活力均在70%以上,45 ℃时催化活力最高。PrLip的热稳定性研究结果发现,在35 ℃和40 ℃条件下,PrLip在6 h内分别保留了其初始活性的57%和46%,但在45 ℃孵化30 min便失活(图4(b))。目前已报道的偏甘油酯脂肪酶最适温度范围为15~40 ℃(表2),而在工业生产应用中,酶的热稳定性能是重要应用参数。因此,脂肪酶PrLip的发现拓宽了偏甘油酯脂肪酶的最适温度范围,为偏甘油酯脂肪酶的工业应用提供更多的选择。
为进一步解释脂肪酶PrLip良好的温度耐受性,以序列相似度高达80%的偏甘油酯脂肪酶PCL为模板(PDB ID: 5CH8),通过Swiss-Model进行同源建模。脂肪酶PrLip的三维结构如图5。从整体上看(图5(a)),脂肪酶PrLip在蛋白质外部loop转折之处,有两对二硫键,分别是Cys36-Cys41和Cys103-Cys106,固定了两段长loop结构,从而稳定了蛋白质构象。二硫键是共价作用形成的连接,因此被认为是稳定蛋白质最有利的因素,而目前已报道的偏甘油酯脂肪酶多数仅具有一对二硫键,如低温酶SMG1及MgMDL2。从核心区域上分析((图5(b)),发现脂肪酶PrLip盖子区(黄色)的疏水性氨基酸大部分均朝向催化口袋内侧,与催化中心的疏水性氨基酸(蓝色)形成疏水相互作用,对蛋白质的折叠与构象稳定起重要作用。
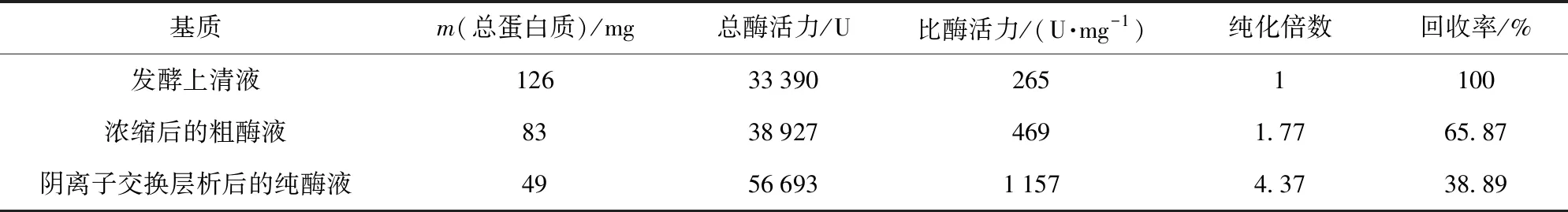
表1 脂肪酶PrLip纯化结果Tab.1 Purification of lipase PrLip
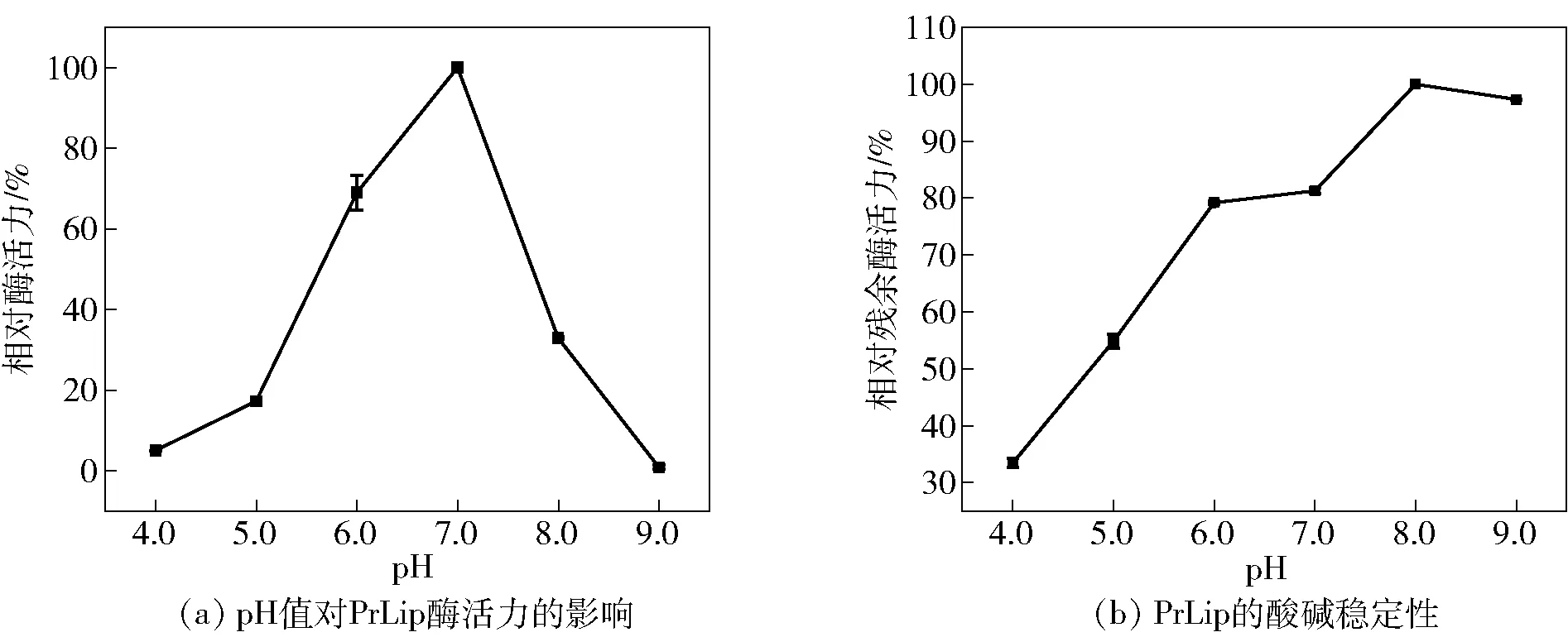
图3 pH值对脂肪酶PrLip酶活力及稳定性的影响Fig.3 Effects of pH on lipase activity and stability of PrLip
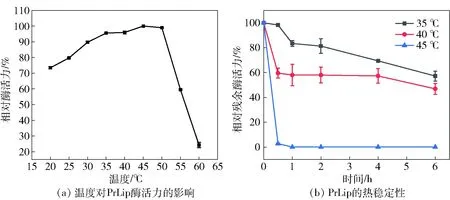
图4 温度对脂肪酶PrLip酶活力及耐热性的影响Fig.4 Effects of temperature on lipase activity and stability of PrLip
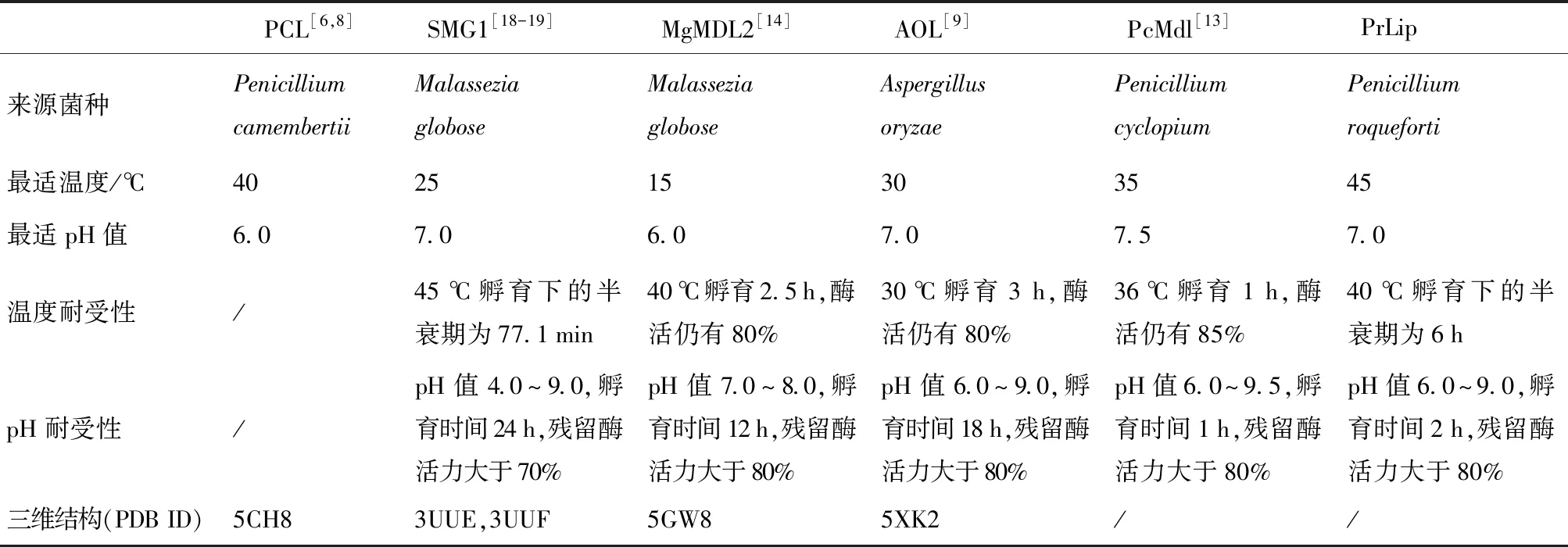
表2 不同来源的偏甘油酯脂肪酶的酶学特性比较
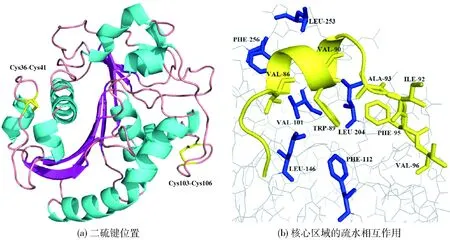
图5 脂肪酶PrLip的三维结构Fig.5 Structure of lipase PrLip
2.3.3金属离子、有机溶剂及表面活性剂对PrLip酶活力的影响
金属离子对PrLip酶活力的影响情况如图6(a)。Zn2+离子对PrLip的抑制作用较弱(相对残余酶活力约为75%);而Cu2+、Mg2+、Mn2+、Co2+对酶活性的抑制作用较强(残余活性60%~70%);Ca2+、Ni+、Fe3+抑制作用最强,相对残余酶活力分别下降到46.97%、21.68%、3.12%。
有机溶剂常被用作催化反应的组分之一,提高底物溶解性和分散性,影响酶催化效率。因此,研究了有机溶剂对脂肪酶PrLip活性的影响。测定了PrLip在体积分数30%的有机溶剂中孵育2 h后的活性,结果如图6(b),甲醇和异丙醇对PrLip有明显的抑制作用(相对活力降低90%),而在乙醇中PrLip的失活65%。
图6(b)呈现了体积分数1%表面活性剂(曲通X-100、吐温20、吐温80和SDS)对PrLip酶活力的影响。与对照组相比,SDS和吐温20对PrLip活性抑制作用较小,相对残余酶活力分别为对照组的70%和67%,曲通X-100对PrLip几乎无影响,酶活力保持100%。但是,吐温80可以将其相对酶活力提高为140%。有研究报道,曲通X-100通过调节酶- 底物复合体的活性位点,有利于酶与底物的自我调节,从而影响酶的活力和稳定性。脂肪酶PrLip对表面活性剂的耐受性有望使其应用于生物洗涤领域[20-21]。
2.3.4脂肪酶PrLip的底物选择性分析
为确定脂肪酶PrLip的底物特异性,对天然油脂底物(单月桂酸甘油酯、α,α’-二月桂精和三月桂酸甘油酯)进行24 h水解反应,并以甘油和亚麻酸为底物进行酯化反应。脂肪酶PrLip只对DAG与MAG底物表现出水解活性,而不水解TAG底物,如图7(a)。在酯化反应中,反应产物只有DAG和MAG被检测到,且无TAG产生(图7(b))。酶催化水解和酯化的实验均证实PrLip为偏甘油酯脂肪酶。

图6 金属离子、有机溶剂、表面活性剂对脂肪酶PrLip酶活力的影响Fig.6 Effects of metal ions, organic solvents and detergents on lipase activity of PrLip
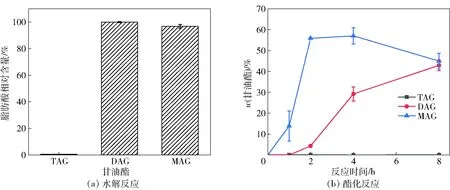
图7 脂肪酶PrLip的底物选择性Fig.7 Substrate specificity of lipase PrLip
表2归纳了当前已表征的真菌来源偏甘油酯脂肪酶的酶学特性,从来源上看,脂肪酶SMG1及MgMDL2均来源于球形马拉色菌(Malasseziaglobose),为皮肤致病菌;而其余3种脂肪酶的来源菌株常见于食品中,卡门柏青霉(Penicilliumcamembertii)和娄地青霉(Penicilliumroqueforti)常用于奶酪发酵剂,米曲霉(Aspergillusoryzae)在制作清酒或酱油时可作曲,因此在油脂加工中应用更为安全。这6种脂肪酶的最适pH值均在6.0~7.5,且大多数偏向于耐受碱性环境,除了脂肪酶SMG1在pH值4.0~9.0均保持70%以上的酶活力;MgMDL2、SMG1、AOL、PcMdl和PCL的最适温度分别为15、25、30、35、40 ℃,PrLip为45 ℃,具有更好的温度耐受性。
3 结 论
偏甘油酯脂肪酶因其独特的底物选择性,使其在生物催化领域具有广阔的应用前景。从自然界微生物中筛选鉴定,研究其酶学性质及应用评价的工作意义重大。本研究从食品安全菌娄地青霉(Penicilliumroqueforti)基因组中发现一个假定的脂肪酶基因prlip,通过全基因合成该序列,并实现在毕赤酵母中高效重组表达。纯化的PrLip的最适温度为45 ℃,最适pH值为7.0,40 ℃的半衰期约为6 h,耐受大部分表面活性剂,水解及酯化反应证实其为偏甘油酯脂肪酶。本研究一方面丰富了偏甘油酯脂肪酶种类,同时为其在工业中的应用提供了一定研究基础。未来的研究工作中,需要对其三维结构进行解析,并结合基因工程手段及生物计算阐明其催化机制,通过酶工程技术手段对酶分子进行改造,强化酶的催化性能,满足工业应用需求。
