东北虎豹国家公园野生动物大肠埃希菌毒力与耐药性研究
2020-10-27祝令伟王铁成郭学军
梁 冰 纪 雪 祝令伟 王铁成 刘 军 郭学军 孙 洋
(军事科学院军事医学研究院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,长春,130122)
保护和拯救野生动物在全球备受关注,我国也在逐年加大对野生动物的保护力度。2016年11月,在全国人大常委会上制定了国家公园试点总体方案,计划建立“青海三江源国家公园”和“东北虎豹国家公园”。2017年在长春正式成立了东北虎豹国家公园国有自然资源资产管理局、东北虎豹国家公园管理局。我国野生东北虎(Pantheratigrisaltaica)、东北豹(Pantherapardusorientalis)种群跨越吉林、黑龙江两省,涉及两个省份的多个林业局,主要以吉林省为主。大肠埃希菌(Escherichiacoli)是动物和人的肠道中常见的条件致病菌,可引起多种疾病,在自然生态中亦扮演着重要角色[1]。在我国,针对不同动物来源的大肠埃希菌研究有很多,但对于野生动物源大肠埃希菌的研究却相对缺乏,有限的报道也是针对人工饲养繁育的野生动物。本研究为了解东北虎豹国家公园野生动物大肠埃希菌毒力及耐药特征,采集吉林省6个林业局管辖区内的东北虎等野生动物的粪便样品,进行大肠埃希菌的分离与鉴定,获得野生动物携带大肠埃希菌的本底数据,监测致病性及耐药性大肠埃希菌在野生动物肠道内的流行情况,为阐明野生动物病原菌耐药传播规律提供数据支持。
1 材料
1.1 样品来源
2016年从东北虎豹国家公园辖区内珲春、天桥岭、黄泥河、汪清等地,采集东北虎、东北豹、野猪(Susscrofa)、马鹿(Cervuselaphus)、西伯利亚狍(Capreoluspygargus)、梅花鹿(Cervusnippon)、东北兔(Lepusmandshuricus)和花尾榛鸡(Tetrastesbonasia)等野生动物的粪便样品共234份。
1.2 培养基及试剂
麦康凯琼脂基础培养基购自青岛海博生物公司;E-test试纸条购自OXOID公司;2×TaqMasterMix试剂包购自康为世纪公司;Premix ExTaqVersion 2.0 plus dye和DNA分子量标准DL2000购自TaKaRa公司;琼脂糖购自Genview公司。使用引物见表1,由吉林库美生物科技有限公司合成。

表1 本研究所用PCR引物

续表1
1.3 主要仪器
全自动微生物鉴定/药敏系统(BD PhoenixTM-100)、比浊仪(Phoenix SpecTM)为美国BD公司生产。生物安全柜(1300A2)为美国Thermo公司生产,PCR扩增仪(ETC-811)为北京东胜创新生物科技有限公司生产,生化培养箱(LRH-70)为上海一恒科学仪器有限公司生产。
2 方法
2.1 大肠埃希菌的分离
称取每份粪便样品5 g,加入2 mL无菌生理盐水,室温振荡10 min,静止2 min,上清为菌悬液。吸取20 μL粪便生理盐水菌悬液于麦康凯琼脂平板,半板涂布半板划线,(36±1) ℃培养16—18 h,观察菌落形态,挑取疑似单菌落于麦康凯琼脂平板二次分离纯化。
2.2 模板制备
分离株接种于脑心培养液中,(36±1) ℃振荡培养16—18 h。吸取400 μL培养液,12 000 r/min离心1 min,弃上清,菌体沉淀用100 μL无菌去离子水重悬,95 ℃加热7 min,室温冷却后12 000 r/min离心1 min,取上清液作为PCR检测的DNA模板。
2.3 大肠埃希菌鉴定
参考文献[2]合成大肠埃希菌特异性16S rDNA引物(表1)。PCR反应体系:2×TaqPCR Master Mix 预混酶12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,ddH2O补至25 μL。反应条件:94 ℃预变性10 min;94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸1 min,30个循环;72 ℃总延伸7 min。1%琼脂糖凝胶电泳,凝胶成像系统记录分析。PCR阳性大肠埃希菌分离株于BD PhoenixTM-100全自动微生物鉴定/药敏系统进行生化鉴定和药敏检测。
2.4 最小抑菌浓度(MIC)检测
挑取大肠埃希菌的单菌落接种于2 mL MH肉汤培养液中,(36±1) ℃培养16—18 h,将增菌液稀释至0.5麦氏比浊度备用。蘸取0.5麦氏比浊度的菌液在MH平板上均匀涂布。将四环素E-test试纸条放置于MH平板中央,(36±1) ℃培养16—18 h,参考CLSI标准(2018版)判定最小抑菌浓度MIC(minimal inhibitory concentration)。
2.5 四环素耐药基因检测
参考文献[3-4]合成tetA、tetB、tetC、tetD、tetW和tetM6种耐药基因引物(表1)。PCR反应体系:2×TaqPCR Master Mix预混酶12.5 μL,上、下游引物各1 μL,DNA模板1 μL,ddH2O补至25 μL。反应条件:95 ℃预变性3 min;95 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1 min,30个循环,72 ℃总延伸10 min。1%的琼脂糖凝胶电泳检测。
2.6 Eric-PCR指纹图谱鉴定
参考文献[5]合成引物ERIC-1(5′-ATG TAA GCT CCT GGG GAT TCA C-3′)和 ERIC-2(5′-AAG TAA GTG ACT GGG GTG AGC G-3′)。PCR反应体系:2×TaqPCR Master Mix预混酶12.5 μL,上、下游引物各1 μL,DNA模板1 μL,ddH2O补至25 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,48 ℃退火80 s,72 ℃延伸2 min,30个循环;72 ℃总延伸10 min。1.2%琼脂糖凝胶电泳,凝胶成像系统记录分析。
2.7 大肠埃希菌系统进化分群分析
参考文献[6]合成ChuA、YjaA和TspE4.C23对引物(表1)。多重PCR反应体系;Mix1 0.125 μL,Mix2 12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,ddH2O补至25 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃总延伸7 min。1%琼脂糖凝胶电泳,凝胶成像系统记录分析。
2.8 大肠埃希菌毒力基因检测
参考文献[7]合成F41、LT、EAST1、Stx1、Stx2、eae、F6、F4、F5、F18、STa、Stx2e和STb等13对大肠埃希菌毒力基因,PCR反应体系:2×TaqPCR Master Mix预混酶12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,ddH2O补至25 μL。大肠埃希菌各毒力基因PCR反应条件如下:94 ℃预变性5 min;94 ℃变性30 s,退火45 s(表1),72 ℃延伸45 s,30个循环,72 ℃总延伸5 min。1%琼脂糖凝胶电泳,凝胶成像系统记录分析。
3 结果
3.1 大肠埃希菌分离与鉴定结果
从234份陆生野生动物粪便样品中,分离获得40株疑似大肠埃希菌,经分子生物学鉴定和BD PhoenixTM-100全自动微生物鉴定,确定分离株均为大肠埃希菌,分离率为17.1%(40/234)。
3.2 大肠埃希菌药敏检测结果
通过BD PhoenixTM-100全自动微生物药敏系统对40株大肠埃希菌进行药敏检测,有8株大肠埃希菌对四环素耐药,耐药率为20%(8/40)。
3.3 MIC检测结果
利用四环素E-test试纸条对8株四环素耐药大肠埃希菌进行检测,MIC值如表2所示,最高抑菌浓度为128 μg/mL,最低抑菌浓度为32 μg/mL。四环素耐药菌株均来源于东北虎和野猪。
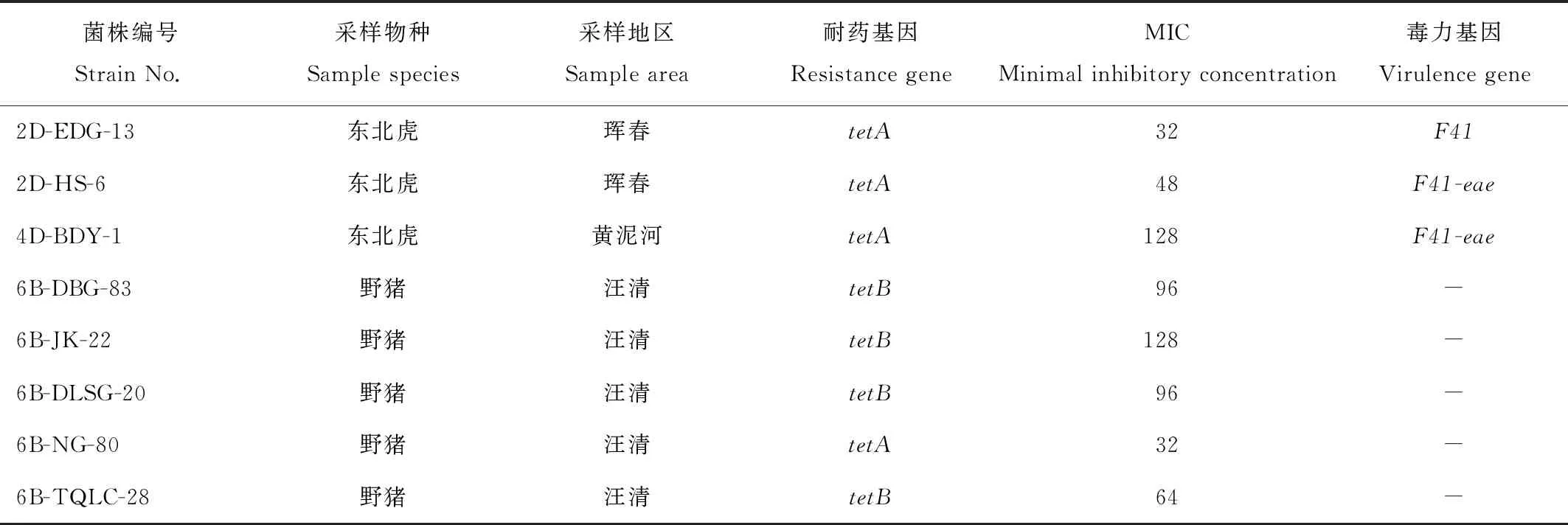
表2 四环素耐药大肠埃希菌分离株鉴定结果
3.4 ERIC-PCR结果
通过ERIC-PCR结果如图1所示,40株大肠埃希菌分离株存在35种不同指纹图谱。

图1 大肠埃希菌ERIC-PCR鉴定结果(部分)Fig.1 ERIC-PCR identification results of Escherichia coli(partial) 注:M:DNA标准100 bp;1—12:大肠埃希菌分离株 Note:M,DNA marker 100 bp.1-12,Escherichia coli isolates
3.5 大肠埃希菌系统进化分群
40株野生动物源大肠埃希菌的系统进化分群结果显示A群占7.5%(3/40),B1群占30%(12/40),B2群占15%(6/40),D群占37.5%(15/40),未知群占10%(4/40),PCR结果如图2所示。

图2 大肠埃希菌ABD分群PCR结果(部分)Fig.2 PCR results of Escherichia coli on phylogenetic clustering(partial) 注:M:DNA标准100 bp;1—9:大肠埃希菌分离株;N:阴性对照 Note:M,DNA marker 100 bp.1-9,Escherichia coli isolates.N,negative
3.6 大肠埃希菌毒力基因检测结果
对40株大肠埃希菌进行13种毒力基因检测,有10株大肠埃希菌携带EAST1基因,携带率为25%(10/40),其余毒力基因未检出。
3.7 耐药基因检测结果
对8株四环素耐药大肠埃希菌进行四环素耐药基因检测,仅检测到tetA和tetB(表2),未检测到tetC、tetD、tetW和tetM耐药基因。
4 讨论
肠杆菌基因间共有重复序列(enterobacterial repetitive intergenic consensus,ERIC)分散在细菌的基因组中,保守性极强,不易突变。ERIC-PCR是在RAPD-PCR的基础上发展起来的对细菌基因组DNA进行指纹图谱分析的一种方法,可用来区别不同种的细菌和同一种细菌的不同菌株[8]。本研究分离获得的大肠埃希菌ERIC图谱分散度高,同源性低,在40株分离株出现35种不同的指纹图谱,说明不同物种野生动物之间菌群交换存在屏障。
大肠埃希菌是常见条件性致病菌之一,也是细菌群落在肠道微环境中获得和传递毒力及耐药相关遗传元件的重要菌属,大肠埃希菌的耐药谱也是肠道菌群耐药基因水平传播评估的重要指标。本研究结果表明东北虎豹国家公园栖息的陆生野生动物携带大肠埃希菌耐药情况并不严重,仅存在四环素耐药表型并检出相关耐药基因,表明东北虎豹国家公园自然生态基本未受到人类畜牧养殖等活动的严重影响,但亦不能掉以轻心。Timonin等[9]对栖息于海岛的加拿大野马(Equuscaballus)做了类似的研究,大肠埃希菌分离率为28.7%(146/508),97%的分离株对全部抗生素敏感,仅有4株(2.7%)对四环素耐药,1株对β内酰胺类抗生素耐药。而与人类活动接触更为密切的野生动物如鸟类、啮齿类等通常耐药与毒力元件携带率更高[10]。本研究检出四环素耐药株也多从与人类活动区域有交集的野猪分离获得。
四环素作为临床上常用的抗生素,在我国养殖业中被广泛使用,长期大量的使用不仅造成家畜体内细菌四环素的耐药水平增高,同时也对环境造成了严重的抗生素污染。王基伟[11]报道吉林地区猪源大肠埃希菌四环素耐药率为83.63%,张瑜等[12]对延边地区猪源大肠埃希菌四环素耐药率为89%,而本研究中,野生动物大肠埃希菌对四环素的耐药率为20%,相对于周边养殖业对四环素的耐药率,我国“东北虎豹国家公园”中野生动物源大肠埃希菌的耐药情况较为乐观,但耐药菌四环素MIC值已高达128 μg/mL,需要加以关注。大肠埃希菌对四环素的耐药机制主要以外排和核糖体保护机制为主[13],本研究在8株具有四环素耐药表型大肠埃希菌中分别检出tetA和tetB基因,均为携带单一耐药基因,这与国内流行特点一致。
大肠埃希菌系统进化分群可分为A、B1、B2、D和未知群,其中B2群和D群为主要致病群[6],肠道外大肠埃希菌感染主要以B2群为主[14]。本研究中D群占较大比例,其次为B1群、B2群和A群。D群和B2群所占比例为52.5%。其中25%的分离株检出EAST1(enteroaggregativeEscherichiacoliheat-stable enterotoxin 1)毒力基因。EAST1为肠集聚性大肠埃希菌耐热肠毒素,是一种小蛋白质类毒素,与很多致病性大肠埃希菌家族有关联[15]。EAST1(38aa)由astA基因编码,编码基因和免疫原性均与STa不同,该毒素通过激活腺苷环化酶发挥活性。astA毒力基因转移通过插入序列IS1414实现,可在不同属细菌间水平转移,除了大肠埃希菌,在沙门氏菌(Salmonellaenterica)中也有发现[16]。
本研究对陆生野生动物源大肠埃希菌进行了初步研究,获得了大肠埃希菌系统进化分群、毒力基因、耐药表型、耐药基因型及耐药程度等的实验结果,为进一步了解陆生野生动物携带致病性或耐药性大肠埃希菌的情况提供了参考数据,为建立野生动物和人携带耐药病原菌之间的流行病学关联提供基础数据。
