JAK2/STAT3通路在雌激素缺乏相关骨髓间充质干细胞衰老中的作用初探
2020-10-27武文婧傅稼耀马鹏飞吴珺华
武文婧, 傅稼耀, 魏 玉, 马鹏飞, 吴珺华
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔修复科,上海200072)
绝经后骨质疏松给口腔修复及种植带来困难。前期研究表明,骨髓间充质干细胞(BMSCs)衰老可能在雌激素缺乏相关骨丢失中发挥重要作用[1]。细胞衰老是在端粒缩短、氧化应激、DNA损伤等诱因下发生的细胞增殖能力进行性、不可逆的丧失[2]。衰老的细胞除自身受损外还会分泌可溶性炎性坏死因子,即衰老相关分泌表型(senescent-associated secrete phenotype,SASP)。SASP会造成新的细胞衰老,形成恶性循环。JAK2/STAT3信号通路作为调控衰老SASP的重要节点,正日益受到关注。有文献报道JAK2/STAT3信号通路是调节衰老细胞SASP分泌和生成的关键[3]。因此,明确该通路在雌激素缺乏所致BMSCs衰老中的作用,对绝经后骨质疏松的治疗有借鉴意义。
1 材料和方法
1.1 BMSCs的提取和培养
将4周龄的雄性小鼠以过量麻醉的方式处死,用75%乙醇浸泡15 min后分离其双侧股骨和胫骨,剪去骭骺两端。用1 mL注射器吸取含10%胎牛血清(美国Gibco公司),1%青、链霉素(中国凯基公司)的α-MEM培养液(美国Hyclone公司),将小鼠骨髓冲入培养皿中,过筛,制备成单细胞悬液。将其置于37℃、5%CO2的培养箱中培养。每3天更换1次培养液,当细胞密度达到85%~90%时以1∶2的比例进行传代,并在第3代时进行研究。
1.2 药物处理
实验分组:对照组,H2O2诱导组(H2O2组),H2O2诱导+雌激素处理组(H2O2+E2组),H2O2诱导+雌激素+氟维司群(fulvestrant,ICI182,780,美国Sigma公司)处理组(H2O2+E2+ICI182,780组),H2O2诱导+JAK抑制剂处理组(H2O2+JAKi组)。相关处理如下:对照组不做任何处理;H2O2组使用含200μmol/L H2O2的培养液培养BMSCs 2 h,去除上述培养液,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗后用含5μmol/L的H2O2培养液培养24 h维持刺激,以建立BMSCs衰老模型;H2O2+E2组是在H2O2处理的同期将10-7mol/L的E2(美国Sigma公司)添加到培养液中48 h,以体外模拟雌激素的作用。H2O2+E2+ICI 182,780组是在H2O2及E2处理前24 h加入100μmol/L的氟维司群,以抑制雌激素受体,抵消E2的作用;H2O2+JAKi组是在H2O2处理的同期将6×10-5mol/L的鲁索替尼加入培养液中作用48 h以抑制JAK2/STAT3信号转导。
1.3 RNA提取及qPCR检测
使用RNAiso Plus试剂(日本Takara公司)提取细胞总RNA,使用PrimeScriptTMRT试剂盒(日本Takara公司)进行逆转录。然后使用SYBR Green荧光染料试剂配置反应体系。用LightCycler qPCR仪(瑞士Roche公司)进行扩增反应及分析,以GAPDH作为内参,通过2-ΔΔCt方法计算mRNA的倍数变化,并根据对照组对数据进行标准化。所用相关基因的引物序列均在文献中验证,具体序列见表1。
1.4 Western印迹法
用含有蛋白酶抑制剂混合物(中国威奥公司)的RIPA裂解液(中国碧云天公司)裂解细胞,以12 000 r/min离心10 min,吸取上清液,并使用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(中国碧云天公司)进行定量分析。用本课题组先前发表过的方法[4]进行Western印迹检测。p53,p21,JAK2,磷酸化的酪氨酸激酶2(phosphorylated janus kinase 2,PJAK2),STAT3和GAPDH抗体均购自美国CST公司,并以1∶1 000的稀释倍数使用。磷酸化的信号转导与转录激活子3(phosphorylated signal transducer and activator of transcription 3,PSTAT3)抗体购自中国博士德公司,以1∶500的倍数稀释并使用。
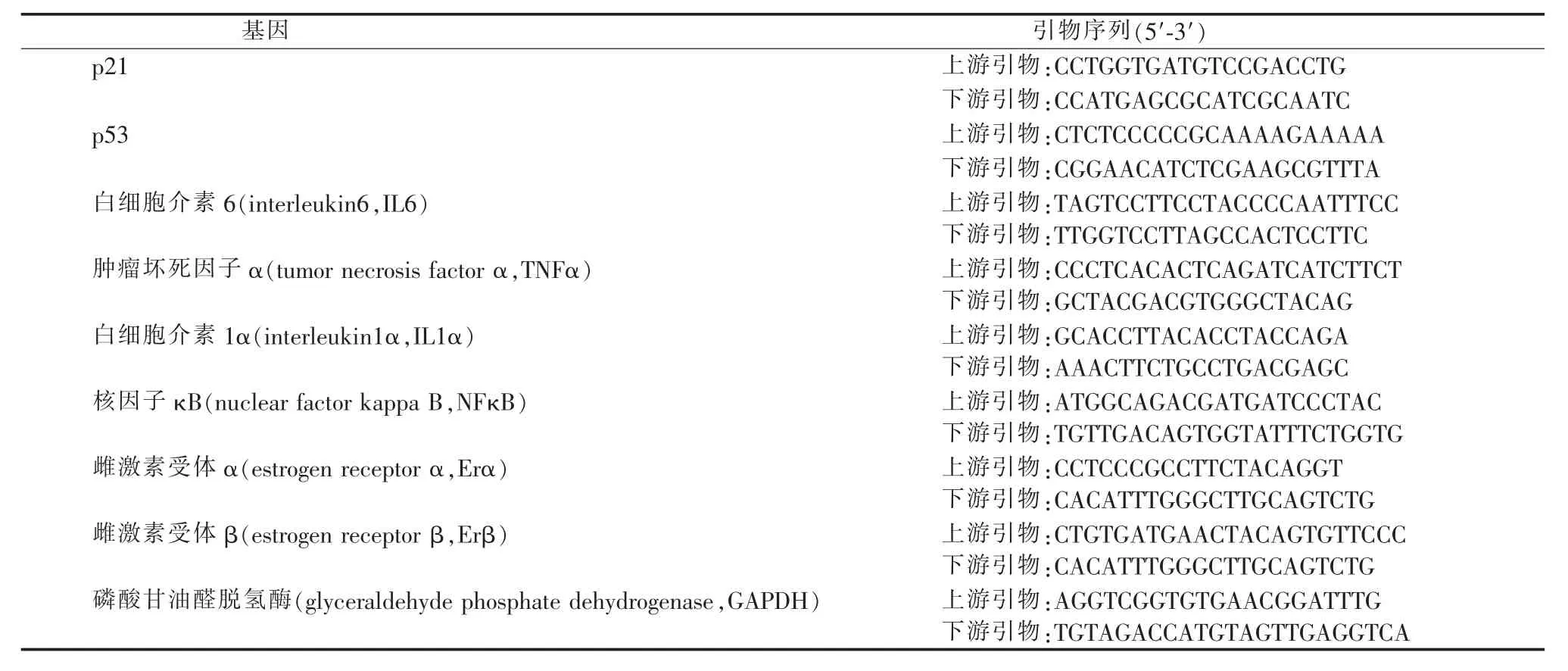
表1 qPCR引物序列表Table 1 Primer sequences of qPCR
1.5 衰老细胞SA-β-gal染色
将BMSCs接种在6孔板上,根据说明书,使用SA-β-gal染色试剂盒(中国碧云天公司)行SA-β-gal染色。4',6-二脒基-2-苯基吲哚(DAPI)(1∶1 000,美国Sigma公司)染色以鉴定SA-β-gal阳性细胞的比例,显微镜下(日本Nikon公司)随机选取5个视野内的图像进行统计分析。
1.6 数据统计分析
在图、表中,数据以平均值±标准差(±s)的形式表示。组间差异用SPSS 24.0软件进行独立样本t检验或卡方检验分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 H2O2诱导以建立BMSCs衰老模型
H2O2诱导可上调BMSCs衰老关键通路p53/p21的基因和蛋白表达水平(图1A、1B)。SA-β-gal染色结果也显示H2O2组较对照组有更多的阳性细胞(图1C)。qPCR结果显示,H2O2组的SASP因子(IL1α、IL6、CXCL15、TNFα、NFκB)表达也显著增加(图1D)。同时,我们应用Western印迹法检测了JAK2/STAT3信号通路的改变,发现JAK2、STAT3的磷酸化水平上调,提示JAK2/STAT3信号通路的激活可能与BMSCs的衰老有关(图1E)。
2.2 雌激素可抑制H2O2诱导的BMSCs衰老
qPCR结果显示,在H2O2+E2组中加入10-7mol/L的E2后,衰老相关基因p53、p21的表达及SA-β-gal阳性细胞比例较H2O2组明显降低(图2A、2B)。同时,SASP因子的转录也因E2的加入而下调(图2C)。在蛋白水平上,p53、p21表达趋势与基因水平相吻合,且JAK2/STAT3在衰老细胞中的激活可被雌激素抑制(图2D)。提示JAK2/STAT3可能是雌激素调控BMSCs衰老的潜在靶点。
2.3 JAK2/STAT3信号通路是雌激素调节BMSCs衰老的靶点
qPCR结果显示,在H2O2+E2组BMSCs中,氟维司群(ICI182,780)可以有效抑制被E2激活的雌激素受体(图3A)。同时,E2对于JAK2/STAT3通路的抑制作用也被ICI182,780废除(图3B)。以上结果说明,JAK2/STAT3是雌激素的下游靶点。
2.4 抑制JAK信号可以缓解H2O2诱导的BMSCs衰老
Western印迹法结果显示,鲁索替尼可有效抑制H2O2刺激下的JAK2/STAT3激活(图4A),且对细胞衰老p53、p21基因的表达有抑制作用(图4B、4C)。SA-β-gal染色的细胞阳性率降低(图4D),SASP因子表达下调(图4E)也证明了JAK信号的抑制可以挽救BMSCs的衰老。
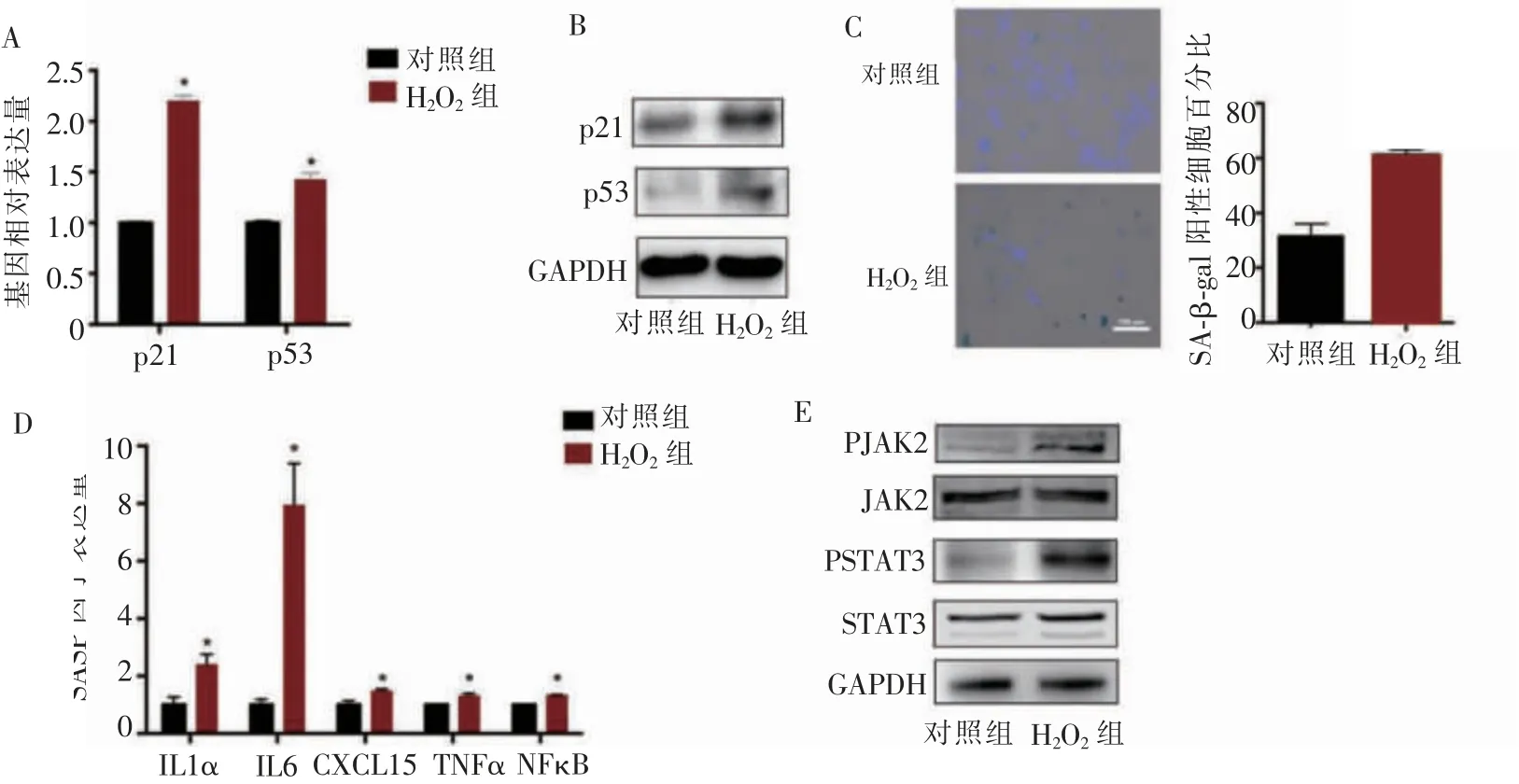
图1 H2O2诱导BMSCs衰老及JAK2/STAT3通路激活Figure 1 H2O2 induced senescence of BMSCs and activation of JAK2/STAT3 pathway
3 讨论
骨质疏松是一种退行性、代谢性疾病,表现为骨量减少、骨微结构改变,伴发骨折等并发症,影响患者生活质量[5]。全身性的骨质疏松会加剧颌骨骨丢失,造成牙齿松动、脱落,给口腔修复及种植带来困难。有研究表明,超过75%的骨质疏松发生于女性[6],而绝经后的骨质疏松又占了较大比例,其骨丢失程度也更为严重[7]。因此,研究雌激素缺乏所导致的骨丢失机制,对于骨质疏松的治疗有重要意义。雌激素是卵巢分泌的激素,其在骨组织中通过与雌激素受体ERα、ERβ相结合,直接调控成骨、破骨基因的表达,从而影响骨稳态。此外,雌激素也能调节多种骨组织细胞的各项生理功能,如衰老、自噬和凋亡等,进而维持骨吸收和骨形成的平衡[8]。雌激素与细胞衰老之间的关系正日益受到关注。
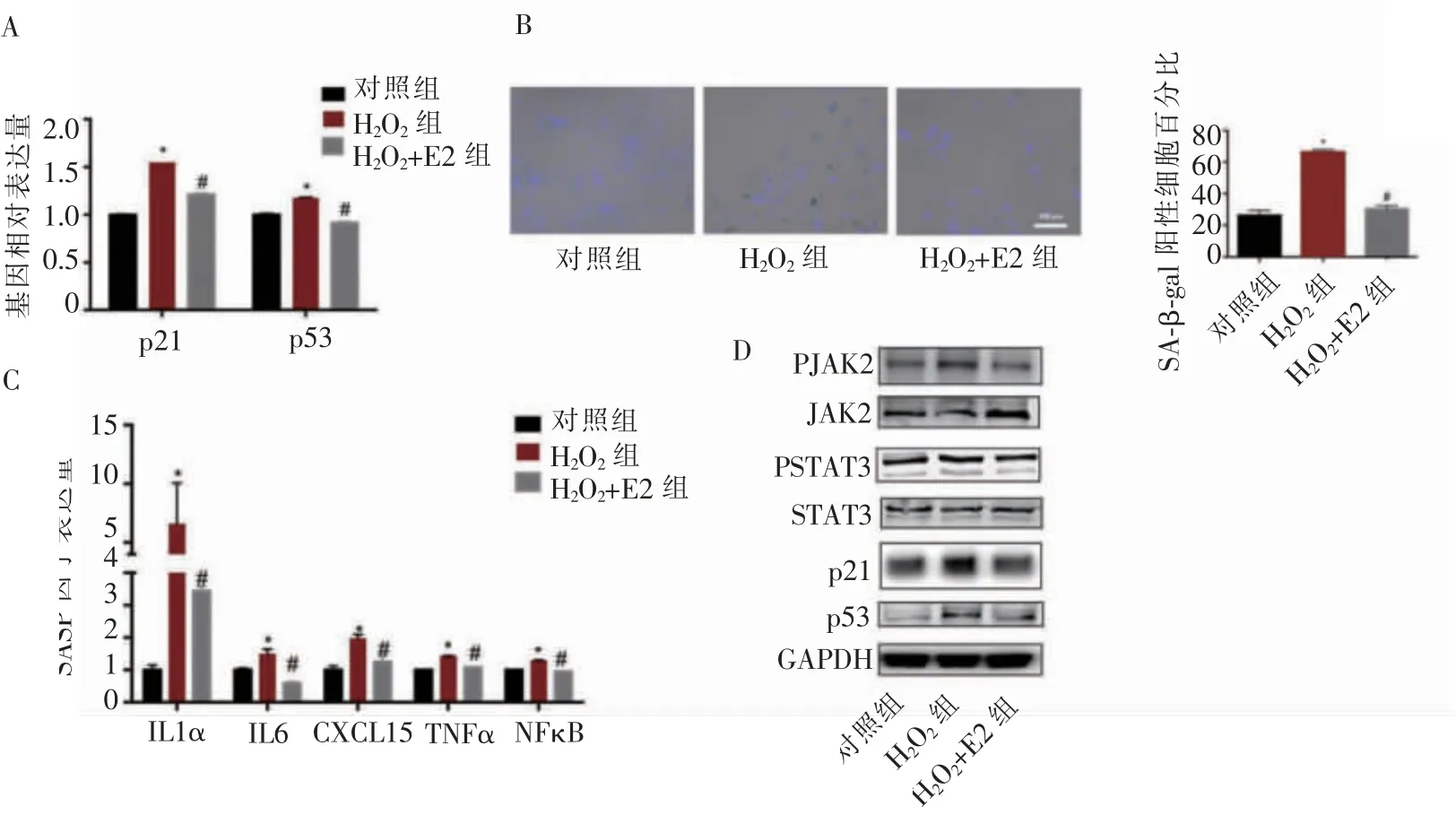
图2雌激素可以挽救H2O2诱导的BMSCs衰老Figure 2 Estrogen rescued H2O2-induced senescence of BMSCs
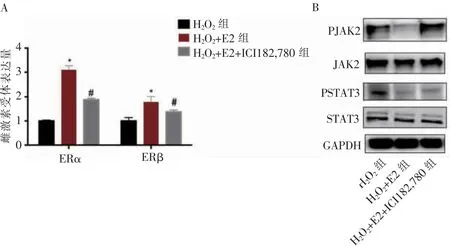
图3雌激素通过JAK2/STAT3影响BMSCs衰老Figure 3 Estrogen affected BMSCs senescence through JAK2/STAT3 signaling
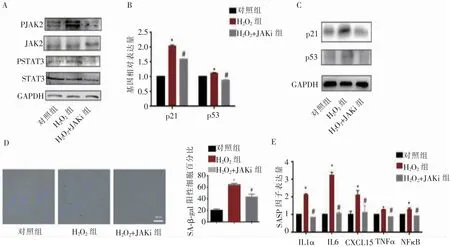
图4抑制JAK2/STAT3可以缓解H2O2诱导的BMSCs衰老Figure 4 Inhibition of JAK2/STAT3 alleviated H2O2-induced BMSCs senescence
细胞衰老是在端粒缩短、氧化应激、DNA损伤等诱因下导致的细胞增殖能力进行性不可逆的丧失[2],即一种持续的细胞周期阻滞。细胞衰老根据诱因不同可以分为复制性衰老、原癌基因诱导的衰老、压力诱导的成熟前衰老等[9]。现有的普遍观点认为,雌激素的缺乏加剧了骨髓微环境中活性氧(reactive oxygen species,ROS)的含量[10]及炎症因子的分泌[11],导致成熟前衰老的发生。为模拟这一现象,我们选用了H2O2作为刺激物。结果显示,成熟前衰老的关键通路p53/p21被激活,SA-β-gal染色阳性细胞增加;而适宜浓度雌激素的加入可以挽救H2O2组的上述衰老改变,证明了雌激素对BMSCs衰老的抑制作用。近年来,雌激素与细胞衰老的关系在多种组织器官中得到证实,如心血管疾病[12]、皮肤老化[13]、神经系统退行性疾病如阿尔茨海默症[14]等。在表皮细胞中,雌激素能缓解细胞的衰老,增加端粒酶的活性[15];在骨组织中,雌激素可能参与了多种骨组织细胞衰老的进程。有报道称,雌激素通过调控ERβ-SATB2的表达调节BMSCs的衰老表型[16]。在本课题前期研究中也发现,雌激素对于成骨细胞和骨细胞的衰老都有抑制作用[17]。但现有的有关雌激素调控骨衰老的研究较少,具体机制仍有待挖掘。
除了对细胞本身稳态的影响,如前所述,雌激素缺乏还会增加诱导衰老的重要因素ROS含量的增加,以及骨髓中炎症因子如IL1α、IL1β、IL7、IL8、TNF-α、巨噬细胞集落刺激因子(macrophage colonystimulating factor,M-CSF)、人巨噬细胞粒细胞集落刺 激 因 子 (human granulocyte-macrophage colony stimulating factor,GM-CSF)等[11]的累积,这些炎症因子会导致内源性骨衰老的发生,最终引起骨稳态的失调[18]。同时,衰老细胞分泌的SASP也加剧了炎症微环境,炎性因子和细胞衰老互为因果[19],形成了炎症因子—细胞衰老—SASP的连锁反馈,加剧了成骨和破骨的失衡。我们发现,H2O2组SASP因子的表达随着衰老基因的上调而上调,且受到雌激素的抑制。因此,阻断以SASP为关键节点的恶性循环可能为骨质疏松的治疗提供新思路。
JAK/STATs信号通路在调节细胞因子的生成中起到重要作用。JAK家族有4个成员:JAK1、JAK2、JAK3和酪氨酸激酶2(tyrosine kinase2,TYK2)。其中JAK1和JAK2涉及炎症信号转导及生长激素和其他内分泌和旁分泌信号的作用[20]。STATs包括STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B及STAT6,是一类经典的转录调节因子。JAK的激活继而激活STATs,使其发生磷酸化修饰后入核,调控目标基因的表达[20]。我们发现,JAK2/STAT3信号通路受雌激素信号调控并与衰老相关通路有同向变化,而雌激素主要通过与雌激素受体ERα、ERβ相结合,调节相应的基因表达而发挥作用。为了进一步探究JAK2/STAT3信号通路与雌激素信号在调控BMSCs衰老时的关系,我们选取ICI182,780来抑制雌激素受体,发现随着雌激素信号的抑制,JAK2/STAT3的磷酸化水平都被重新激活。因此,我们推测JAK2/STAT3是雌激素调控BMSCs衰老的下游靶点。有研究表明,JAK通路抑制剂可以改变衰老肿瘤细胞SASP的分泌,实现对肿瘤细胞的免疫应答[21]。进一步的研究发现,抑制JAK2/STAT3信号通路可以缓解老龄小鼠脂肪前体细胞SASP分泌的情况[22],并对增龄性骨质疏松有一定缓解作用。而且,基于我们前几部分的结果可知,JAK2/STAT3信号通路在雌激素相关的BMSCs衰老中可能也起到了重要作用。因此,明确该通路在雌激素缺乏所致的BMSCs衰老及SASP分泌中的作用对绝经后骨质疏松的治疗有借鉴意义。我们选择鲁索替尼(JAK1/2)选择性抑制剂来进行体外给药[23],发现抑制JAK信号后,SASP分泌减少,BMSCs衰老情况有所减轻。这与先前的文献报道的“JAK的抑制仅能减少SASP分泌,对细胞衰老的相关基因没有影响”的结论有所差异[24]。但也有研究表明p53、p21是STAT3的直接下游靶点[25],且我们认为其抑制了SASP分泌就相当于抑制了衰老的传播,从而导致衰老基因的表达下调。此外,也有报道称JAK2/STAT3与BMSCs的成骨相关,瘦素可以通过激活JAK2/STAT3来增强BMSCs成脂分化,抑制其成骨分化[26]。因此,JAK2/STAT3有望通过靶向细胞衰老及成骨过程成为治疗绝经后骨质疏松的新靶点。
综上所述,JAK2/STAT3通路可以响应雌激素信号挽救BMSCs的衰老,其可能是绝经后骨质疏松治疗的新靶点。
