纯镁载聚乳酸-乙醇酸膜层的体内骨结合与降解行为
2020-10-27郑凯宁李慕勤张二林初明慧
郑凯宁, 肖 月, 李慕勤, 张二林, 姚 潍, 初明慧
(1.黑龙江佳木斯大学附属口腔医院修复科,2.佳木斯大学黑龙江省高校生物医学材料重点研究实验室,3.佳木斯大学生命科学实验中心,黑龙江 佳木斯154007;4.东北大学材料科学与工程学院材料各向异性与织构教育部重点实验室,辽宁 沈阳110004)
目前,临床上多用高分子聚合材料和钛进行 植入和固定。钛的弹性模量过高,与人体骨组织不匹配,易产生应力遮挡效应,影响骨骼的生长和重构[1];而且,由于钛在人体内不能降解,需进行二次手术才能被取出,会对患者造成二次损伤[2]。高分子聚合材料因其较差的机械性能,现多用作骨填充材料。镁与人骨弹性模量相近,且在人体内可自然降解。通过对肾小管再吸收量的控制,可将血镁浓度控制在一定范围内。但镁性质活泼,在生理环境中会快速降解,不能实现与骨的完全愈合[3-5]。因此,如何调控镁降解速率,且促进新骨形成已成为当下医学研究的热点。
微弧氧化(MAO)技术是近年来比较热门的在有色金属表面原位生长氧化物陶瓷层的一项技术[6]。该技术操作简单,能使纯镁具有更好的耐蚀性、耐磨性及更高的显微硬度,是一项常见的医用金属植入体表面生物改性技术[7]。以往实验中多以纯镁微弧氧化来控制镁的降解速率,涂层的骨结合效果有待于提高。聚乳酸-乙醇酸共聚物(PLGA)由2种单体乳酸和羟基乙酸随机聚合而成,是一种可降解的功能高分子有机化合物。它具有良好的生物相容性、合适的机械强度、可控的生物降解性[8],被广泛应用于制药、医用工程材料领域。PLGA可抑制巨噬细胞的浸润,减少炎症反应,这些优点有利于骨再生修复;还可以通过调整单体比,进而改变PLGA的降解时间[9-10]。
针对医用镁合金在体内降解速率过快,降解产物为碱性氧化物,微区碱性过高不利于成骨细胞生长的特点,利用PLGA可将体内降解为酸性。二者结合既可调控镁基体体内降解产物的pH,又能控制镁基体的降解速率,形成互补;加之PLGA具有抗炎及促进骨组织修复的特性,能加快镁基体周围骨组织愈合和骨生长,但该方面的研究鲜有报道。因此,在医用纯镁表面做酸碱糙化处理及强碱活化处理,使纯镁表面羟基化,负载PLGA作为实验组,以目前研究较多的纯镁微弧氧化层为对照组,分析比较二者体内促进骨生长和控制降解速率的差异,期望为可降解医用纯镁的临床应用提供一条新途径。
1 材料和方法
1.1 实验动物
佳木斯大学动物实验中心提供的已适应动物实验房生长环境的24只2~3月龄的家兔,体质量为2.0~2.5 kg。
1.2 实验用品、器材和设备
纯镁螺钉(下文简称为镁钉)共计48枚(长度为7.5 mm,直径为2.5 mm),纯镁接骨板(下文简称为镁板)共计16枚(长度为14 mm,宽度为6 mm,厚度为1.5 mm)(东北大学材料科学与工程学院);PLGA(PLGA中丙交酯与乙交酯比例相同,济南岱罡生物工程有限公司);陆眠宁,2%利多卡因,抗生素(青霉素、庆大霉素),地塞米松,生物清洁工作台(佳木斯大学);牙科微动力低速手机(佳木斯大学医学实验室);MAO-Ⅱ微型氧化电源(哈尔滨工业大学先进表面技术研究中心);环氧乙烷灭菌机(佳木斯大学附属第一医院);CBCT(美国Kodak公司);Leica硬组织切片机(德国徕卡公司);FV1000激光共聚焦显微镜(日本Olympus公司);扫描电子显微镜(日本JEOL公司)。
1.3 试剂制备及分组
1.3.1 PLGA膜层制备 将镁钉放入酒精中消毒,用质量浓度为80 g/L的碳酸氢钠(NaHCO3)溶液对其进行碱处理,时间为10 s,再用100 g/L的磷酸(H3PO4)溶液对其进行酸处理,时间为15 s;蒸馏水清洗后,放入120 g/L的氢氧化钠(NaOH)溶液中以60℃恒温水浴1 h,对螺钉进行羟基活化,再将螺钉放入1% PLGA(1 g PLGA溶于100 mL二氯甲烷)溶液中浸泡提拉1 min,重复浸泡提拉3次后,晾干备用。
1.3.2 MAO膜层制备 将镁钉酸碱处理后,放入硅酸盐电解液中,在电压300 V,脉宽50μs,频率500 Hz,超声波频率60 kHz,超声功率60 W的条件下进行微弧氧化,计时7 min;再将电压调至200 V,计时3 min。
1.3.3 动物分组 将实验动物分为2组,纯镁微弧氧化膜层为对照组(MAO组),纯镁载PLGA膜层为实验组(PLGA组)。将2组表面镀膜的镁钉和镁板进行环氧乙烷灭菌处理后备用。分别于2、4、8、12周时对2组家兔进行相应处理,每个时间点设3只家兔(1~3号),共24只家兔。在1号家兔体内仅植入2个镁钉;将2号和3号家兔分别制作骨折模型,并植入2个镁钉和1个镁板。单笼喂养。
1.3.4 动物手术 将手术家兔逐个称重并记录,按0.2 mL/kg的剂量将陆眠宁肌肉注射于家兔腿部,进行全身麻醉。将家兔仰卧固定在无菌手术台上,头偏向一侧,将手术区域剃毛并用碘伏进行消毒,注射2%利多卡因进行局部麻醉。切开皮肤,做大约2 cm的长切口,用止血钳钝性分离皮下筋膜层,游离皮下肌肉,使用大裂钻定位后,在距下颌骨下缘8~10 mm处植入镁钉,间距为3 mm。用超薄金刚砂片对植入镁钉和镁板的家兔做不穿通口腔的线性骨缺损,在骨折线两端制备2个植入窝洞,植入镁钉并固定镁板,制备骨折模型。制备过程中用0.9%氯化钠溶液降温,在骨面上放置少量青霉素,止血,逐层缝合。
1.3.5 术后护理 为预防感染,术后对家兔注射0.1 mg/kg的地塞米松和0.5 mg/kg的盐酸庆大霉素,每日1次,连续3 d。实验过程中动物无意外死亡,术后每周测量1次体质量。所有家兔愈后良好,未发生感染、过敏、局部产气等情况;精神状态良好,饮食、饮水、大小便均正常。
1.3.6 药物注射 注射荧光素以检测骨生长情况。2周组的家兔在第3天时,注射茜素红,4 d后注射钙黄绿素;4周组在第7天时注射茜素红,7 d后注射钙黄绿素;8周组分别于第14、21天时注射茜素红,14 d后注射钙黄绿素。茜素红的注射剂量为18 mg/kg,注射质量浓度为10 mg/mL,溶剂为0.9%氯化钠溶液。钙黄绿素注射剂量为6 mg/kg,注射质量浓度为10 mg/mL,溶剂为磷酸氢二钠。注射部位均为家兔术侧颈部皮下。
1.4 标本取材及检测
在耳缘静脉处注射空气处死家兔,截取家兔术侧下颌骨,固定于4%中性甲醛中。CBCT检测后,切割成大小为15 mm×12 mm×10 mm的小块,进行梯层脱水、浸润与包埋处理。包埋完成后用硬组织切片机将标本骨块切成厚度为5 mm左右的组织切片,将其手动研磨至厚度为70μm左右,用于扫描电镜、能谱分析、激光共聚焦等检测。
2 结果
2.1 CBCT检测
将截取骨块的下颌升支侧朝下,垂直悬挂于水溶液中,并将其放置于CBCT检测台上,调节检测台高度确定每组观测位置。2、4、8和12周时,MAO组和PLGA组镁钉的CBCT矢状面和横断面影像见图1。2周时,PLGA组纯镁螺钉与骨组织间存在明显的低密度影像;4周和8周时,低密度影像区逐渐被高密度的骨组织充填;12周时,镁钉与骨组织间低密度影像区明显减小。2周和4周时,MAO组钉周低密度影像区较PLGA组略大;8周和12周时,钉周低密度影像区明显增大。随时间的延长,2组的镁钉直径均不断减小,4周时MAO组镁钉直径为2.2 mm,PLGA组镁钉直径为2.4 mm;12周时MAO组镁钉直径为1.9 mm,PLGA组镁钉直径为2.2 mm。在同一时间内,PLGA组较MAO组镁钉周围骨密度高,低密度透射影像范围小,镁钉直径大。说明PLGA组骨结合更好,耐蚀性更佳。
2.2 Micro-CT检测
2组镁基体植入后4和8周的Micro-CT图像见图2。随时间增长,镁钉的螺纹逐渐模糊,镁钉和镁板降解逐渐增多。表1为4、8周时,2组镁钉植入后骨小梁的检测数据。由表中可见,PLGA组骨小梁数量明显多于MAO组,且骨小梁间距小,说明纯镁载PLGA膜层具有更高的成骨活性。图3为各时间段2组镁基体剩余体积柱状图。由图中可见,随时间增长,2组镁基体剩余体积均逐渐减小,但PLGA组剩余体积较MAO组大,且随时间增长2组镁基体剩余体积差值逐渐增大。计算4、8和12周时2组镁基体降解率,MAO组为11.44%、19.58%、36.73%,PLGA组为6.31%、11.63%、16.09%。根据回归方程可计算出MAO组完全降解需8个月,PLGA组完全降解需17个月。该结果说明PLGA涂层有效降低了镁基体的降解速率。

图1 2、4、8和12周时MAO组和PLGA组镁钉的CBCT影像Figure 1 CBCT images showing magnesium implants in MAO and PLGA groups of rabbits at 2,4,8 and 12 weeks

图2 4周和8周时镁钉和镁板的Micro-CT影像Figure 2 Micro-CT images of magnesium implants and magnesium plates at 4 and 8 weeks

图3植入前,术后4、8和12周时2组镁基体的剩余体积Figure 3 Residual volume of magnesium matrix before implantation and 4,8 and 12 weeks after implantation
2.3 激光共聚焦观察
图4是2、4和8周时,2组镁基体的激光共聚焦影像。2周时,MAO组荧光强度微弱,而PLGA组螺钉周围有明显的荧光标记;4周时,MAO组螺钉周围仅有一层稀薄荧光标记,而PLGA组钙黄绿素与茜素红荧光标记在近螺钉处高度重叠,说明4周时PLGA组螺钉周围有大量钙盐沉积和新骨形成;8周时,MAO组荧光强度明显增强,荧光标记范围扩大,PLGA组部分荧光标记已远离螺钉周围,近螺钉处荧光强度减弱。相同时间点时,MAO组荧光强度较弱,荧光条带狭窄,PLGA组荧光强度较强,条带较粗。以上结果说明,相较于MAO组,PLGA组新骨生成更为活跃。
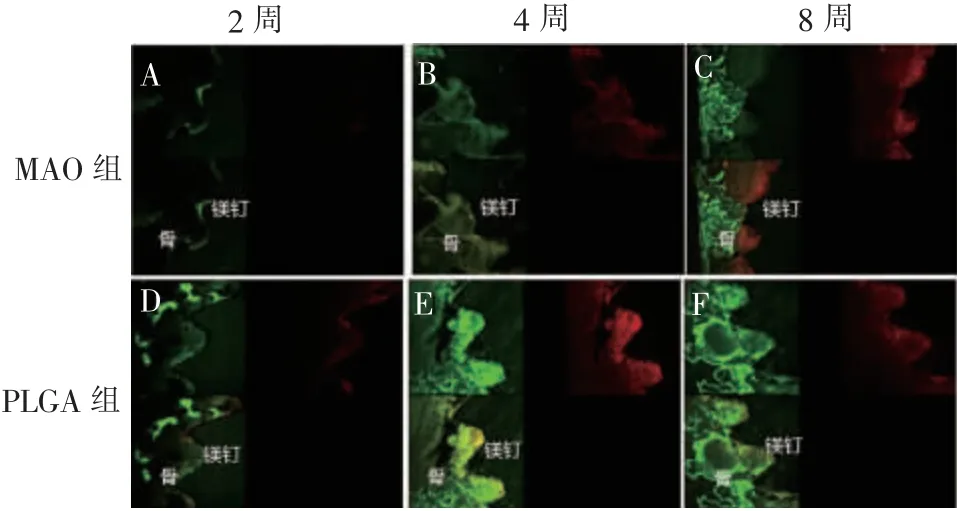
图4 2、4、8周时MAO组和PLGA组镁钉激光共聚焦影像Figure 4 Confocal laser images of magnesium implants in MAO and PLGA groups at 2,4 and 8 weeks
2.4 植体与骨界面扫描电镜形貌和元素分析
图5为2组镁基体植入后4周和8周时的扫描电镜形貌和元素分析。4周时,MAO组涂层已几乎完全消失,附着骨组织稀疏;PLGA组镁钉表面存在清晰且连续一致的涂层,且有薄层新生骨紧密地结合在镁钉螺纹处。8周时,MAO组镁钉严重降解,镁钉螺纹结构消失,新生骨与镁钉间存在明显间隙;PLGA组镁钉螺纹结构仍存在,大量新生骨组织成条带状,且与镁钉紧密相连。从界面元素分布中可以看出,植入界面中出现的元素有Mg、Ca、P,其中Mg为主要元素,并从镁基体向骨组织方向扩散。MAO组4和8周时,骨组织处均有散在Mg元素;PLGA组仅在8周时,骨组织处可见少量Mg元素。界面处可见大量Ca、P元素,MAO组4周时Ca、P元素稀薄,8周时Ca、P元素增加,但与镁钉存在间隙;PLGA组4周时有少量Ca、P元素沉积在涂层表面,8周时,Ca、P元素富集成带并与镁钉表面紧密贴合,镁钉降解部分被Ca、P元素充填。以上结果说明PLGA组骨结合更好,镁钉降解少。
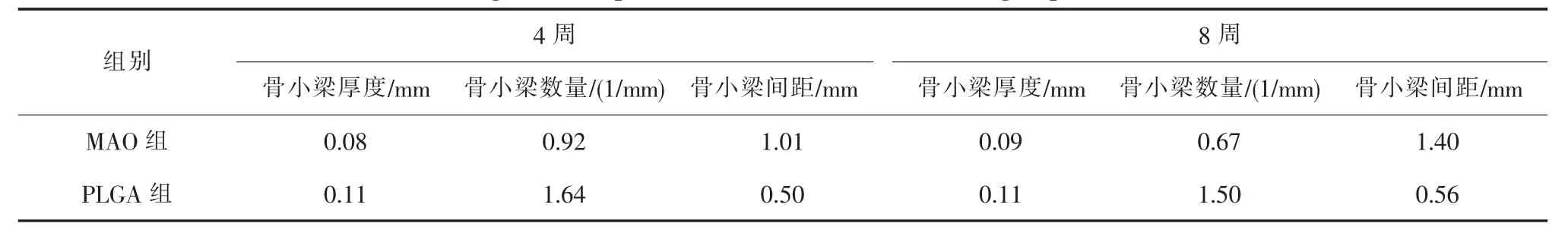
表1 4、8周时2组镁钉的骨小梁数据Table 1 The magnesium implants trabecular bone data of two groups at 4 and 8 weeks

图5 MAO组和PLGA组4、8周时镁钉扫描电镜形貌及元素分析Figure 5 Morphology characterization and element analysis by SEM of magnesium implants in MAO and PLGA groups at 4 and 8 weeks
3 讨论
在医用金属中,镁及镁合金具有与人骨最为相近的弹性模量,并能自行降解。镁具有良好的骨诱导性,局部富含Mg2+的环境可以刺激骨髓干细胞分化为成骨细胞,并促进成骨细胞黏附、生长和增殖,从而加快骨愈合速度[11]。但镁元素化学性质活跃,其被植入后常未能达到良好的生理性骨愈合,就已丧失负载能力而早早降解。研究表明,镁基体快速降解会产生大量氢气和碱性氧化物,使局部pH上升,导致骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)过量分泌,进而激活破骨细胞,发生溶骨[12]。利用微弧氧化技术可在镁基体表面形成一层致密的氧化膜,该技术是目前常用的一种镁基体表面改性技术。PLGA由乳酸和羟基乙酸2种单体复合共聚而成,具有良好的亲水性和可降解性,PLGA降解产生的乳酸和乙醇酸能中和局部pH,促进骨生长。
本研究中,CBCT结果显示,PLGA组较MAO组骨密度大,低密度影像小,说明纯镁载PLGA膜层与骨生长速度更匹配。4、12周时,PLGA组镁钉直径均>MAO组,证明PLGA膜层耐蚀性更佳;8、12周时,MAO组镁钉周围低密度影像明显增大,可能是由于微弧氧化涂层降解后,镁基体快速降解产气,阻碍了骨组织的愈合。Micro-CT结果显示,4、8周时,PLGA组较MAO组骨小梁数量多,骨小梁间距小,证明PLGA膜层较微弧氧化膜层周围骨组织形成更多。2组8周时较4周时骨小梁数量少,骨小梁间距大,说明8周时镁钉周围的骨组织正在向成熟骨转变。一般初期骨痂愈合时间为2个月,8周时PLGA组镁基体形态基本完整,可认为纯镁载PLGA膜层可在下颌骨内承担2个月的固定作用。根据回归方程估算,MAO组镁钉完全降解需8个月,PLGA组完全降解需17个月。结果证明,相比微弧氧化涂层,PLGA涂层更有效地降低了镁基体的降解速率。黄晶晶等[13]发现,在镁基体表面浸涂PLGA可有效提高其在体外模拟环境中的耐蚀性,结果与本文一致。本研究中的激光共聚焦结果显示,随时间增长,2组荧光标记范围逐渐变大,荧光强度变强;但PLGA组荧光强度明显强于MAO组,荧光条带也更粗,结果证明PLGA膜层具有更强的促新骨形成能力。8周时,PLGA组部分荧光标记远离螺钉周围,螺钉周围荧光强度减弱,说明PLGA组8周时螺钉周围已形成成熟骨组织。这可能是由于镁基体与PLGA膜层同时降解,镁基体降解产生的碱性氧化物被PLGA降解产生的酸性产物中和,同时降解的镁元素促进了骨组织修复。陈伟等[14]用油浴法和萃取法制备Mg-PLGA复合材料,发现降解过程中其pH基本正常,佐证了此观点。扫描电镜和元素分析结果显示,PLGA膜层可促进新骨形成并延缓镁基体降解,同时与骨组织紧密贴合,提高了骨结合强度,促进Ca、P元素沉积。
目前国内外的镁基体材料多以微弧氧化法、离子注入等表面改性技术提高镁基体的耐蚀性,但对镁基体降解时pH的调控鲜有研究[15]。本研究通过纯镁表面羟基活化载PLGA,对镁基体降解时的pH进行调控,并利用PLGA可控的降解速率控制镁基体的降解速率,使之与骨的生长速度相匹配。
综上所述,纯镁羟基活化载PLGA膜层明显降低了镁基体的降解速率,提高了镁基体的耐蚀性,并且诱导新骨形成,促进骨结合,为镁的临床应用提供了一条新途径。但有关此膜层的制备方法还需进一步研究。
