去铁胺对糖尿病大鼠心肌细胞铁死亡通路的影响
2020-10-26李浩甲杨文曲韩冲芳贺建东王文杰任鹏鹏
李浩甲 杨文曲 韩冲芳 贺建东 王文杰 任鹏鹏
EffectofDeferoxamineonFerroptosisofMyocardialCellinDiabeticRats.LiHaojia,YangWenqu,HanChongfang,etal.DepartmentofAnesthesiology,ShanxiMedicalUniversity,Shanxi030001,China
AbstractObjectiveTo investigate the effect of deferoxamine on ferroptosis of myocardial cell in diabetic rats.Methods24 male SD rats weighing 240-290g were randomly divided into 3 groups (n=8 each):Group N was continuously feeded by normal fodder for 4 weeks; group D was induced via intraperitoneal injection of streptozotocin (STZ)55mg/kg and fed by normal fodder for 4 weeks; group C was induced by injection of streptozotocin (STZ)55mg/kg and DFO 0.2mg/g during the forth week. The weight and blood glucose were monitored in rats on 1st, 3rd, 10th, 17th, 24th and 31st days. The blood was taken for test of cTnI on 31st day. The pathological changes were observed by HE staining and Prussian blue staining. Western blot was used to determine the expression of microtubule associated protein 3 Ⅱ(LC3Ⅱ), ferritin heavy chain (FTH) and nuclear receptor coactivator 4(NCOA4).ResultsCompared with group N, the blood glucose level increased, the body weight decreased in group D and C; the expression of cTnI, FTH, NCOA4 and LC3Ⅱwere significantly up-regulated in the group D. Compared with group D, the expression of cTnI, FTH, NCOA4, LC3Ⅱand blood glucose on 31st day were down-regulated in the group C. The iron content was less in group C.ConclusionDesferrioxamine treatment for 1 week could decrease the level of blood glucose, decrease the concentration of cTnI, inhibit the expression of NCOA4 in myocardial cell, inhibit the ferroptosis pathway, and alleviate the injury of myocardial cell.
KeywordsDeferoxamine; Diabetic; Ferroptosis
糖尿病患者往往伴随多器官功能的下降,高血糖造成的血管内皮细胞和心肌细胞的损伤增加了糖尿病患者心血管疾病的风险[1]。有研究发现,铁过载激活的铁死亡通路与糖尿病心肌细胞损伤密切相关[2]。去铁胺是一种铁螯合剂,结合游离Fe3+形成络合物随尿液排出体外,去铁胺可以降低糖尿病大鼠体内铁含量,改善胰岛素抵抗,减轻糖尿病心肌损伤,但具体机制尚未完全清楚[3,4]。核受体共同激活因子4(NCOA4)在铁死亡通路中介导细胞内铁蛋白自噬,导致铁离子增多,引发细胞损伤[5]。本研究推测去铁胺可能通过抑制NCOA4的表达,起到心肌保护的作用,通过观察去铁胺对糖尿病大鼠心肌细胞铁死亡通路的影响,探讨去铁胺改善糖尿病心肌损伤的机制。
材料与方法
1.实验材料:体质量240~290g的健康成年雄性SD大鼠24只,由山西医科大学实验动物中心提供;链脲佐菌素(STZ)(美国Sigma公司);注射用甲磺酸去铁胺(诺华制药有限公司);铁蛋白重链(FTH)、核受体共同激活因子4(NCOA4)、微管相关蛋白3(LC3Ⅱ)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国ABclonal公司。
2.实验分组:大鼠适应1周后,采用数字表法随机将其分为3组(n=8):正常组(N组): N组大鼠在禁食8h后经腹腔注射10ml/kg枸橼酸钠缓冲液。普通饲料喂养,饮水饲料供应充足,保持垫料干燥;糖尿病组(D组):大鼠在禁食8h后,采用头低位腹腔注射STZ 55mg/kg,浓度10mg/ml,其他条件同N组;去铁胺处理组(C组):采用与D组相同的方法制备糖尿病模型,于第24天开始每日腹腔注射去铁胺0.2mg/g,浓度50mg/ml,持续1周。3组大鼠于注射当天、第3天、10天、17天、24天、31天监测日间随机血糖和体质量。
3.血浆cTnI测定:于建模后第31天,采用断尾法采血2.5ml,收集于抗凝采血管中,4℃离心机12000r/min离心10min,取约1ml血浆,使用全自动动物血液生化仪测血浆cTnI浓度。
4.病理学染色:采血后采用脊椎脱臼法处死大鼠,取心脏组织,0.9%氯化钠溶液冲洗后置于-80℃度冰箱冷冻5min。垂直于心脏长轴切成厚4mm的标本,经过固定、脱水、透明、石蜡包埋、切片,制成4μm厚标本切片。HE染色采用苏木精染液染色5min,伊红染液染色1min制备;普鲁士蓝染色采用普鲁士蓝染液染色30min,核固红染液染色10min,之后透明、封片。
5.Western blot法检测:每只大鼠的心肌取500g组织,加入RIPA裂解液10μl/mg和PMSF蛋白酶抑制剂0.1μl/mg,提取总蛋白。每份样品取50μg,选择12% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),进行湿法转膜。37℃脱脂牛奶封闭2h,分别加入铁蛋白重链单克隆抗体(FTH,1∶1000);核受体共同激活因子4单克隆抗体(NCOA4,1∶1000);微管相关蛋白3单克隆抗体(LC3Ⅱ,1∶1000)和内参抗-甘油醛-3-磷酸脱氢酶单克隆抗体(GAPDH,1∶1000)孵育过夜。洗膜后加入HRP二抗山羊抗兔(1∶1000)孵育2h,自动曝光仪曝光显影。采用Image J软件测定条带灰度值,以目的条带灰度值与GAPDH灰度值的比值反映表达。

结 果
1.大鼠基本情况的变化:3组大鼠基础体质量、基础血糖值比较,差异无统计学意义(P>0.05);与N组比较,D组、C组在注射STZ第3天、10天、17天、24天、31天监测日间随机血糖明显升高(P<0.05),D组、C组体质量在第17天、24天、31天明显降低(P<0.05,表1、表2)。

表1 3组大鼠随机血糖值比较
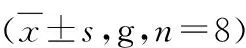
表2 3组大鼠体质量变化比较
2.大鼠心肌细胞铁蛋白自噬相关蛋白变化:与N组比较,D组和C组大鼠血清cTnI含量增加,D组心肌细胞LC3Ⅱ、FTH、NCOA4表达增多,C组心肌细胞FTH、LC3Ⅱ、NCOA4含量降低(P<0.05);与D组比较,C组大鼠血清cTnI含量降低,心肌细胞FTH、LC3Ⅱ、NCOA4含量降低(P<0.05,表3)。
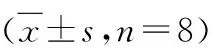
表3 3组大鼠cTnI浓度、LC3Ⅱ、FTH、NCOA4比较
3.大鼠心肌病理学改变:光镜下可见N组心肌细胞形态正常,普鲁士蓝染色显示细胞内有少量含铁小粒;D组心肌纤维排列松散,细胞肿胀,胞质染色加深,细胞内有较多含铁小粒;C组心肌细胞结构较完整,胞质染色较均匀,但细胞间连接不紧密,出现少量空泡,与D组比较,C组含铁小粒明显减少(图1、图2)。
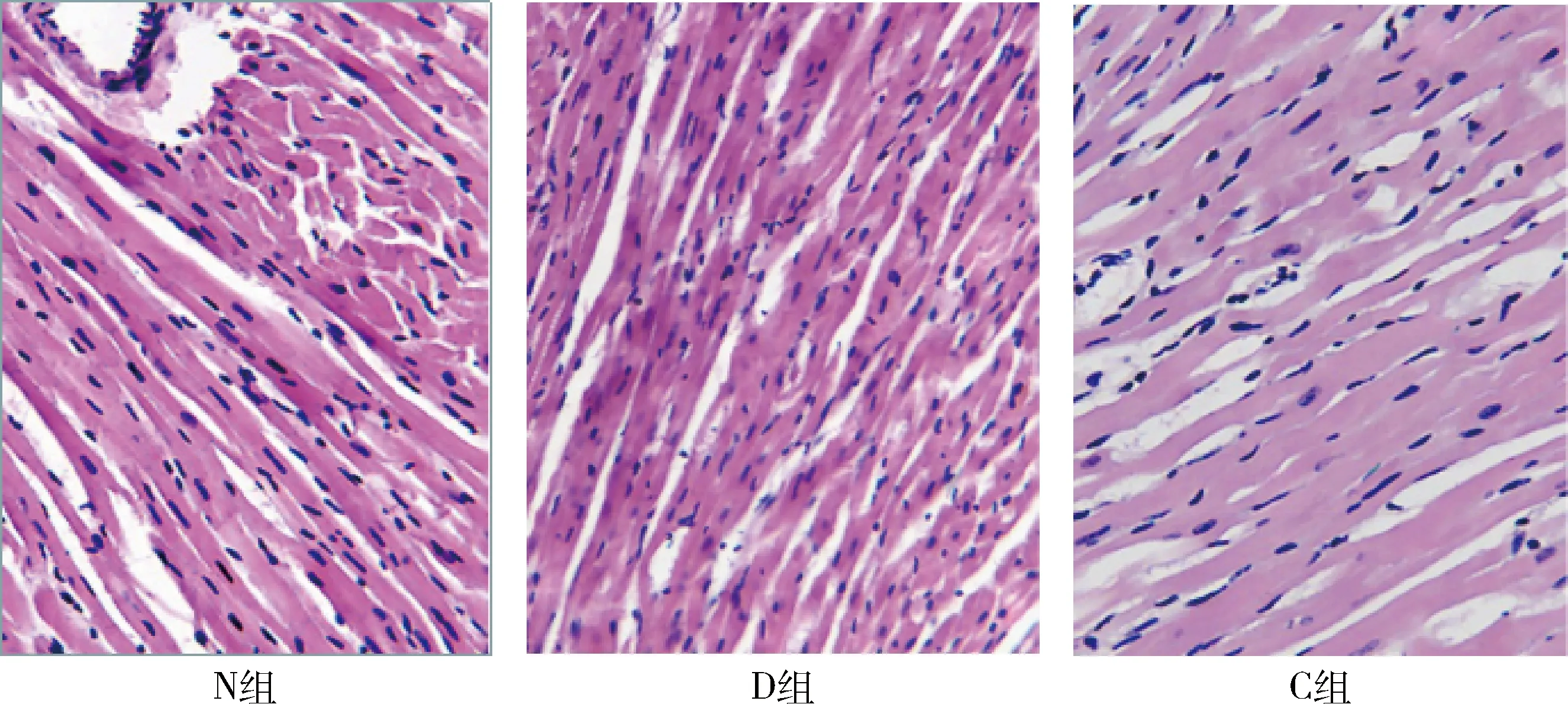
图1 心肌组织HE染色(×200)

图2 心肌组织普鲁士蓝染色(×400)为含铁小粒
讨 论
STZ通过破坏大鼠胰岛β细胞,造成胰岛素分泌不足,制备糖尿病大鼠模型。本研究选择单次腹腔注射STZ 55mg/kg,注射STZ 3天后,D组和C组静脉血糖值均>16.7mmol/L,且出现多饮、多食、多尿、体质量减轻的表现,表明成功制备糖尿病大鼠模型。参照文献[6],C组采用腹腔注射去铁胺0.2mg/g连续1周的方法处理糖尿病大鼠,C组cTnI浓度、随机血糖值下降,心肌细胞损伤减轻,说明去铁胺对糖尿病大鼠有一定的器官保护作用。
研究表明,铁蛋白自噬增强是促进糖尿病发生的重要途径之一[7]。有6.6%的2型糖尿病患者中伴随高铁蛋白血症,升高的铁蛋白与胰岛素抵抗相关,而不是与胰岛素产生相关[8]。铁蛋白自噬增强,释放出游离的铁离子,加速细胞内氧化应激的发生[9]。NCOA4介导的铁蛋白自噬是铁死亡通路的重要组成部分,它可以特异性识别铁蛋白重链,并连接自噬体上的LC3,在溶酶体完成铁蛋白自噬,游离的铁离子释放到胞质中,通过芬顿反应促进细胞内氧自由基损伤,特别是细胞器膜脂质分子受到氧自由基攻击后形成脂质过氧化物,影响细胞器功能、激活凋亡通路等[10,11]。本研究中D组大鼠NCOA4、FTH、LC3Ⅱ表达增加,cTnI浓度升高,心肌细胞含铁小粒数量增加,提示糖尿病组心肌细胞内铁蛋白自噬增加,细胞损伤加重。
去铁胺作为一种铁螯合剂,临床上主要用于治疗地中海贫血,输血引起的铁负荷过重,可以结合Fe3+形成水溶性络合物,并随尿液排出体外[12]。有研究显示,去铁胺在改善糖尿病胰岛素抵抗、减轻心肌细胞损伤中发挥重要作用,但其中的机制仍不明确[13,14]。本研究中C组大鼠在注射去铁胺1周后,心肌细胞NCOA4、FTH、LC3Ⅱ表达降低,血糖水平也比D组降低,说明去铁胺的作用可能与抑制细胞内铁蛋白自噬通路有关。虽然去铁胺处理后血糖水平未恢复正常,但是大鼠心肌细胞损伤明显减轻。张东等[15]研究发现,采用去铁胺20mg/(kg·d)干预糖尿病大鼠2个月,血糖水平仍高于正常,但是可以在一定程度上减轻糖尿病大鼠骨质疏松的形成。
综上所述,去铁胺可以抑制糖尿病大鼠心肌细胞内NCOA4的表达,抑制铁蛋白自噬,减轻铁死亡,降低血糖水平和cTnI浓度,起到心肌保护的作用。本研究为糖尿病的临床治疗提供了新思路。
