熊果酸对人肝癌HepG2细胞凋亡及PI3K/Akt信号通路的影响
2020-10-26宗彦红霍丽静
宗彦红 霍丽静 常 胜
EffectsofUrsolicAcidonApoptosisandPI3K/AktSignalingPathwayofHumanHepatomaHepG2Cells.ZongYanhong,HuoLijing,ChangSheng.HebeiGeneralHospital,Hebei050051,China
AbstractObjectiveTo investigate the effect of Ursolic Acid (UA) on the apoptosis of human liver cancer HepG2cells and its possible molecular mechanism.MethodsThe DMSO (blank control group), UA (10, 20, 40μmol/L) and LY294002 (PI3K-specific inhibitor) 10nmol/L were used to intervene HepG2cells in the growth phase. 48h after the drugs were given, the proliferation inhibition rate of the HepG2cells was detected by MTT method, the apoptotic status was analyzed by Annexin Ⅴ-FITC/PI double staining and the apoptotic rate was calculated. The expression of PI3K, p-PI3K, Akt, p-Akt, caspase-9, cleaved caspase-3, Bax, Bcl-2, p-JNK, CHOP proteins were detected by Western blot.ResultsCompared with blank control group, being intervened by UA 10, 20, 40μmol/L or LY294002 10nmol/L could increase the proliferation inhibition rate and apoptosis rate of HepG2cells (P<0.01), being intervened by UA 20, 40μmol/L or LY294002 10nmol/L could down-regulate the expression of p-PI3K, p-Akt, Bcl-2 and up-regulate the expression of caspase-9, cleaved caspase-3, Bax, p-JNK, CHOP (P<0.05), increase the ratio of Bax/Bcl-2 (P<0.01). Compared with LY294002 10nmol/L group, being intervened by UA 40μmol/L could down-regulate the expression of p-PI3K, p-Akt, and up-regulate the expression of cleaved caspase-3, Bax, p-JNK, CHOP (P<0.05), increase the ratio of Bax/Bcl-2 (P<0.01).ConclusionUA can promote the apoptosis of human liver cancer HepG2cells, inhibit the activation of PI3K/Akt signaling pathway, thus to activate the endoplasmic reticulum stress apoptotic pathway and up-regulate the expression of downstream pro-apoptotic proteins, which may be its important molecular mechanisms.
KeywordsUrsolic acid; Liver cancer; Apoptosis; PI3K/Akt;Endoplasmic reticulum stress
全球每年新发肝癌病例超过100万,其中42.5%分布在我国,我国肝癌病死率约20/10万,居恶性肿瘤致死率第3位[1]。随着医疗技术的发展,手术切除并辅以放化疗、生物治疗等成为临床治疗肝癌的常规方案,但5年生存率仍不足40%[2]。因此探索新型高效的抗肝癌药物仍是目前的研究热点。
熊果酸(ursolic acid,UA)是广泛存在于熊果、女贞子、野蔷薇果、白花蛇舌草、车前草、山楂等天然药物中的一种五环三萜类化合物,具有抗氧化、抗炎、调脂等多种生物学活性[3,4],近年来其抗肿瘤活性得到广泛关注,已研究发现UA能够通过抑制肿瘤细胞增殖并促进细胞凋亡对肺癌、胃癌、结肠癌细胞等生长起到抑制作用[5]。本课题组研究YAP1、β-Catenin在肝癌疾病发生及进展过程中的作用,二者对磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)通路活性具有抑制作用,而PI3K/Akt通路对细胞凋亡具有关键性的调控作用,因此本研究将基于PI3K/Akt信号通路探讨UA对人肝癌HepG2细胞凋亡的影响及机制[6~8]。
材料与方法
1.药物与试剂:熊果酸(纯度≥98%)购自上海源叶生物科技有限公司;LY294002购自美国Sigma公司;DMSO、DMEM培养基、胎牛血清、Annexin Ⅴ-FITC/PI凋亡试剂盒购自南京凯基生物科技发展有限公司;MTT试剂盒购自美国Sigma公司;PI3K、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)、caspase-9、激活型caspase-3(cleaved caspase-3)、Bcl-2、Bax、c-Jun氨基端激酶(p-JNK)、C/EBP同源蛋白(CHOP)抗体购自上海碧云天生物技术有限公司。
2.细胞:人肝癌HepG2细胞株购自中国科学院细胞库,复苏并重悬后接种于含10%胎牛血清和双抗(100U/ml青霉素、链霉素)DMEM培养基,置于5% CO2、37℃培养箱中培养,取对数生长期HepG2细胞进行实验。设空白对照组(DMSO)、UA(10、20、40μmol/L)和LY294002 10nmol/L实验组[9,10]。
3.细胞增殖抑制率的测定:以0.25%胰酶消化对数生长期HepG2细胞制备浓度5×104个/毫升的单细胞悬液,转移至96孔板(100微升/孔),置于细胞培养箱培养至贴壁生长后,分别以DMSO、UA(10、20、40μmol/L)或LY294002 10nmol/L进行干预,每组设10个复孔,48h后加入5mg/ml浓度的MTT溶液(20微升/孔),置培养箱继续培养4h后,加入DMSO(150微升/孔)避光震荡10min后通过酶标仪测定490nm处吸光度值(A490nm),增殖抑制率(%)=(1-实验组A490nm/空白对照组A490nm)×100%
4.细胞凋亡分析:以0.25%胰酶消化对数生长期HepG2细胞制备浓度5×104个/毫升的单细胞悬液,转移至6孔板(100微升/孔),置细胞培养箱培养至贴壁生长后,分别以DMSO、UA(10、20、40μmol/L)或LY294002 10nmol/L进行干预,每组设10个复孔,48h后经0.25%胰酶消化后离心(r=10cm、1500r/min、5min)取细胞,洗涤后置70%乙醇固定1h,按照Annexin Ⅴ-FITC/PI试剂盒操作说明处理后,通过流式细胞仪分析细胞凋亡状况并计算凋亡率。
5.细胞蛋白表达检测:以0.25%胰酶消化对数生长期HepG2细胞制备浓度5×104个/毫升的单细胞悬液,转移至6孔板(100微升/孔),置细胞培养箱继续培养至贴壁生长后,分别以DMSO、UA(10、20、40μmol/L)或LY294002 10nmol/L干预,每组设10个复孔,48h后,经4℃离心(r=10cm、1500r/min、5min)后取细胞,加入冷裂解液后置冰上裂解40min,经4℃离心(r=10cm、12000r/min、15min)取上清,检测总蛋白浓度后95℃高温变性,上样(40μg总蛋白)、SDS-PAGE胶电泳、转PVDF膜,置5%脱脂牛奶溶液于室温封闭1h,滴加PI3K、p-PI3K、Akt、p-Akt、caspase-9、cleaved caspase-3、Bcl-2、Bax、p-JNK、CHOP、β-actin一抗后4℃冰箱孵育过夜,洗膜后滴加二抗室温孵育1h,洗膜后滴加DAB显色剂;以β-actin为内参,通过条带灰度值半定量目标蛋白表达量。

结 果
1. UA对人肝癌HepG2细胞增殖抑制率的影响:与空白对照组比较,发现经UA 10、20、40μmol/L或LY294002 10nmol/L干预能显著提高HepG2细胞增殖抑制率(P<0.01);与LY294002 10nmol/L组比较,UA 40μmol/L组细胞增殖抑制率明显升高(P<0.05,图1)。
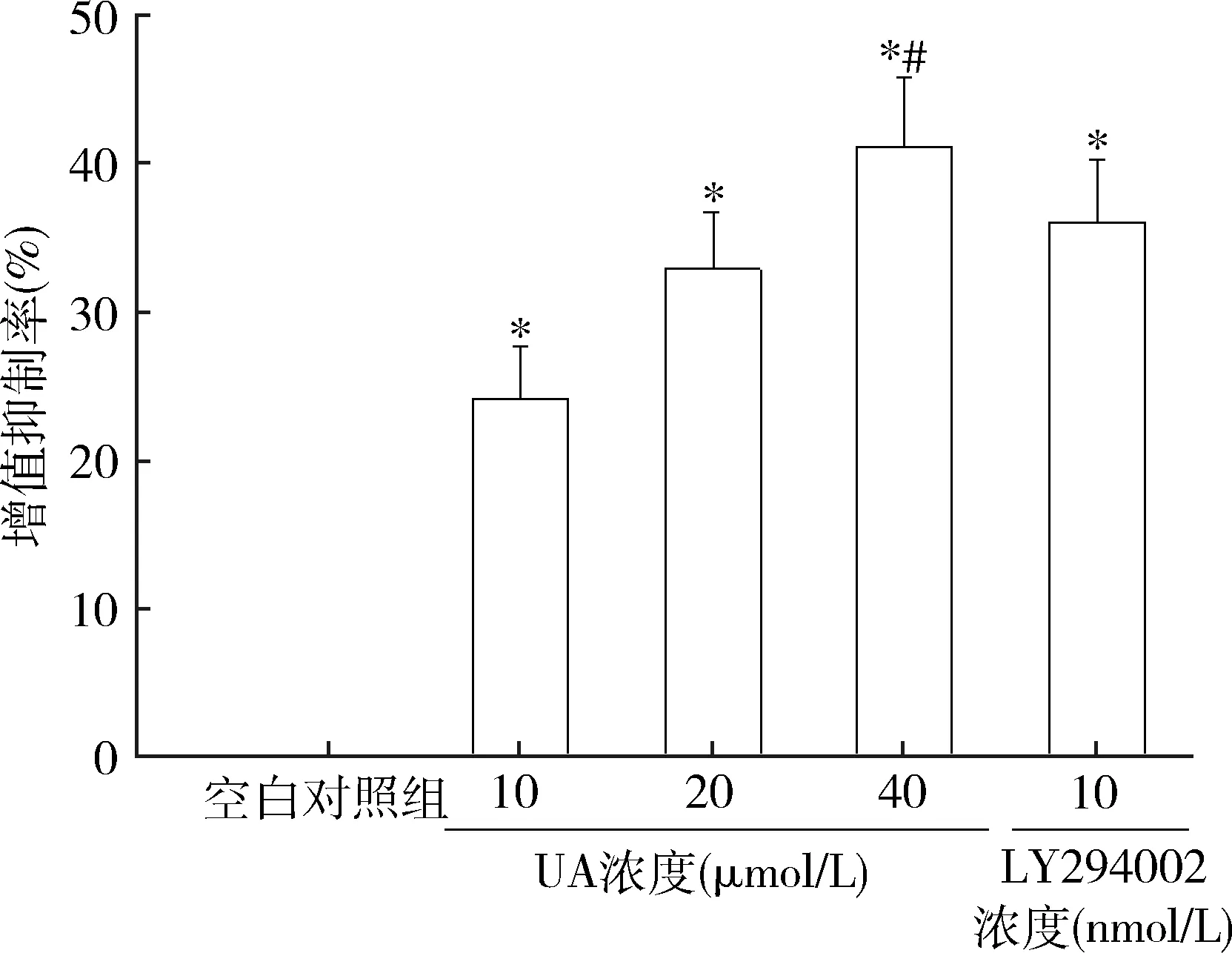
图1 各组人肝癌HepG2细胞增殖抑制率与空白对照组比较,*P<0.01;与LY294002 10nmol/L组比较,#P<0.05
2.UA对人肝癌HepG2细胞凋亡的影响:与空白对照组比较,发现经UA 10、20、40μmol/L或LY294002 10nmol/L干预能显著提高HepG2细胞凋亡率(P<0.01);与LY294002 10nmol/L组比较,UA 40μmol/L组细胞凋亡率明显升高(P<0.05,图2、图3)。

图2 UA对人肝癌HepG2细胞凋亡的影响A.空白对照组;B.UA 10μmol/L组;C.UA 20μmol/L组;D.UA 40μmol/L组;E.LY294002 10nmol/L组
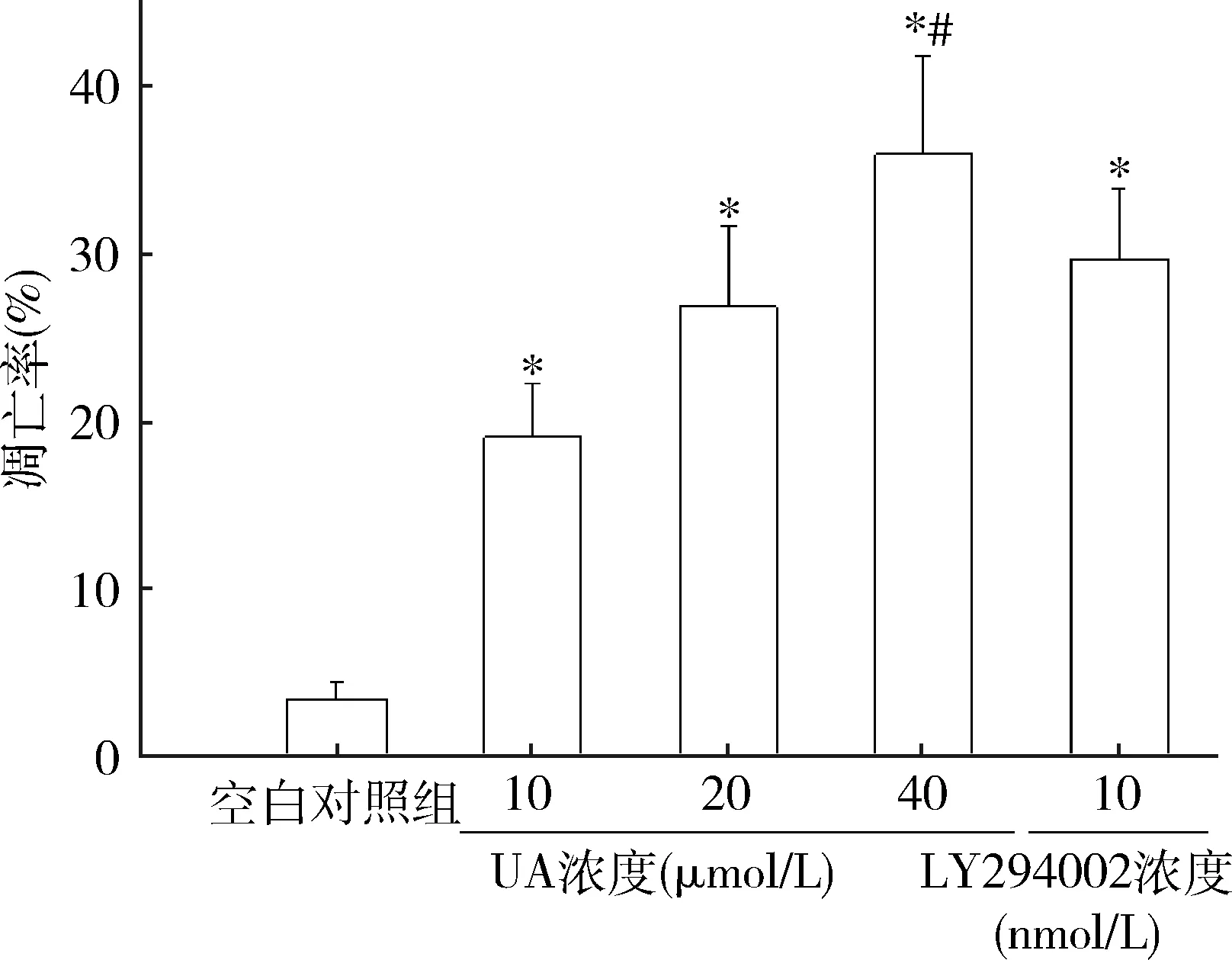
图3 各组人肝癌HepG2细胞凋亡率与空白对照组比较,*P<0.01;与LY294002 10nmol/L组比较,#P<0.05
3.UA对人肝癌HepG2细胞PI3K、p-PI3K、Akt、p-Akt蛋白表达及PI3K、Akt磷酸化比值的影响:与空白对照组比较,发现经UA 20、40μmol/L或LY294002 10nmol/L干预能够明显下调HepG2细胞p-PI3K、p-Akt表达(P<0.05),降低PI3K、Akt磷酸化比值(p-PI3K/PI3K、p-Akt/Akt);与LY294002 10nmol/L组比较,UA 40μmol/L组p-PI3K、p-Akt表达下调且PI3K、Akt磷酸化降低(P<0.05,图4、图5)。
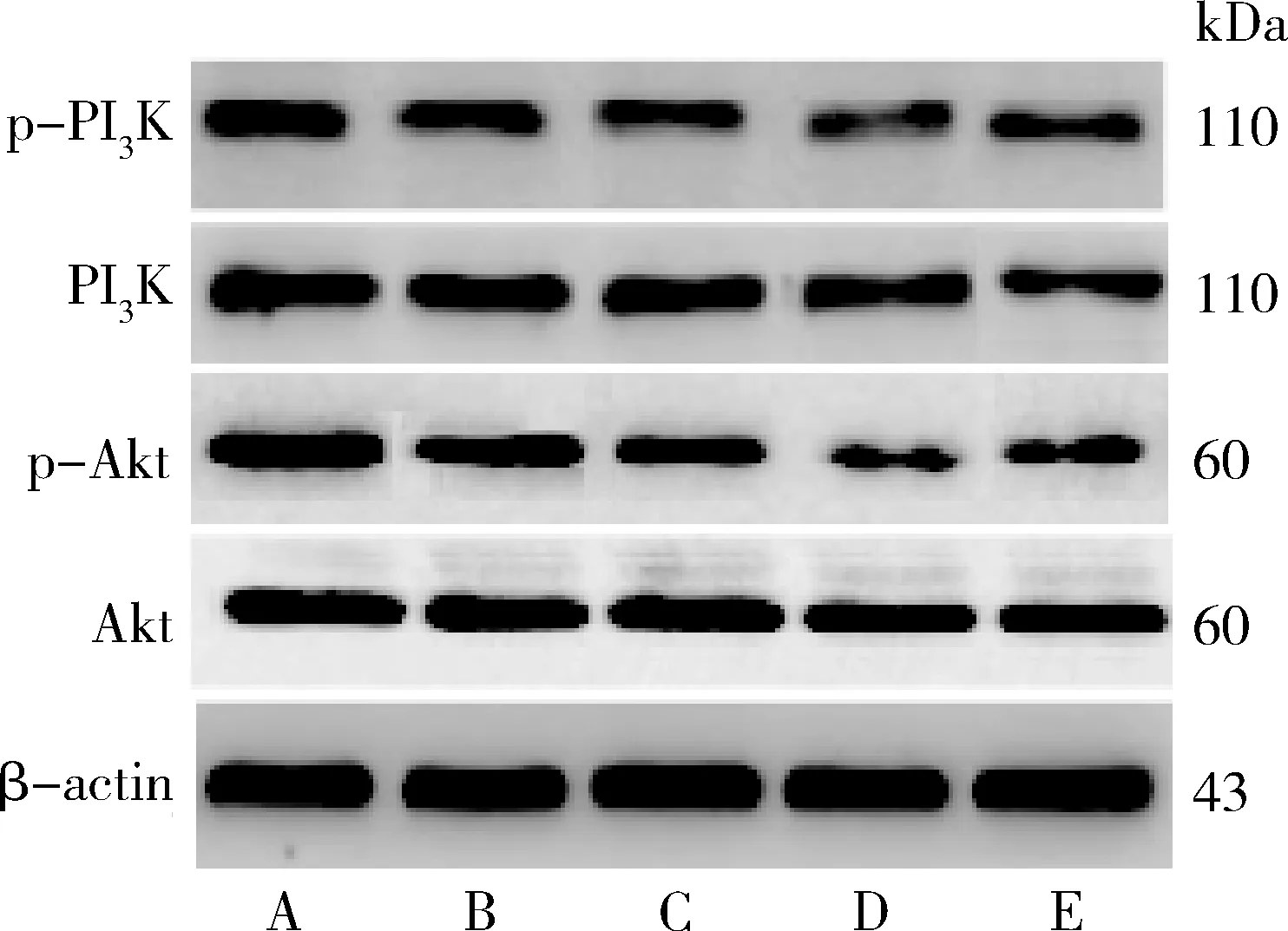
图4 UA对人肝癌HepG2细胞PI3K、p-PI3K、Akt、p-Akt蛋白表达的影响A.空白对照组;B.UA 10μmol/L组;C.UA 20μmol/L组;D.UA 40μmol/L组;E.LY294002 10nmol/L组

图5 各组人肝癌HepG2细胞PI3K、p-PI3K、Akt、p-Akt蛋白相对表达量及PI3K、Akt磷酸化比值与空白对照组比较,*P<0.05, **P<0.01;与LY294002 10nmol/L组比较,#P<0.05, ##P<0.01
4.UA对人肝癌HepG2细胞caspase-9、cleaved caspase-3、Bcl-2、Bax蛋白表达及Bax/Bcl-2比值的影响:与空白对照组比较,发现经UA 20、40μmol/L或LY294002 10nmol/L干预能够明显上调HepG2细胞caspase-9、cleaved caspase-3、Bax表达并下调Bcl-2表达(P<0.05),显著提高Bax/Bcl-2比值(P<0.01);与LY294002 10nmol/L组比较,UA 40μmol/L组cleaved caspase-3、Bax表达明显上调(P<0.05或P<0.01),两组间caspase-9、Bcl-2表达比较差异无统计学意义(P>0.05),Bax/Bcl-2比值显著升高(P<0.05,图6、图7)。
5.UA对人肝癌HepG2细胞p-JNK、CHOP表达的影响:与空白对照组比较,发现经UA 20、40μmol/L或LY294002 10nmol/L干预能够明显上调HepG2细胞p-JNK、CHOP蛋白表达(P<0.01);与LY294002 10nmol/L组比较,UA 40μmol/L组p-JNK、CHOP表达明显上调(P<0.01,图8、图9)。
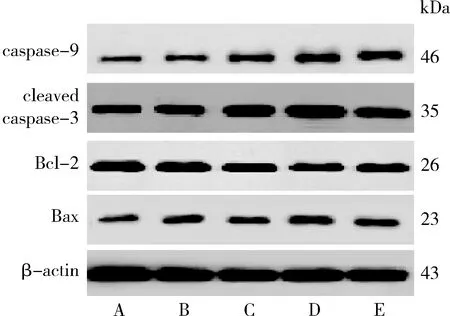
图6 UA对人肝癌HepG2细胞caspase-9、cleaved caspase-3、Bcl-2、Bax蛋白表达的影响A.空白对照组;B.UA 10μmol/L组;C.UA 20μmol/L组;D.UA 40μmol/L组;E.LY294002 10nmol/L组

图7 各组人肝癌HepG2细胞caspase-9、cleaved caspase-3、Bcl-2、Bax蛋白相对表达量及Bax/Bcl-2比值与空白对照组比较,*P<0.05, **P<0.01;与LY294002 10nmol/L组比较,#P<0.05, ##P<0.01
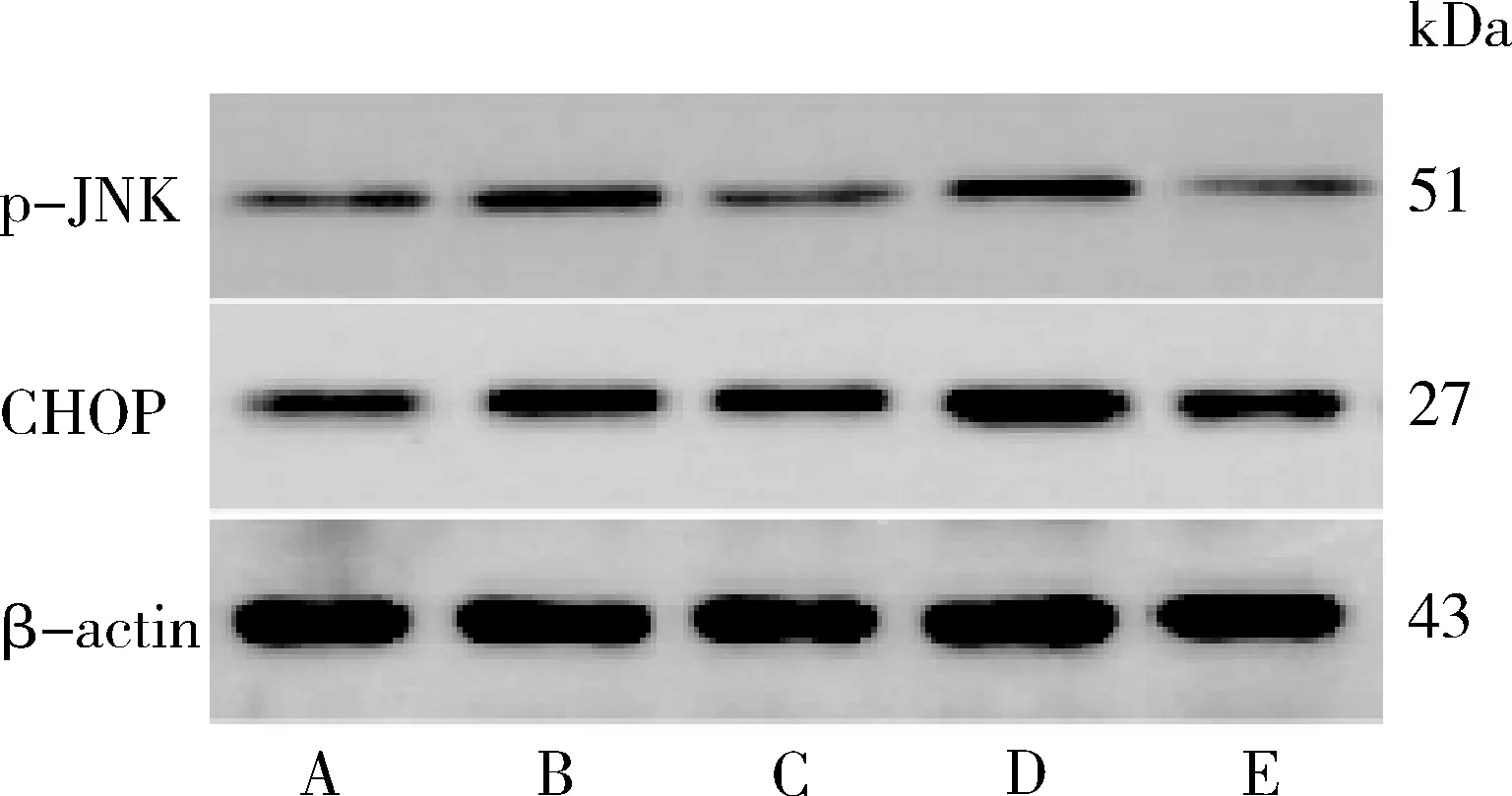
图8 UA对人肝癌HepG2细胞p-JNK、CHOP表达的影响A.空白对照组;B.UA 10μmol/L组;C.UA 20μmol/L组;D.UA 40μmol/L组;E.LY294002 10nmol/L组
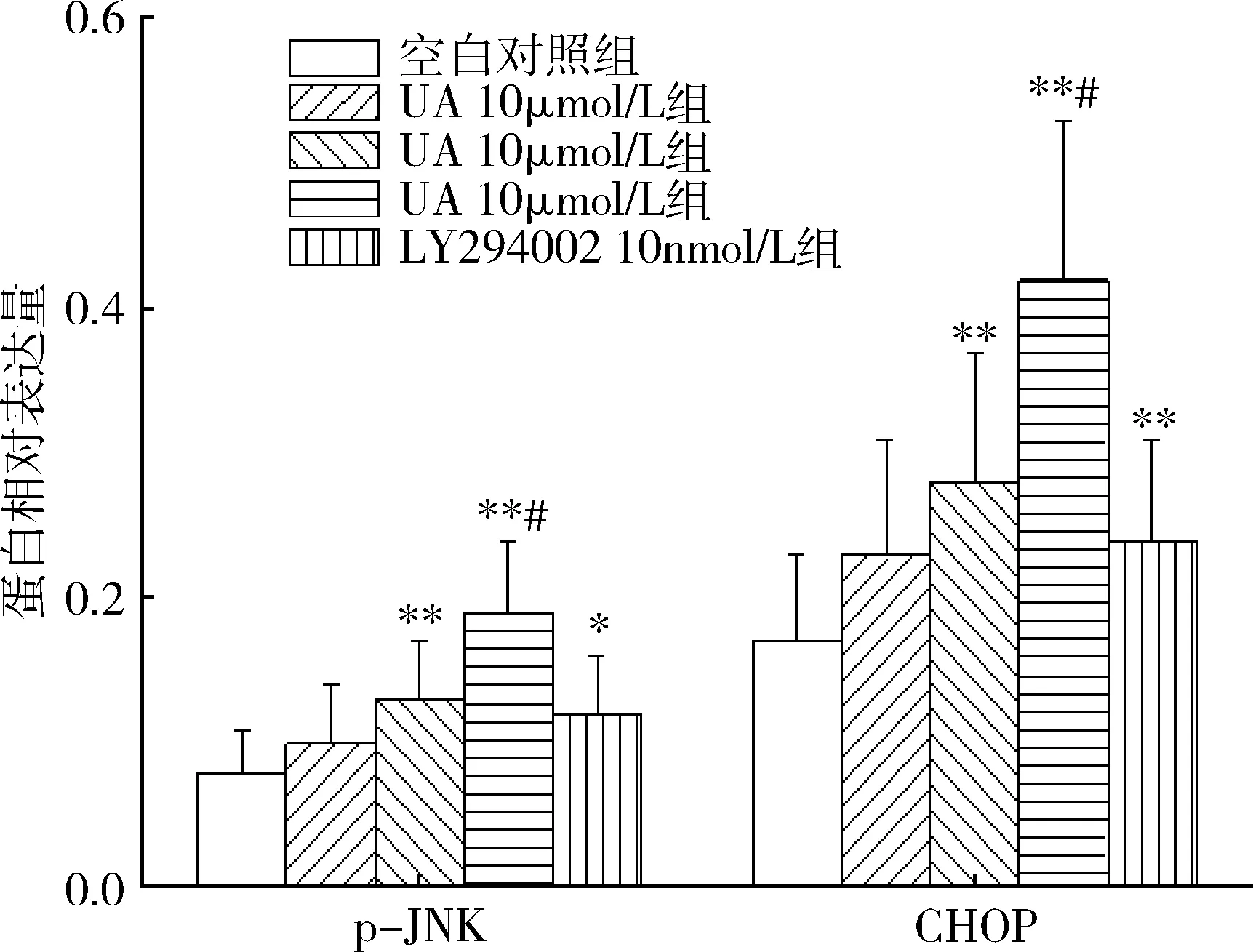
图9 各组人肝癌HepG2细胞p-JNK、CHOP蛋白相对表达量与空白对照组比较,*P<0.05, **P<0.01;与LY294002 10nmol/L组比较,#P<0.01
讨 论
肝癌在中医属“臌胀”、“黄疸”、“肝积”等范畴,正气虚损、蕴结于肝、血行不畅、形成痞块为其主要病理。随着我国振兴中医药战略的实施与中药现代化研究的深入,中药抗肿瘤具有整体调理、标本兼治的独特优势[11]。UA是广泛存在于熊果、女贞子、车前草等中药中的一种具有广泛抗肿瘤活性的五环三萜类化合物,诱导细胞凋亡是其主要作用机制之一。本研究发现,经UA或LY294002干预能够明显提高HepG2细胞增殖抑制率和凋亡率,UA 40μmol/L组效果优于LY294002 10nmol/L组,提示UA能够促进HepG2细胞凋亡并抑制其增殖。
细胞凋亡是一种主动性的程序化死亡过程,是由多种信号通路和蛋白参与调控的复杂过程,其中caspase家族和bcl-2家族蛋白发挥着至关重要的作用[12]。caspase-9具有促凋亡作用并且能够激活caspase-3,cleaved caspase-3参与细胞凋亡的启动与执行等全过程;Bcl-2和Bax为bcl-2家族成员,Bcl-2蛋白位于线粒体膜,能够保护线粒体膜通透性而抑制细胞色素C释放,抑制caspase-9、caspase-3活化等表现出抗凋亡作用;Bax则能够破坏线粒体膜而导致细胞色素C释放,进而激活caspase-9、caspase-3而诱导细胞凋亡。此外,Bax能够与Bcl-2形成异源二聚体而抑制彼此活性,所以Bax/Bcl-2比值能够反映二者对细胞凋亡的调控作用[13]。CHOP和JNK是内质网应激通路介导细胞凋亡的信号分子,CHOP具有促细胞凋亡活性,p-JNK能够诱导促凋亡蛋白Bim表达并且抑制Bcl-2活性而发挥促凋亡作用[14,15]。
PI3K/Akt信号通路对细胞凋亡发挥着重要调控作用[16,17]。Akt是PI3K的下游基因,能够被p-PI3K诱导磷酸化(p-Akt)而激活,p-Akt能够诱导caspase-9磷酸化而失活,阻断caspase-3被caspase-9激活,并且p-Akt能够诱导Bax表达,抑制CHOP、JNK表达和活化而抑制内质网应激通路[18~20]。本研究发现,经UA或LY294002干预能够明显下调HepG2细胞p-PI3K、p-Akt表达,降低PI3K、Akt磷酸化,上调caspase-9、cleaved caspase-3、Bax表达并下调Bcl-2表达,提高Bax/Bcl-2比值,并且UA 40 μmol/L组对p-PI3K、p-Akt、cleaved caspase-3、Bax表达和PI3K、Akt磷酸化及Bax/Bcl-2比值的调控作用优于LY294002 10nmol/L组,提示UA诱导HepG2细胞凋亡可能与抑制PI3K/Akt信号通路有关。
综上所述,UA能够促进人肝癌HepG2细胞凋亡,抑制PI3K/Akt信号通路而导致其下游促凋亡蛋白表达上调、内质网应激通路活化可能是其重要的分子机制。
