lnc-HOTAIRM1 RT-qPCR检测在APL治疗中的临床应用价值
2020-10-26杨慧洁张佳丽虞莉莎殷雪瑞郑晓群陈占国
杨慧洁 张佳丽 虞莉莎 殷雪瑞 郑晓群 陈占国
ClinicalValueofQuantitativeDetectionoflnc-HOTAIRM1RT-qPCRintheTreatmentofAPL.YangHuijie,ZhangJiali,YuLisha,etal.DepartmentofLaboratoryMedicine,TheSecondAffiliatedHospitalofWenzhouMedicalUniversity,Zhejiang325000,China
AbstractObjectiveTo establish a real-time quantitative PCR (RT-qPCR) method for the quantitative peripheral blood (PB) lnc-HOTAIRM1, and to explore its clinical application value in the treatment of APL.MethodsThe expression of NB4 cell line induced by ATRA was analyzed. The amplification system and amplification conditions of RT-qPCR were optimized, and the PB lnc-HOTAIRM1 RT-qPCR detection method was established. Finally, the clinical value of PB lnc-HOTAIRM1 detection in monitoring APL treatment was evaluated.ResultsThe lnc-HOTAIREM1 RT-qPCR amplification system and amplification conditions were successfully optimized. The relative expression of lnc-HOTAIREM1 increased gradually with the increase of ATRA-induced differentiation time in NB4 cell line (P<0.05). In RT-qPCR detection for clinical PB samples, the relative expression level of lnc-HOTAIREM1 in APL group was lower than that in non-APL group and normal control group (P<0.01). Compared with APL before treatment, the relative expression of lnc-HOTAIREM1 in APL after treatment was significantly up-regulated (P<0.01).ConclusionThere were differences in the expression of PB lnc-HOTAIREM1 among APL group, non-APL group and normal control group. lnc-HOTAIREM1 was associated with APL induced differentiation, and the expression of lnc-HOTAIREM1 in APL after treatment was significantly up-regulated. The established RT-qPCR for the quantitative detection of PB lnc-HOTAIREM1 can be used for the differential diagnosis and minimal residual leukemia (MRD) assessment for APL patients.
KeywordslncRNA;Acute promyelocytic leukemia;RT-qPCR; Treatment
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)发病凶险且病死率高,早期诊断和及时治疗可降低病死率并提高治愈率[1]。目前全反式维甲酸(all-trans-retinoic acid,ATRA)和三氧化二砷(arsenic trioxide,ATO)在APL靶向治疗中得到较好的应用,但仍有部分APL患者产生治疗耐药[2~5]。因此APL患者需长期地进行微小残留白血病(minimal residual disease,MRD)监测以期早期发现白血病耐药或复发[6]。临床普遍采用基于骨髓PML-RARɑ融合基因实时荧光定量PCR(reverse transcription-quantitative polymerase chain reaction,RT-qPCR)检测来反映APL患者的MRD状态,然而骨髓穿刺具有创伤性,APL治疗期间反复进行骨髓穿刺会增加患者痛苦且存在感染风险。因此在APL治疗过程中,很有必要找到能替代骨髓PML-RARɑ进行MRD监测的分子标志物。
在APL靶向治疗过程中,针对治疗方案的选择、疗效评估、MRD监测及继发耐药监测,外周血是骨髓的最佳替代。因此,寻找无创的外周血分子标志物迫在眉睫。长链非编码RNA(long noncoding RNAs,lncRNA)在APL细胞分化中发挥重要的调控作用,可作为反映APL治疗的分子标志物[7~9]。研究表明,HOXA转录本反义RNA髓样特异性1(HOTAIRM1)为上调的lncRNA与APL细胞分化相关,但外周血lnc-HOTAIRM1作为分子标志物的临床应用价值尚不清楚[10]。本研究拟通过ATRA诱导NB4细胞株分析lnc-HOTAIRM1表达规律,并建立外周血lnc-HOTAIRM1 RT-qPCR检测方法,最后评价外周血lnc- HOTAIRM1 RT-qPCR检测在APL治疗中的临床应用价值。
对象与方法
1.研究对象:本研究共收集60例于笔者医院初诊为急性白血病的临床样本,其中APL 30例,非APL(急性淋巴细胞白血病和除APL以外的急性髓细胞白血病)30例。所有病例中,男性38例,女性22例,患者年龄3~78岁,中位年龄为49岁。同时收集30例年龄与性别匹配的正常对照样本。分别留取APL治疗前和治疗完全缓解后的EDTA抗凝全血标本,另外留取其余研究对象的EDTA抗凝全血标本,所有全血标本经红细胞裂解后TRIzol冻存。所有白血病诊断采用WHO2016 AML分型标准,APL治疗参照最新的NCCN指南。研究对象纳入标准:①初诊APL患者未接受任何诱导分化治疗;②正常对照排除血液系统疾病无合并其他恶性肿瘤。排除标准:①未明确诊断患者;②APL治疗未参照最新NCCN指南的患者。所收集患者样本与所有患者签订书面知情同意书,获得了温州医科大学附属第二医院医学伦理学委员会的许可。
2.主要仪器和试剂:ABI 7500实时荧光定量PCR仪(美国ABI公司)、人急性早幼粒细胞白血病细胞株NB4(由温州医科大学附属第一医院惠赠)、引物及MGB探针(上海奕跃生物科技有限公司)、ATRA(美国Sigma 公司)、RevertAid First Strand cDNA Synthesis Kit(美国Thermo Scientific公司)、TaqMan Universal PCR Master Mix Ⅱ, no UNG(美国ABI公司)、红细胞裂解液(美国Solarbio公司)、RPMI1640 细胞培养液(美国Gibco 公司)、胎牛血清(杭州四季青公司)、白血病PML-RARɑ融合基因检测试剂盒(上海源奇公司)。
3.引物和MGB探针:由上海奕跃生物科技有限公司合成,引物和探针序列见表1。

表1 HOTAIRM1和人GAPDH的引物与探针序列
4.外周血标本的处理:取1~2 ml外周血标本,3500r/min离心5min后弃血浆,加入等量的0.9%氯化钠溶液,充分混匀后移至15ml离心管,加入10ml红细胞裂解液进行红细胞裂解。严格按照说明书操作,得到细胞沉淀,确保没有红细胞,若有红细胞再裂解1次。在细胞沉渣中加入1ml TRIzol振荡混匀,让细胞充分溶解移至2ml细胞冻存管,室温放置5min,最后于-80℃冰箱暂时保留或直接用于下一步的总RNA提取。
5.细胞培养:NB4细胞株培养于1640培养基(含10%灭活胎牛血清、1%双抗),置于37℃、5%CO2、饱和湿度的培养箱内培养。
6.ATRA诱导细胞实验:实验细胞数2×106/ml,ATRA药物干预终浓度10-6mol/L。以不加药的细胞悬液为对照,每瓶细胞悬液含量均为10ml。实验组(含10-6mol/L终浓度ATRA的细胞悬液)分为实验组0h、实验组24h、实验组48h和实验组72h,对照组(不添加ATRA诱导分化剂)分为对照组0h、对照组24h、对照组48h和对照组72h。将细胞培养瓶放置37℃、5%CO2培养箱分别避光培养0、24、48、72h后,将细胞悬液1000r/min 离心 5min,取200μl 0.9%NaCl溶液洗涤沉淀后的细胞悬液进行涂片,剩余细胞用TRIzol冻存。
7.lnc-HOTAIRM1以及内参基因GAPDH RT-qPCR扩增条件优化:同一反应条件均重复3次,每次设置水空白、阴性对照和阳性对照。扩增条件优化时根据美国Applied Biosystems公司提供的说明书,采用20μl 反应体系,程序:UNG酶激活50℃ 2min,预变性95℃ 10min,变性95℃ 15s,退火温度梯度58℃、59℃、60℃和61℃ 60s,循环数45。确定退火温度后,探针浓度分别取50、300和900nmol/L;引物浓度分别取50、300和900nmol/L,通过正交试验,比较扩增曲线和CT值,确定最佳引物探针浓度。
8.RT-qPCR检测细胞株及临床标本lnc-HOTAIRM1的表达规律:将TRIzol法提取的总RNA进行反转录后,以cDNA为模板利用优化后的最终反应条件进行RT-qPCR反应,同时设置水空白、阴性对照和阳性对照。
9.骨髓PML-RARɑ融合基因检测:采用上海源奇公司的白血病PML-RARɑ融合基因检测试剂盒检测骨髓PML-RARɑ表达,严格按照说明书操作。
10.统计学方法:应用 SPSS 22.0统计学软件对数据进行统计分析,基因相对表达量应用GraphPad 5.0做图,基因分析结果采用内参基(GAPDH)校正lnc-HOTAIRM1的相对表达量,采用2-△△Ct表示。用Wilcoxon秩和检验分析基因的差异性表达[11],lnc-HOTAIRM1的相对表达量和PML-RARα相关性分析采用Spearman秩相关法,以P< 0.05为差异有统计学意义。
结 果
1.TaqMan探针法lnc-HOTAIRM1反应条件优化结果:RT-qPCR体系20μl,程序:预变性95℃ 10min;变性95℃ 5s,退火温度梯度57℃、59℃、60℃和61℃,延伸时间为60s,循环数45。将基线调成一致后,结果显示,退火温度59℃和60℃时扩增曲线呈“S”形趋势,59℃时荧光值较高、CT值较小,扩增曲线见图1,故选择59℃作为最终的退火温度。
图1 HOTAIRM1反应条件优化结果RT-qPCR扩增曲线图A、B、C、D分别代表退火温度为58 ℃、59 ℃、60 ℃和61 ℃的扩增曲线;ΔRn.荧光值
2.TaqMan探针法GAPDH反应条件优化结果:根据Applied Biosystems公司提供的说明书,扩增体系20μl,程序:预变性95℃ 10min;变性95℃ 5s,退火温度梯度58℃、59℃、60℃和61℃,延伸时间为60s,循环数45。将基线调成一致后,退火温度58℃、59℃以及60℃时扩增曲线呈“S”形趋势,59℃时荧光值较高、CT值较小,扩增曲线见图2,故选择59℃作为最终退火温度。

图2 GAPDH反应条件优化结果RT-qPCR扩增曲线图A、B、C、D分别代表退火温度为58℃、59℃、60℃和61℃的扩增曲线;ΔRn.荧光值
3.RT-qPCR最终体系:综合对lnc-HOTAIRM1和 GAPDH的扩增条件及扩增体系优化结果分析,同时考虑实验操作的简便性,最终确定优化条件和优化体系结果。lnc-HOTAIRM1和 GAPDH的优化结果统一为体系20μl:模板2μl、TaqMan Universal PCR Master MixⅡ, no UNG(2×) 10μl、上下游引物(10μmol/L) 0.6μl、MGB探针(10μmol/L) 0.4μl、无酶水6.4μl。程序:预变性95℃ 10min;变性95℃ 5s,退火59℃ 60s,循环数45。
4.NB4 细胞株中lnc-HOTAIRM1的相对表达量:NB4细胞株经ATRA诱导分化24、48和72h后,lnc-HOTAIRM1的相对表达量随着诱导时间的增加而增加,分别是对照组的1.60倍、3.16倍和5.13倍,与对照组0h比较呈现上调趋势(图3),各个时间点与对照组比较差异均有统计学意义(P<0.01)。

图3 经ATRA诱导后NB4 细胞株中lnc-HOTAIRM1的表达情况*P<0.01
5.lnc-HOTAIRM1在APL及非APL和正常对照中的表达结果:APL治疗前外周血lnc-HOTAIRM1的相对表达量较非APL低(P<0.01);APL治疗前外周血lnc-HOTAIRM1的相对表达量较正常对照低(P<0.01)。比较治疗APL治疗前后的外周血标本,APL治疗后完全缓解外周 lnc-HOTAIRM1的相对表达量远高于APL治疗前外周血lnc-HOTAIRM1的相对表达量(P<0.01,图4)。

图4 lnc-HOTAIRM1在APL和非APL、APL和正常对照、APL治疗前后的表达情况NAPL.ALL和除APL以外的AML;APL.治疗前急性早幼粒细胞白血病患者;APL-CR.治疗后完全缓解的急性早幼粒细胞白血病患者;*P<0.01
6.APL患者治疗前后外周血lnc-HOTAIRM1与骨髓PML-RARα相关性分析:APL患者治疗前后外周血lnc-HOTAIRM1与其对应的骨髓PML-RARα/ABL检测结果呈负相关(P=0.000,r=-0.98),线性方程为y=-0.089x+0.614。APL患者外周血lnc-HOTAIRM1相对表达量越高,骨髓PML-RARα/ABL的值越小(图5)。
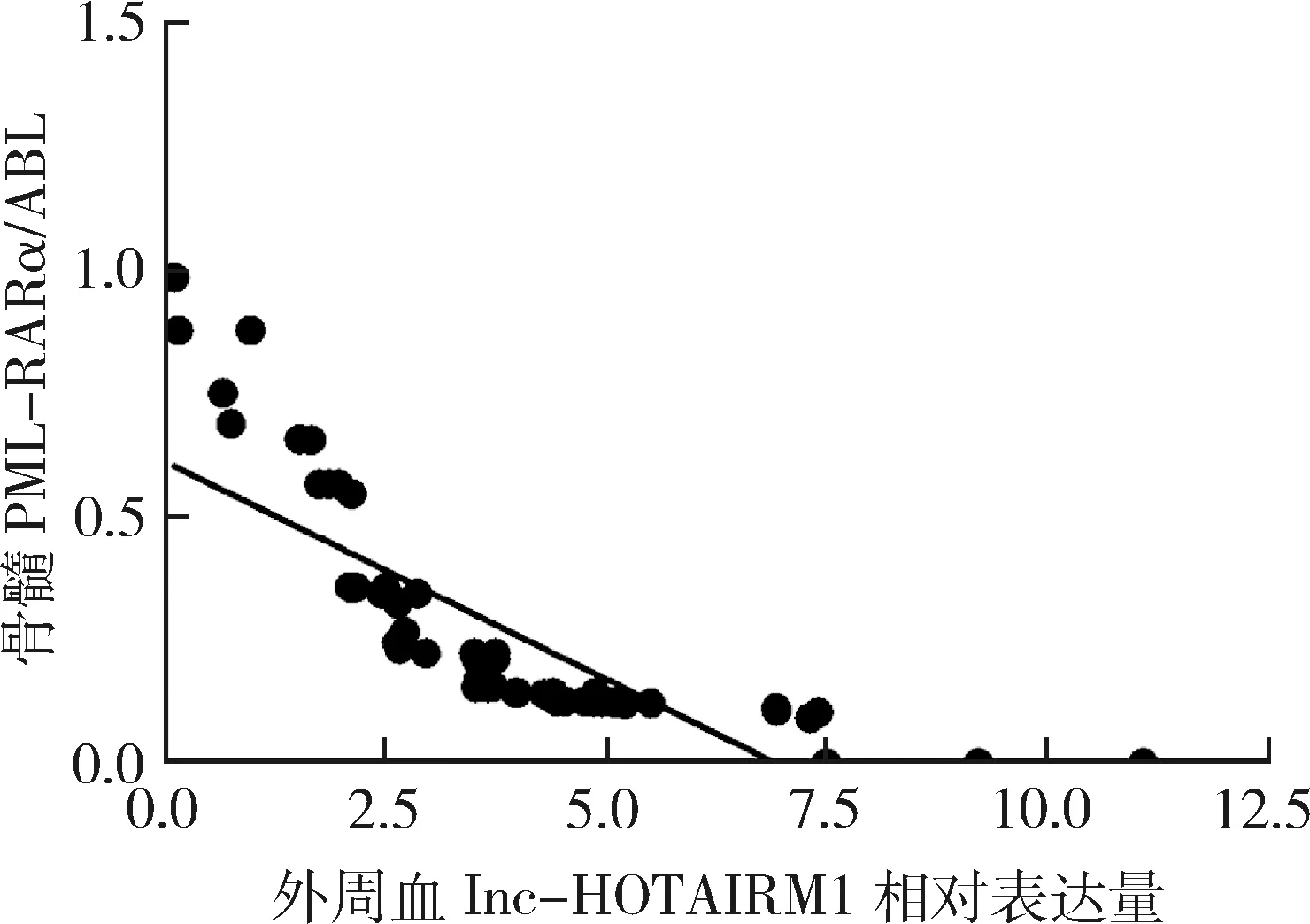
图5 APL患者治疗前后外周血lnc-HOTAIRM1相对表达量与骨髓PML-RARα相关性
讨 论
lncRNA是一类长度大于200个核苷酸的非编码RNA,在微小RNA(microRNA,miRNA)之后成为恶性肿瘤领域的研究热点[12, 13]。lnc-HOTAIRM1是一种成熟于骨髓细胞中的高度特异性lncRNA,它在急性髓细胞白血病、急性淋巴细胞白血病和霍奇金淋巴瘤的治疗中有重要临床价值[14~16]。有文献证实,lnc-HOTAIRM1在APL细胞分化中起重要作用,在APL诱导分化过程中,lnc-HOTAIRM1表达受PU.1转录因子调节,且通过增强自噬途径促进PML-RARα融合蛋白降解和髓细胞分化[7, 8]。因此,lnc-HOTAIRM1可能是APL治疗的潜在靶标以及APL治疗反应的指标。RT-qPCR是一种常规的分子生物学诊断方法,因其自身的高度特异性和便利性被广泛应用于临床[17]。
APL患者需要定期通过骨髓穿刺进行分子生物学检查和形态学检查以评估诱导分化效果,但长期的骨髓穿刺无疑会极大增加患者的痛苦,特别是对那些不能耐受骨髓穿刺或存在骨髓穿刺禁忌证的患者,进而影响临床医生对患者病情做出及时判断,导致患者的治疗效果不佳。静脉抽血相对于骨髓穿刺风险要小,外周血的获取相对于骨髓要简便和快捷。迄今为止在APL治疗中基于RT-qPCR技术检测外周血lncRNA的相关文献国内外尚未见报道。
本研究笔者通过ATRA诱导NB4细胞探究lnc-HOTAIRM1的表达规律,发现了lnc-HOTAIRM1的相对表达量在NB4细胞株中随着ATRA诱导时间的增加而增加。这提示了在APL的细胞株中lnc-HOTAIRM1的表达规律是可信的,因此体外诱导NB4细胞实验的结果为临床治疗前后的APL标本外周血lnc-HOTAIRM1的差异表达提供了有力的实验室证据,从而验证了外周血lnc-HOTAIRM1与APL治疗有关。
本研究结果显示,APL患者诱导分化后完全缓解的外周血lnc-HOTAIRM1相对表达量远高于APL患者治疗前的外周血lnc-HOTAIRM1相对表达量(P<0.01),这提示了在APL患者治疗监测中可以通过检测外周血lnc-HOTAIRM1的表达水平来评估APL的治疗效果。APL患者治疗前的外周血lnc-HOTAIRM1相对表达量低于治疗前非APL的其他白血病患者和正常对照的外周血lnc-HOTAIRM1相对表达量(P<0.01),即外周血lnc-HOTAIRM1在APL患者与非APL白血病患者以及正常对照之间存在差异性表达,上述研究结果提示了lnc-HOTAIRM1可能可用于APL和非APL/正常人群的鉴别诊断。研究表明,某些关键lncRNA确实在白血病的发生、发展和治疗中起着重要作用,lncRNA SBF2-AS1在AML患者治疗中存在差异性表达,其可作为潜在治疗靶点[18]。lncRNA H19通过参与破坏hTERT-hTR相互作用来阻止端粒酶功能,抑制APL的发生,因此H19可作为治疗靶点。lncRNA RP11-87C12.5的表达在初诊急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和完全缓解ALL中存在差异,这对评估ALL治疗效果有重要意义。有研究表明,在ALL中,lncRNA SNHG16下调抑制了ALL细胞的增殖,SNHG16在ALL中上调促进了ALL的发生[19]。
笔者将APL患者治疗前后外周血lnc-HOTAIRM1与患者的骨髓PML-RARα检测做比较,发现APL患者治疗前后外周血lnc-HOTAIRM1相对表达量与骨髓PML-RARα呈负相关(P=0.000)。骨髓PML-RARα检测是评估APL患者治疗效果和进行MRD监测的一项关键的分子生物学检查,本研究中APL患者治疗前后外周血lnc-HOTAIRM1与骨髓PML-RARα相关,提示外周血lnc-HOTAIRM1在APL患者的疗效评估和MRD监测方面存在一定的临床价值。
综上所述,本研究建立了外周血lnc-HOTAIRM1定量检测的RT-qPCR方法,并在APL患者治疗中进行临床应用,证实外周血lnc-HOTAIRM1在APL治疗前后存在差异性表达。本研究有望为APL的鉴别诊断、疗效评估和MRD监测提供无创新型分子标志物,并为其他白血病治疗监测提供了新策略。
