红细胞抗氧化机制的研究进展
2020-10-26郁多男
杨 蕾 凌 玲 郁多男
氧化应激是德国科学家Sies H在1985年首次提出的生理概念,指的是机体在受到内外环境有害刺激时,细胞中氧化物与抗氧物的平衡被打破所引起的细胞和组织损伤[1]。ROS在一定程度上是必需的,可以帮助机体消灭细菌,清除体内毒素,但是当其产生过多时,不能被抗氧化酶及时清除,就成了危害人体健康的一大危险因素。氧化应激理论一经提出,研究者们对抗氧化的研究便紧紧相随。
一、研究背景
1.红细胞的特殊结构:成熟红细胞(red blood cells,RBCs)形如双凹圆盘,是血液中数量最多的一种血细胞,游走于全身组织器官并发挥气体交换、氧化还原、肿瘤免疫等重要生理功能。在这一过程中,RBCs不断遭到ROS攻击,导致其渐进损伤和最终衰老,主要原因是RBCs结构的一些特殊性:①红细胞膜脂质富含不饱和脂肪酸,而多不饱和脂肪酸含有双键,持续暴露于高氧水平极易被过氧化[2];②红细胞总蛋白的95%为富含Fe2+的血红蛋白(hemoglobin,Hb),铁是自由基反应的催化剂;③正常生理情况下,线粒体可以通过多种机制来消除ROS,但成熟红细胞无线粒体等细胞器,所以损伤后很难自我修复。
2.红细胞氧化损伤的机制:研究表明,在多种生理病理条件下红细胞都易发生氧化损伤,降低血液供氧能力,加重组织缺氧从而影响机体的运动能力和恢复过程[3]。红细胞发生氧化损伤后ROS会攻击红细胞胞内的主要成分——Hb,Hb被氧化成高铁血红蛋白(methehemoglobin,MetHb)而不能再与氧气结合向组织供氧,当体内MetHb含量达到一定浓度时会导致机体昏迷甚至死亡[4]。微循环是进行气体和物质交换的重要场所,红细胞必须形变才可以穿过比自己直径小的毛细血管到达周围组织发挥供氧功能,维持微循环的有效灌注[5]。这一过程主要依赖于膜的完整性和变形性。氧化应激时Hb氧化会使蛋白交联聚合或形成二硫键,沉积在细胞膜内侧,影响骨架蛋白延展性。ROS还会攻击红细胞膜脂质,生成脂质过氧化物(lipid peroxide,LPO),如氧化应激的标志物丙二醛,使膜蛋白和磷脂交联,直接破坏质膜的磷脂双分子层结构和膜骨架蛋白,红细胞发生异形改变,导致细胞膜失去良好的流动性,脆性增加,变形能力下降[6]。这也使得红细胞聚集,血液黏度升高,血管阻力增大,细胞寿命缩短,免疫黏附功能障碍,与许多自身免疫疾病和心脑血管疾病如高血压、冠心病等的发生、发展及不良预后密切相关[7]。这些都表明了红细胞抗氧化应激机制的研究与维持机体健康密不可分。
二、硫氧还蛋白过氧化物酶-2的抗氧化作用
红细胞运输氧气导致其不断接触内源和外源性ROS而产生氧化应激。为了尽量减少ROS对细胞的损伤以及由此产生的应激影响,RBCs具有广泛的非酶抗氧化系统(如谷胱甘肽和维生素E)和抗氧化酶系统[8]。抗氧化酶系统包括:①超氧化物歧化酶(superoxide dismutase,SOD),SOD专门清除超氧阴离子自由基;②过氧化氢酶(catalase,CAT),CAT能通过催化过氧化氢的分解来发挥抗氧化作用;③谷胱甘肽过氧化物酶(glutathione peroxidase,GPx),GPx可以清除过氧化氢和脂质过氧化物。
硫氧还蛋白过氧化物酶-2(peroxiredoxin-2,Prx2)是最近发现的抗氧化防御酶家族成员,也是红细胞中第3丰富的蛋白质,利用半胱氨酸残基分解过氧化物,能有效地清除低水平的H2O2。Nagababu等[9]建立的Prx2敲除小鼠模型表现为轻度慢性溶血性贫血,Hb持续自氧化会伴随产生超氧化物,这是一种相对不活跃的自由基,SOD迅速将之歧化为H2O2,Prx2和GPx再进一步分解为水和氧气,降低Hb的自氧化作用,减轻ROS诱导的Hb聚集(图1)。Rocha等[8]也指出Prx2和GPx负责清除细胞内源性/低浓度的H2O2,平均MetHb水平和血红蛋白降解显著增加,降低了红细胞变形能力。MetHb可以看作红细胞氧化应激的间接指标,因为它的升高意味着MetHb的还原水平难以跟上Hb的自氧化。
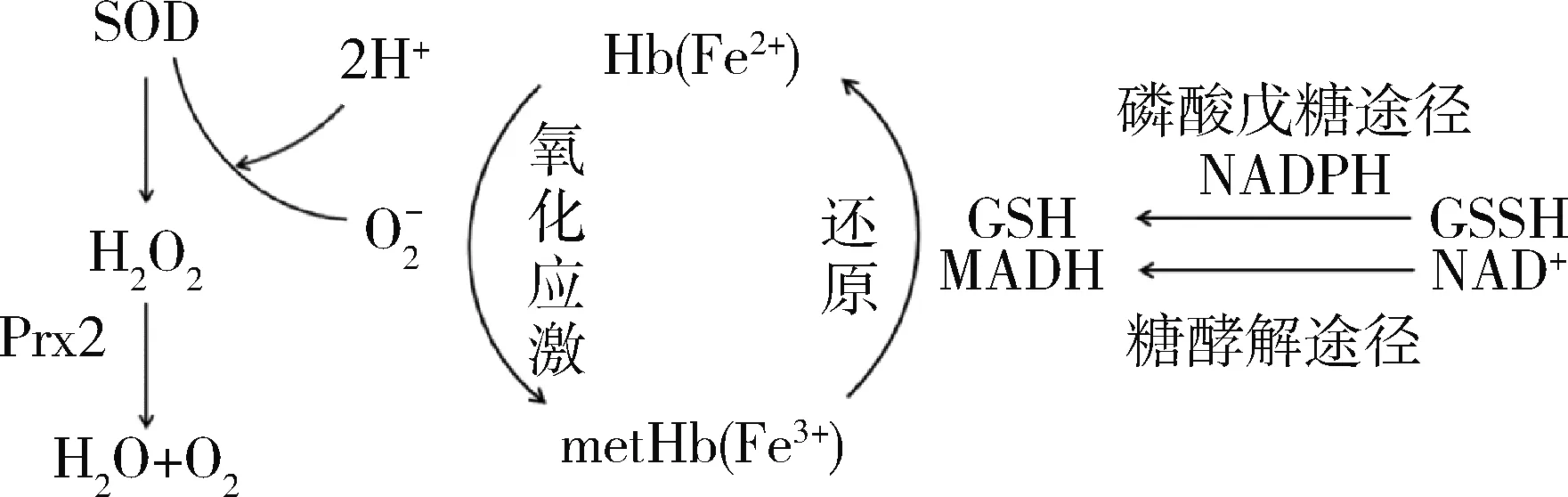
图1 氧化应激时血红蛋白的氧化还原
在红细胞抗氧化酶中,Prx2是唯一一种至少部分与膜相关的酶。在正常条件下,约5%的Prx2通过C-末端绑定膜带3蛋白与膜结合,被证明可以清除脂质氢过氧化物,防止血红蛋白降解产物的形成以及所伴随的铁的释放,抑制红细胞变形能力受损和酶活性的下降[8,10]。考虑到红细胞中Prx2的高浓度,5%是不容忽视的。还有进一步的研究表明,Prx2与膜的结合程度受氧化应激和缺氧的影响,Prx2是在缺氧条件下与膜结合Hb自氧化产生的H2O2反应的首选酶,可以抑制细胞骨架蛋白质损伤所导致的红细胞膜形态改变[11]。
三、miR-144/451与红系氧化应激
红细胞系由不同发育阶段的红细胞组成,从原始红细胞分化脱核最终变为成熟红细胞。研究发现,这一发育过程受到一个庞大且精密的系统调控。microRNA(miRNA)是一类长度为18~25核苷酸(nt)的非编码小分子RNA,通常降低靶基因转录本的稳定性或抑制靶基因转录本的表达[12]。miR-144/451在人和小鼠基因组中分别位于17号和11号染色体上,是一个双顺反子基因位点,编码两个高度保守的miRNAs:miR-144-3p和miR-451a。miR-144/451在红细胞内表达很丰富,且几乎完全存在于红细胞中[13,14]。主要有以下转录因子参与miR-144/451红系氧化应激过程。
1.FOXO3a(forkhead box O3a):FOXO3a作为红系中一个重要的核转录因子,在氧化应激的多个信号通路中发挥重要作用,通过转录调控一些凋亡/细胞生长相关基因在凋亡和细胞生长中起着关键作用[15]。FOXO家族的成员具有一个独特的高度保守的叉头DNA结构域,该结构域受蛋白激酶Akt、SGK和IKKβ负调控。这些激酶对FOXO3a的磷酸化作用导致FOXO3a从细胞核移送到细胞质,转录活性被抑制。最近的研究也揭示了FOXO在保持造血干细胞自我更新能力方面的重要性,FOXO3a在应对生理氧化应激中起重要作用,从而调解在HSC隔间中静默和增强存活率,这是其长期再生潜力所必需的功能[16]。小鼠miR-144/451基因被敲除后,红细胞氧化应激的敏感度显著增加,这主要由于miR-451靶基因Ywhaz的表达明显增高所致。ROS水平增高又使得AKT急剧磷酸化,磷酸化后的FOXO3a暴露结合位点与Ywhaz所编码的14-3-3ζ蛋白形成复合物,从细胞核内转移到细胞核外,并且14-3-3ζ蛋白封闭核定位信号,阻止FOXO3a再入核,降低FOXO3a转录抗氧化酶的功能,导致红细胞中CAT和GPx-1生成减少,红细胞氧化应激损伤加剧,贫血加重[17]。
2.NF-E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2):Nrf2是调控细胞氧化应激反应的另一个重要转录因子,维持细胞内氧化还原稳态[18]。氧化应激发生后,原被Kelch样环氧氯丙烷相关蛋白-1(kelch-like ECH2 associated protein 1,Keap1)蛋白锚定在细胞骨架上的Nrf2,与Keap1解离进入细胞核,并与抗氧化反应元件结合,启动下游靶基因抗氧化酶的表达,可以减轻ROS和亲电体引发的细胞损伤,从而抑制氧化应激反应[18]。miR-144和Nrf2信号之间的潜在联系已在许多细胞和组织类型中进行了探索[19~21]。miR-144通过碱基互补原则结合Nrf2的3′非翻译区(3′-untranslated region,3′UTR),抑制Nrf2的mRNA翻译。由此可见,miR-144和miR-451共同参与红细胞的抗氧化作用。
四、丙酮酸钠的抗氧化机制
丙酮酸钠的抗氧化、抗炎及细胞器官保护作用已经在多个模型中得到验证,也可以改善红细胞功能,减轻红细胞氧化损伤。目前认为主要通过以下几种途径:(1)作为简单的α-酮酸,能够中和H2O2的氧化能力,与H2O2反应生成二氧化碳和水,阻止H2O2浓度升高杀伤正常细胞,抑制ROS的生成[22]。(2)红细胞因为胞内没有线粒体,主要从血浆中摄取葡萄糖,90%~95%经糖酵解途径代谢。当细胞发生氧化损伤时,糖酵解途径中的关键酶,即磷酸果糖激酶1会失活,使糖酵解途径受阻。而丙酮酸是糖代谢途径中的关键中间产物,在糖酵解途径中,内源性丙酮酸可经由乳酸脱氢酶(LDH)催化转化为乳酸供能,同时促进NAD+(氧化型辅酶Ⅰ)向NADH(还原型辅酶Ⅰ)转化。NADH可以抑制脂质过氧化反应,作为辅助因子在NADH脱氢酶作用下还原MetHb(图1)。已有研究证明外源性丙酮酸钠同样可以阻止糖酵解障碍,保持NAD+/NADH的正常比例[23]。(3)丙酮酸钠升高GSH/GSSG比率从而发挥抗氧化作用。磷酸戊糖途径中,丙酮酸钠促进NADPH(还原型辅酶Ⅱ)的生成,NADPH是细胞内很重要的还原当量,最关键的一个作用是把氧化型谷胱甘肽(GSSG)重新还原成谷胱甘肽(GSH),而GSH是细胞内重要的自由基清除剂,可以保护膜蛋白和血红蛋白中巯基不被破坏,维持红细胞活性。
上述有关丙酮酸钠抗氧化作用的研究在临床上很有指导意义。例如,输血是外科治疗中挽救患者生命的重要手段之一,但红细胞存储效果的维持也是一大难点。有研究发现,在红细胞储存过程中,添加外源性丙酮酸钠,可以使储存血细胞的能量代谢水平提高而降低氧化应激水平,从而改善红细胞存储损伤问题,减小回输体内后不良反应的发生率[24]。
五、展 望
氧化应激的概念提出以来,研究者在氧化应激/抗氧化平衡等方面做了很多探索,外源性的热辐射、环境污染、氧化还原类的物质等都能使细胞产生ROS,人们寻求抗氧化剂来清除自由基以制止氧化应激对身体的伤害。红细胞的重要生理作用和特殊结构特点使其更易受氧化应激损伤。红细胞的损伤影响着与人类健康息息相关的多种血液疾病,但目前针对红细胞体系的相关研究还不是很多,所以进一步科学全面的研究红细胞抗氧化机制来预防血液疾病或改善健康是非常有必要的。希望未来能通过干预红细胞氧化损伤后发生的血红蛋白变性、膜脂质和膜蛋白被破坏、酶活性降低、糖酵解受阻等中间环节,尽可能维持红细胞正常生理形态和功能状态。
