3D打印可控式张力带技术通过刺激表皮生长和新血管形成来促进皮肤再生
2020-10-26买合木提亚库甫陈洪涛
买合木提·亚库甫 刘 旭 陈洪涛
皮肤常因急性或慢性伤口而受损,如大面积烧伤、外伤等引起的损伤。这些损伤不仅破坏了皮肤的屏障功能,还改变了对温度、疼痛和触摸的感觉[1]。虽然大多数皮肤缺损可以自然愈合,但是成人皮肤伤口的愈合是一个复杂的过程,需要许多不同组织和细胞的共同参与,一些急、慢性皮肤损伤仍需要住院治疗[2,3]。大量证据表明,通过加速伤口愈合过程,可以促进皮肤的再生[4~6]。因此,寻找一种有效的方法促进皮肤再生,恢复受损皮肤的功能是一个迫切的要求。
近年来,3D打印技术作为一种新兴技术,从最初被用作手术前的可视化模型和工具模型,到目前已开始应用于组织工程、诊断平台、支架、药物发现和毒理学中[7]。大量研究发现,3D打印技术可以作为一种仿生支架,可以促进软骨修复、心脏修复、伤口愈合和皮肤再生等[8~11]。虽然传统的3D打印技术在伤口修复和皮肤再生方面的应用已经取得了很大的进展,但是张力带的布置方法和张力大小对创缘皮肤的增殖和再生并不清楚。因此,探究新型3D打印可控式张力带技术作为一种新的方法在创面愈合和皮肤再生中的规律和作用机制值得进一步研究。
本研究讨论了新型3D打印可控式张力带技术在皮肤缺损治疗中的作用,并探讨了不同张力大小对创面愈合过程和皮肤再生的影响,阐明了其作用规律和机制,为临床应用提供理论支持。
材料与方法
1.材料:60只雄性新西兰大白兔购自新疆医科大学动物实验中心;Panowin-F3000 打印机购自上海磐纹科技有限公司;戊巴比妥钠购自武汉力博瑞生物科技有限公司;庆大霉素购自北京索莱宝科技有限公司;甲醛购自国药集团化学试剂有限公司;胃蛋白酶购自上海生工生物工程有限公司;pan-cytokeratin、CD31和VEGF单克隆抗体、山羊抗兔二抗购自美国Abcam公司。
2.构建皮肤缺损动物模型:选用6月龄、体质量2~3kg的新西兰大耳白兔头部制备动物模型,因为头部皮肤位置相对固定,避免了实验过程中张力带周围皮肤被牵扯过来。术前对兔进行体温和体重检测,将戊巴比妥钠按25mg/kg于耳缘静脉注射进行全身麻醉,麻醉显效后,进行常规消毒手术区,铺无菌巾,将兔固定在操作台上,用质量分数为8%的硫化钠对兔头进行脱毛,自两耳根后缘连线间,横向切开长约2.5cm皮肤切口,切开皮肤及皮下组织,血管钳向前钝性分离头部皮肤与颧骨骨膜的疏松附着,分离范围为两侧近眶骨上缘1cm,前部距鼻翼2cm处。手术后立即肌肉注射庆大霉素80000单位,连续注射3天。
3.构建3D打印可控式张力带和滑轮装置:通过UG、3-Matic等三维数据处理软件设计可控式张力带和滑轮装置并建模,优化数据,输出三维打印设备可识别的标准模板库STL文件,将STL文件导入3D打印机,将3D打印材料先在一个平面内(x,y)铺一层材料,z轴向上移动一个单位(为3D打印设备设定的适配参数)后重复上一操作。在计算机设置中可以设置打印机的速度、打印密度以调节快速成型模型的各项特征,即可初步构建出可控式张力带和滑轮装置的制备。
4.皮肤损伤动物的分组治疗:将模型动物随机分为4组治疗:①正常对照组(A组):不植入可控式张力带和滑轮装置;②无张力带组(B组):植入可控式张力带和滑轮装置,但不及硅胶袢张力;③常规张力带组(C组):植入可控式张力带和滑轮装置,每日牵拉1次,每次牵拉力量使硅胶袢直径变细至原先的2/3;④快速张力带组(D组):植入可控式张力带和滑轮装置,每日牵拉1次,每次牵拉力量使硅胶袢直径变细至原先的1/2。硅胶袢直径越细,牵拉力越大,张力带速度越快。
5.皮肤创面愈合检测:分别于手术后3、7和14天时间点观察伤口变化,是否结痂,有无感染,用游标卡尺测量各组创面面积,计算创面收缩率。创面收缩率(%)=(原创面面积-检测时创面面积)/原创面面积×100%。
6.标本的采集与处理:在手术后14天测量完创面收缩面积后,采集新西兰大耳白兔头部缺损皮肤组织。采集时需修剪其表面毛发,全身麻醉情况下于相邻滑轮装置连线外1cm处切取1cm×1cm大小的全层皮肤组织块。并将切取的组织块标本放入10%的甲醛溶液中固定,常规脱水、透明、浸蜡、包埋,制成连续切片(厚度5mm)。
7.HE染色检测各组小鼠皮肤组织病理变化:将标本用蒸馏水清洗,苏木精染色(60℃)30~60s,流水洗去苏木精,1%盐酸乙醇浸润1~3s,流水洗,促蓝液返蓝5~10s,流水洗15~30s,0.5%伊红染色30~60s,蒸馏水洗1~2s,80%、95%和100%乙醇梯度脱水,每步1~2s,二甲苯浸泡3次,中性树脂封片。封片后于显微镜下拍照,观察组织病理变化。
8.免疫组织化学染色检测皮肤组织中pan-cytokeratin、CD31和VEGF的表达:将制备好的皮肤组织标本与0.4%胃蛋白酶在5mm HCl中37℃孵育20min,提取抗原。用3%过氧化氢在甲醇中孵育5min,阻断内源性过氧化物酶;用2%牛血清蛋白孵育,阻断非特异性蛋白结合。用一抗(兔抗pan-cytokeratin、CD31和VEGF均为1∶1000稀释比)在4℃孵育过夜后,切片在室温条件下与山羊抗兔二抗孵育2h。采用Te DAB基片系统进行显色。最后,用苏木精染色封片进行拍照。
9.统计学方法:采用SPSS 18.0统计学软件对数据进行统计分析。所有的值都记录为至少3个独立实验的平均SEM。采用双尾t检验来评价各组间的差异,以P<0.05为差异有统计学意义。
结 果
1.3D打印可控式张力带和滑轮装置:通过UG、3-Matic等三维数据处理软件设计可控式张力带和滑轮装置见图1。包括滑轮装置模型图(图1A、B);3D打印模块图(图1C、D);3D打印滑轮装置动物实验模型图,蓝色区域代表皮肤缺损,蓝色线代表硅胶袢,蓝色线的接触点代表滑轮装置(图1E);3D打印滑轮装置动物实验模拟图,蓝色模块代表可控式张力带装置的滑轮装置,安装在皮肤缺损周围,此时皮肤缺损动物模型中未安装硅胶袢(图1F)。

图1 3D打印可控式张力带和滑轮装置示意图
2.各组实验兔体温变化:4组动物的体温变化见表1,在植入3D打印可控式张力带装置手术前后,实验组与对照组比较,动物的体温变化差异无统计学意义,说明3D打印可控式张力带装置不会对动物的创面皮肤造成感染。
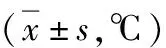
表1 各组动物体温变化
3.各组实验兔体质量变化:4组动物的体质量变化见表2,手术前后对照组和实验组体质量变化较小,其中植入张力大小不同的装置各组间比较差异无统计学意义,说明无论是植入无张力带装置,还是常规张力带和快速张力带装置,对动物的正常生长都无明显影响。

表2 各组动物体质量变化
4.创面愈合观察:皮肤缺损模型大白兔植入3D可控式张力带装置术后于3、7和14天时检测创面愈合情况见表3。对照组和实验组创面均有少量液体渗出,对有少部分感染。术后3天时,与对照组比较,无张力带组的创面收缩差异无统计学意义,常规张力带组和快速张力带组显著增加了创面收缩面积,色泽红润;术后7天时,张力带组的创面收缩面积与对照组比较,差异无统计学意义,而常规张力带组和快速张力带组创面明显缩小且干燥,创口有结痂;术后14天时,常规张力带组和快速张力带组创伤部位干燥,基本愈合且新生表皮光滑有弹性,而对照组和无张力带组创面结痂缓慢,未完全愈合且触感粗糙。4组动物术后创面收缩率由高到低依次是常规张力带组、快速张力带组、无张力带组和对照组(P<0.05)。因此,适当大小张力的3D可控式张力带装置可以促进创面愈合和皮肤再生,其中常规张力带组创面收缩率最大、愈合最快且创口最平滑。

表3 术后创面收缩率
5.3D打印可控式张力带装置对皮肤组织病理变化影响:HE染色结果显示,术后7天,4组全层皮肤均可见炎性细胞,均有炎性反应(图2)。与对照组比较,无张力带组、常规张力带组和快速张力带组全层皮肤的胶原纤维、炎性细胞均未明显变化,表皮表面均趋于均匀。

图2 术后7天大白兔皮肤组织病理学观察(HE,×200)
6.3D打印可控式张力带装置对皮肤表皮生长的影响:为进一步探究皮肤缺损后张力大小不同的3D打印可控式张力带装置促进创面愈合和皮肤再生的机制,笔者使用pan-cytokeratin抗体对术后7天全层皮肤组织进行染色(棕色为阳性细胞)。与对照组比较,无张力带组差异无统计学意义,常规张力带组和快速张力带组均表现为表皮厚度增加,但是常规张力组的表皮厚度要远多于快速张力带组(图3)。

图3 术后7天大白兔皮肤表皮厚度变化(免疫组化,×200)
7.3D打印可控式张力带装置对皮肤新血管形成的影响:为进一步鉴定张力大小不同的3D打印可控式张力带置对全层皮肤的血管形成的影响,采用组织切片免疫组织化学分析CD31和VEGF在术后7天的表达水平,以此来检测各组血管新生情况。免疫组化结果显示,CD31和VEGF主要表达在胞质内(图4A、B),为棕黄色颗粒,与对照组比较,无张力带组差异无统计学意义,常规张力带组和快速张力带组中CD31和VEGF蛋白表达均上升,其中常规张力带组的CD31和VEGF表达水平高于快速张力带组(图4C、D)。因此,适当大小张力的3D打印可控式张力带装置上调了全层皮肤中CD31和VEGF蛋白表达,其中常规张力带组最显著,进一步促进了全层皮肤中新血管的形成。

图4 术后7天大白兔皮肤免疫组织化学染色及结果分析图
讨 论
皮肤是一个复杂的器官,是抵御外部损伤因子的第一道屏障[12]。作为人体最大的器官,皮肤容易受到各种损伤,损伤发生后,必须尽快重建其结构和功能[13]。严重的皮肤损伤可能会危及生命。皮肤再生和伤口愈合是一个复杂的过程,需要一个复杂的生物和分子事件的协调整合,包括炎症、增殖和重塑[14]。目前使用广泛的伤口敷料、药膏和医疗设备来治疗皮肤缺损,但创面愈合仍然是一项艰巨的临床挑战。尽管国内外许多研究者对创面愈合和皮肤再生有不少的报道,但其机制尚未有明确的定论。因此,提供一种促进创面愈合和皮肤再生的技术并明确其作用机制显得格外重要。
对于创面的修复和愈合,传统采用的是“绑鞋带技术”,但此技术是静态张力装置,创面愈合时间相对较慢[15~17]。传统“绑鞋带技术”的局限性推动了3D打印技术的发展。3D打印是一种新兴的技术,在皮肤组织的制剂开发、临床移植、医学检测以及基础研究等方面具有潜在的帮助作用[18~20]。有研究表明,3D打印技术在复杂的面部伤口上,可以促进表皮和真皮层的皮肤组织再生[10,21]。
本研究探讨了新型的3D打印可控式张力带技术对皮肤缺损动物模型中创面愈合和皮肤再生的影响及其机制。从体温和体重结果显示,植入3D打印可控式张力带装置并不会对模型动物的创面感染和动物生长有显著影响,同时通过对4组动物的创面愈合观察和创面收缩率分析显示,植入3D打印可控式张力带装置各组在术后3、7和14天时与对照组比较,无张力带组差异无统计学意义,而常规张力带组和快速张力带组的创伤部位干燥,结痂和愈合速度快且新生表皮光滑有弹性,色泽红润,其中常规张力带组创面愈合收缩率显著高于快速张力带组。这些结果表明,改变3D打印装置的张力大小可以加速创面愈合效率和皮肤再生,且常规张力带组效率最高。从HE染色图来看,术后7天时,各组均有炎性反应,创面周围全层皮肤可见炎性细胞。炎性细胞的浸润是创伤愈合初期创面及周围全层皮肤的一种炎性反应,与对照组比较,无张力带组、常规张力带组和快速张力带组的全层皮肤表皮均趋于均匀,未见明显的组织病理学变化[22]。因此,适当大小张力的3D打印装置对创伤周围全层皮肤无显著病理学改变。
有研究表明,创面愈合和皮肤再生与张力强度有关[23]。Xiong 等[5]研究者发现刺激表皮生长和血管形成可以促进皮肤再生。为了进一步探究3D打印装置促进创面愈合和皮肤再生的分子机制,笔者通过免疫组织化学染色分析pan-cytokeratin、CD31和VEGF的表达。pan-cytokeratin是构成生皮表皮、毛皮毛囊的主要蛋白质,有助于伤口愈合和皮肤再生[10]。CD31是血小板-内皮细胞黏附分子,通常位于血管内皮细胞、血小板和中性粒细胞等细胞,可以被招募到组织损伤部位并直接促进血管生成[24]。VEGF是血管内皮生长因子,具有促进血管通透性、血管增殖和形成的作用[25~27]。本研究结果表明,在术后7天时,与对照组比较,无张力带组差异无统计学意义,常规张力带组和快速张力带组增加了表皮厚度,上调了CD31和VEGF的表达,并且常规张力带组的变化显著于快速张力带组。因此,3D打印可控式张力带装置通过调整张力大小可以促进表皮生长,通过上调CD31和VEGF的表达促进血管的形成,其中常规张力大小最为适合,进而对创面愈合和皮肤再生起到关键的推动作用。
综上所述,3D打印可控式张力带技术可以通过控制张力大小促进皮肤缺损动物模型中创面愈合和表皮生长,上调CD31和VEGF的表达促进了新血管的形成,进而促进了皮肤的再生。其中常规张力带组的创面愈合速率、表皮生长和血管形成最显著。本研究为采用3D打印技术修复皮肤缺损临床应用提供了科学依据。
