rAAV9介导HIF-1α对糖尿病小鼠缺血后处理的影响
2020-10-26李佳馨吴建江陈思宇
李佳馨 李 鑫 吴建江 陈思宇 王 江
急性肺损伤(acute lung injury, ALI)即由多种炎性介质与效应细胞共同参与,呈级联放大的炎症继发性损伤和弥漫性肺实质损伤。而心肌缺血/再灌注(ischemia reperfusion, I/R)损伤时氧化应激释放大量氧自由基及炎性细胞因子作用于肺部,是造成ALI的重要原因[1,2]。研究表明,缺血后处理(ischemic post-conditioning, IPostC)不仅对接受后处理的缺血/再灌注损伤的心肌有保护作用,而且对远隔器官肺也有相同效应,而其缓解心肌I/R所致ALI,发挥围术期肺保护的机制可能与抑制氧自由基积聚、减少炎性细胞因子释放以及激活HIF信号通路相关[3,4]。然而,笔者的前期研究结果发现,糖尿病状态下HIF信号通路受损更加严重[5]。此时IPostC围术期肺保护作用是否存在及其发挥效应的机制亟待进一步阐明。此外,重组9型腺相关病毒rAAV9(recombinant adeno-associated virus-9, rAAV9)载体介导HIF-1α基因,可以外源性上调HIF-1α基因,修复糖尿病状态下损伤的HIF信号通路。因此,本研究通过建立糖尿病小鼠心肌缺血/再灌注损伤模型及心肌缺血后处理模型,观察炎性细胞因子、氧自由基以及HIF信号通路在心肌I/R致ALI病程进展中的作用;探索外源性提高HIF-1α表达后IPostC对糖尿病心肌I/R致ALI的肺保护作用的机制。
材料与方法
1.实验动物与分组:成年雄性糖尿病db/db小鼠40只,体质量55~65g(北京维通利华实验动物技术有限公司提供),饲养于新疆医科大学SPF级动物实验中心,并通过新疆医科大学第一附属医院动物实验医学伦理学委员会批准。按随机数字表法分为假手术组(S组)、缺血/再灌注组(I/R组)、缺血后处理组(IPostC组)、rAAV9-HIF-1α+缺血后处理组(HIPostC组),每组10只。
2.动物模型制备:心肌缺血/再灌注损伤模型建立(I/R组):小鼠腹腔注射氯胺酮(8mg/100g)、甲苯噻嗪(2mg/100g)和阿托品(0.12mg/100g)(即KXA混合液)麻醉,行气管插管,呼吸机辅助呼吸(频率90~110次/分,潮气量0.3~0.4ml),小鼠仰卧固定于恒温垫(36℃)操作台上,消毒手术区域,双目显微镜下于左侧第3、4肋间开胸,结扎冠状动脉左前降支缺血1h,位置为左心耳下缘约1mm处,后松开结扎线再灌注15min。结扎成功显示心前区变白,心电图示ST段抬高(T波高耸,QRS波增宽、变高);再灌注成功标志为ST段回落,心尖复红。假手术组(S组):相同部位开胸、穿线但不结扎。缺血后处理模型建立(IPostC组、HIPostC组):缺血1h后,灌注5min、缺血5min连续重复3个循环,后再灌注15min;HIPostC组于缺血后处理前进行尾静脉注射rAAV9-HIF-1α。
3.尾静脉注射rAAV9-HIF-1α:构建重组病毒载体rAAV9-HIF-1α(美国Virovek公司),从尾静脉注射进入db/db小鼠体内,根据Chen等[6]研究,采用剂量为2.0×1011微克/只小鼠,并于4~5周后处死小鼠,以保证病毒注射最佳剂量和最优表达时间。
4.肺组织病理学检查:各组db/db小鼠建模完成后,取左肺于4%多聚甲醛中固定24h,石蜡包埋,HE染色采用苏木素染液(福州迈新生物技术开发有限公司)、伊红染液(北京中杉金桥生物技术有限公司),切片,×400镜检。肺损伤程度采用Smith评分体系综合评定[7]。
5.炎性细胞因子检测:采用流式微球捕获芯片技术(CBA法)检测促炎性细胞因子白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)及抗炎性细胞因子白细胞介素-10(IL-10)。
6.氧自由基检测:采用丙二醛MDA试剂盒及超氧化物歧化酶SOD试剂盒(南京建成生物工程研究所)分别检测脂质代谢产物丙二醛(MDA)、氧自由基清除剂超氧化物歧化酶(SOD)。
7.Western blot法检测:各组db/db鼠再灌注结束后,取右肺,快速液氮冷冻,后移入-80℃冰箱冻存备用,称重取约100mg样本加400μl RIPA裂解液(武汉博士德生物工程有限公司),于冰上研磨充分混匀,4℃ 12000r/min离心15min取上清液提取蛋白。Easy Ⅱ Protein Quantitative Kit(BCA)(北京全式金生物技术有限公司)测定蛋白浓度,后加入5×SDS-PAGE缓冲液,100℃水浴加热5min使蛋白变性,12000r/min离心5min取上清待加样。制胶、加样、电泳后转移至0.45μm PVDF膜上,室温封闭1h,加入一抗HIF-1α抗体(美国Thermo Fisher Scientific公司),4℃孵育过夜,加入二抗山羊抗兔IgG H&L(HRP)(英国Abcam公司),室温孵育1h,漂洗显色后用ChemiScope mini化学发光仪检测、拍照。以HIF-1α条带灰度值与内参(β-actin)条带灰度值的比值反映HIF-1α的表达。
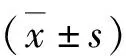
结 果
1.肺组织形态学变化:光镜下观察,与S组比较,I/R组肺损伤程度显著增高,表现为肺泡壁增厚、水肿、充血及出血,部分肺组织间质细胞增生、增大且增多,胞质深染,较多急慢性炎性细胞浸润,部分肺泡萎缩、变小,肺组织大量出血、实变,部分细支气管上皮细胞轻度增生;IPostC组缺血后处理后肺泡壁水肿、断裂及出血情况仅有轻微缓解,但HIPostC组肺组织损伤程度显著降低,肺泡壁结构基本完整,出血情况显著减少。提示糖尿病心肌缺血/再灌注致急性肺损伤模型建立成功,糖尿病状态下,缺血后处理对心肌缺血/再灌注致急性肺损伤的肺保护作用不明显,但结合rAAV9-HIF-1α后对于已受损肺组织确有一定的保护作用(图1)。

图1 db/db小鼠肺组织病理切片(HE,×400)
2.肺组织HIF-1α的表达:Western blot法结果显示,与S组(0.449±0.030)比较,I/R组(0.549±0.025)和IPostC组(0.656±0.026)的肺组织HIF-1α含量升高(P<0.05),与I/R组比较,IPostC组的肺组织HIF-1α含量升高(P<0.05);与IPostC组比较,HIPostC组(0.702±0.064)的HIF-1α含量明显增高(P<0.05);提示在糖尿病心肌缺血/再灌注后急性肺损伤时HIF-1α表达受影响,单纯应用缺血后处理对于HIF-1α提高有帮助,而rAAV9-HIF-1α+缺血后处理可以明显提高HIF-1α的含量(图2)。

图2 肺组织HIF-1α Western blot法条带图及柱状图
3.炎性细胞因子含量:与S组比较,I/R组和IPostC组的促炎性细胞因子IL-6和TNF-α含量明显升高(P<0.05);与I/R组比较,IPostC组的促炎性细胞因子含量降低,但与S组比较含量仍然很高(P<0.05);而与IPostC组比较,尾静脉注射rAAV9-HIF-1α后HIPostC组的促炎性细胞因子IL-6和TNF-α含量显著降低(P<0.05);与S组和I/R组比较,HIPostC组的抗炎性细胞因子IL-10的含量显著增高(P<0.05);提示单纯应用缺血后处理不能有效降低体内炎性细胞因子含量,而rAAV9-HIF-1α+缺血后处理可以明显降低体内炎性细胞因子含量,通过抑制炎性反应的发生,减轻肺损伤(表1)。

表1 db/db小鼠各组炎性细胞因子含量
4.氧自由基含量:与S组比较,I/R组的MDA含量升高,SOD活性降低(P<0.05);与I/R组比较,IPostC组和HIPostC组的MDA含量降低,SOD活性升高(P<0.05);与S组和IPostC组比较,HIPostC组的MDA含量明显降低(P<0.05);脂质代谢产物MDA可反映氧自由基生成量,而氧自由基清除剂SOD可反映机体清除氧自由基的能力,MDA含量明显升高而SOD活性降低,则提示缺血/再灌注损伤致急性肺损伤时体内氧自由基含量显著升高,缺血后处理可以减少ROS的生成,而尾静脉注射rAAV9-HIF-1α后缺血后处理可以使ROS的生成更进一步减少,从而发挥肺保护作用(表2)。

表2 db/db小鼠各组氧化应激因子含量
讨 论
急性肺损伤以炎性反应失衡和血管通透性增加为主要病理特征,临床表现为呼吸窘迫和顽固性低氧血症等[8]。研究发现,心肌缺血/再灌注损伤时心肌氧供不足,通过氧化应激和炎性反应释放大量氧自由基和炎性细胞因子游走于全身,并作用于邻近器官肺[9]。而此时炎性细胞因子与肺部效应细胞共同参与,进一步发生级联放大的炎症继发性损伤,引起多种炎性细胞因子与氧自由基的积聚,造成炎性介质的泛滥,肺内促炎性细胞因子与抗炎性细胞因子失衡,导致肺泡上皮细胞及毛细血管内皮细胞损伤,进而造成弥漫性肺间质及肺泡水肿[10~12]。
本研究病理结果显示,I/R组肺组织损伤程度明显增加,出现肺泡及间质水肿、肺毛细血管扩张及中性粒细胞浸润,表现为肺泡壁严重受损出血和断裂情况严重,较多的急、慢性炎性细胞浸润,胞质深染,部分肺泡萎缩提示心肌缺血/再灌注后肺组织损伤严重,心肌缺血/再灌注损伤后急性肺损伤模型成功建立。此外,I/R组中促炎性细胞因子增多而抗炎性细胞因子减少,氧自由基含量增多,进一步证实了糖尿病心肌缺血/再灌注致急性肺损伤机制与炎性反应和氧化应激相关。
低氧诱导因子HIF是在缺血缺氧状态下被激活的一种转录因子,可以通过调节下游多种靶基因,参与血管生成、葡萄糖代谢及氧运输等多种途径的转录调控,从而发挥肺保护作用[13]。McClendon等[14]研究发现HIF可作用于肺部,修复损伤的肺泡上皮细胞,使肺组织耐受缺氧状态,抑制氧自由基的积聚,减轻肺部炎性反应从而发挥肺保护作用。此外HIF-1α激活能够降低肺氧耗量,维持氧供需平衡,修复已受损的肺泡毛细血管,发挥肺保护作用。然而,在笔者前期研究中也发现,糖尿病状态下HIF信号通路处于失活状态,心肌缺血/再灌注损伤更加严重,因此本研究使用尾静脉注射rAAV9-HIF-1α的方法,外源性提高HIF-1α,恢复HIF-1α活性,探讨糖尿病状态下缺血后处理是否具有肺保护作用[5,15]。
本研究结果显示,糖尿病小鼠中IPostC组只能轻微缓解肺损伤程度,肺泡壁周围仍有出血和大量炎性细胞浸润;而与IPostC组比较,HIPostC组肺泡壁水肿、断裂及出血情况均显著减轻,细胞壁结构基本恢复完整;提示糖尿病状态下rAAV9-HIF-1α+缺血后处理这一措施,对于心肌缺血/再灌注后受损的肺组织具有一定程度的保护作用。
此外,尾静脉注射rAAV9-HIF-1α后HIPostC组中的HIF-α含量显著增高,促炎性细胞因子IL-6、TNF-α减少,抗炎性细胞因子IL-10相对增多,达到炎性细胞因子相对平衡的状态,从而发挥肺保护作用。与此同时,HIPostC组过氧化脂质降解产物MDA的含量减少,氧自由基清除剂SOD的活性提高,提示氧自由基的含量明显减少。由此笔者考虑缺血后处理发挥肺保护作用与激活HIF信号通路,减轻肺部炎性反应,修复受损的肺泡毛细血管,改善血管通透性有关;糖尿病状态下HIF信号通路弱化,但若外源性提高体内HIF-1α的含量恢复其活性,缺血后处理可在一定程度上恢复肺保护作用。
综上所述,尾静脉注射rAAV9-HIF-1α后缺血后处理可减轻心肌缺血/再灌注所致的急性肺损伤,其发挥作用可能与调控促炎性细胞因子与抗炎性细胞因子的平衡,抑制氧化应激,激活HIF信号通路相关。
