蛹虫草高产菌丝体蛋白菌株的ARTP诱变选育
2020-10-25刘广建郑惠华季宏更
刘广建 郑惠华 蒋 益 张 辰 薛 璟 季宏更 张 蕾
(1江苏省苏微微生物研究有限公司,江苏无锡214063;2江苏安惠生物科技有限公司,江苏南通226009)
蛹虫草(Cordyceps militaris)最早源于中国,俗称北虫草,其药用价值与冬虫夏草相似,为国内外公认的食药用真菌。
优良的菌株是提高食用菌液体发酵水平的关键。目前,针对蛹虫草等食药用菌育种方法主要有自然选择、诱变育种和杂交育种。除利用紫外线、激光和化学诱变剂等物理化学诱变因素来筛选出优良食用菌菌株外,目前研究人员越来越重视利用原生质体融合技术、基因重组技术等来构建新型食用菌发酵菌株。近几年ARTP(常压室温等离子体诱变)技术在微生物育种中受到了重视。与传统诱变方法相比,采用ARTP 能够有效造成DNA 多样性的损伤,突变率高,并易获得遗传稳定性良好的突变菌株;与分子育种相比,ARTP 诱变育种具有操作简便、成本低、无有毒有害物质参与诱变过程等优点。因此,ARTP 在对代谢复杂的微生物进行诱变育种时,显示出独特的优势;ARTP 对环境无污染,操作安全。近年来,ARTP 诱变技术被广泛运用于细菌、酵母、霉菌、放线菌等诱变育种,而在食用真菌菌种(蛹虫草)诱变选育方面很少有报道。
1 材料与方法
1.1 供试材料
(1)出发菌株:SWCor-01,来自江苏省苏微微生物研究有限公司。
(2)培养基:固态培养基为PDA;原生质体再生培养基为麦芽糖5 g,葡萄糖10 g,酵母粉4 g,琼脂5.5 g,0.6 mol/L 甘露醇溶液 1 000 mL,pH 自然;液体发酵培养基为酵母膏0.8%,蛋白胨0.6%,葡萄糖3%,MgSO40.05%,KH2PO40.1%,维生素B110 mg/L。
(3)主要仪器和试剂:常压室温等离子体育种机器(ARTP)(无锡源清天木生物科技有限公司),DYY-6C电泳仪(北京市六一仪器厂),溶壁酶(广东微生物研究所)。三种渗透压稳定剂分别为0.6 mol/L蔗糖,0.6 mol/L甘露醇,0.6 mol/LNaCl。
1.2 试验方法
1.2.1 出发菌株准备
取PDA 斜面上生长旺盛的菌丝,接种于液体培养基中,26 ℃静置培养,每天早晚各摇动一次。
1.2.2 原生质体的制备
用镍丝网过滤收集上述培养2~5 d 的菌丝体,用无菌水和渗透压稳定剂,分别洗涤一次,再悬浮于含渗透压稳定剂的2%的溶壁酶酶液中(酶液用0.25 μm 微孔滤膜过滤除菌),间歇摇动,32 ℃酶解2~5 h 后,用8 层擦镜纸过滤去除残留的菌丝,离心收集原生质体,用渗透压稳定剂洗涤2次后,再加入渗透压稳定剂制成悬浮液,然后用血球计数板计数,调整到原生质体为106/mL。试验选用三种渗透压稳定剂(0.6 mol/L 蔗糖,0.6 mol/L 甘露醇,0.6 mol/L NaCl),制备三种原生质体悬浮液。
1.2.3 ARTP诱变处理
原生质体悬浮液上样量10 μL,处理功率120 W,处理距离2 mm,气流量10 SLM,处理时间(s)为0、20、40、60、80、100、120、150、180、240,每个梯度做3个平行。将诱变后的菌液用0.6 mol/L 的渗透压稳定剂稀释涂布平板,计算致死率,绘制致死率曲线,选择致死率为90%时的处理时间为最佳处理时间,对原生质体进行诱变处理。诱变处理三种原生质体悬浮液,计算致死率,确定最佳参数。
1.2.4 诱变菌株的筛选及同工酶电泳试验验证
采取拮抗反应,聚丙烯酰铵电泳技术结合酯酶同工酶和过氧化物同工酶酶谱分析初筛、鉴定诱变菌株。将初筛后得到的诱变菌株,以出发菌株为对照,进行液体摇瓶发酵试验,对比菌丝体产量和菌丝体蛋白含量。
1.2.5 遗传稳定性试验
将获到的较理想的目标菌株,通过6 次传代培养,液体发酵试验,观察新菌株的遗传稳定性。
2 结果与分析
2.1 ARTP诱变蛹虫草原生质体最佳条件的确定
ARTP 对蛹虫草原生质体诱变后的致死率因渗透压稳定剂而异。由图1 可以看出,以0.6 mol/L 蔗糖为渗透压稳定剂,ARTP 处理120 s 时致死率才67%,在 120~240 s 致死率无明显变化,300 s 时才76.6%;以0.6 mol/L 甘露醇为渗透压稳定剂,ARTP处理240 s 致死率才63%;0.6 mol/L NaCl 为渗透压稳定剂,ARTP 处理40 s 致死率发生明显变化,为61%,240 s 为93%,达最佳致死率指标。因此将诱变最佳条件设定为:以0.6 mol/L NaCl为渗透压稳定剂,处理功率120 W,处理距离2 mm,气流量10SLM,处理时间为240 s。
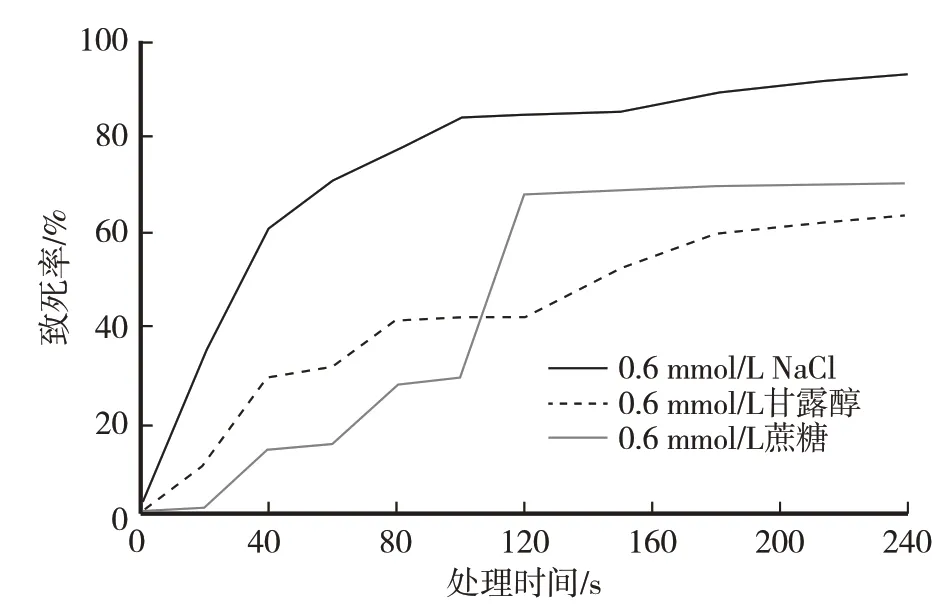
图1 ARTP处理后SW Cor01原生质体致死率
2.2 诱变菌株的筛选及同工酶电泳试验分析
2.2.1 诱变菌株的初筛
将ARTP 诱变处理后的菌悬液涂布于再生培养基平板(在最佳诱变条件的确定过程中一共做了4次试验),一共涂布了800 多块平板,观察有无拮抗反应、菌落长势形态,初筛诱变菌株,筛选出300 多株诱变菌株;将筛选出的300 多株菌株转接平板再筛选:平板(PDA)中心为对照菌株,四周接8 株诱变菌株。观察有无拮抗反应、菌落形态等,结果共筛选出82 株菌株;将82 株菌株分别再与对照菌株进行两两拮抗试验,一共挑选出33 株具有明显拮抗、菌丝生长速度快的菌株。并对33 株菌株进行液体发酵试验、同工酶电泳试验的复筛。
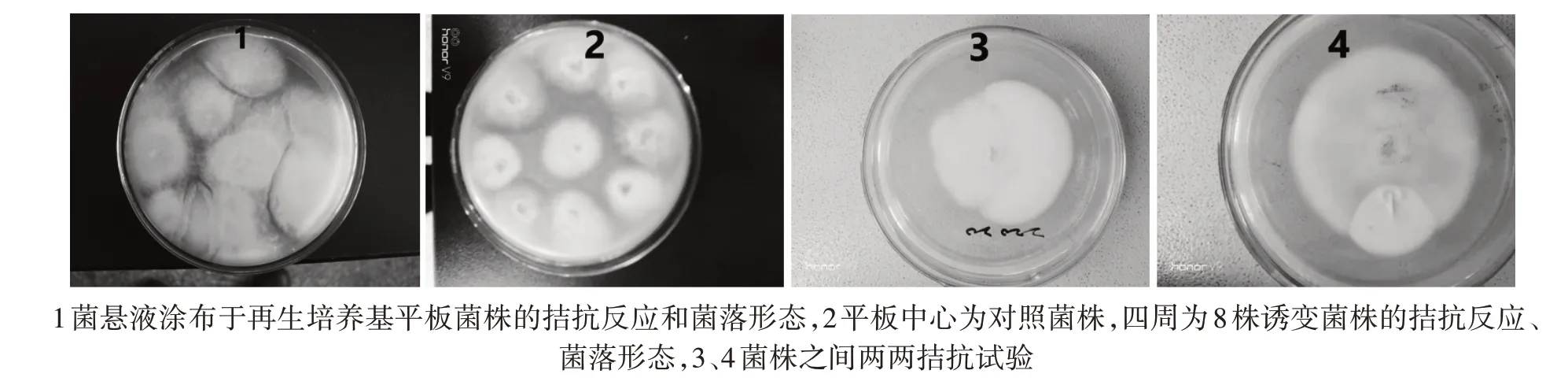
图2 部分诱变菌株拮抗试验照片
2.2.2 诱变菌株的复筛
2.2.2.1 同工酶电泳分析
凝胶电泳显示酯酶同工酶酶谱从阴极向阳极有14 条不同酯酶同工酶条带,这14 条谱带的Rf值在0.1~0.9,诱变菌株酶带数量有一定的差异,其中出发菌株有 9 条酶带,Cor15003 有 11 条,Cor16011有 7 条,Cor20004 有 8 条,Cor22021 有 8 条 Cor27012有11 条,共有谱带为3、8、9、11、12、13,部分菌株同工酶酶谱分析结果见图3。将同工酶电泳分析筛选获得13株变异菌株进行液体发酵试验。
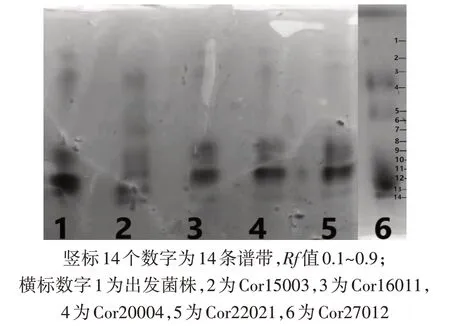
图3 部分诱变菌株同工酶电泳分析图谱
2.2.2.2 液体发酵试验
液体发酵试验方法参照文献[9]。26 ℃恒温摇床140 r/min 旋转培养5 d 后,测定菌丝生物量、菌丝体蛋白含量、菌丝体蛋白得率(表1)。
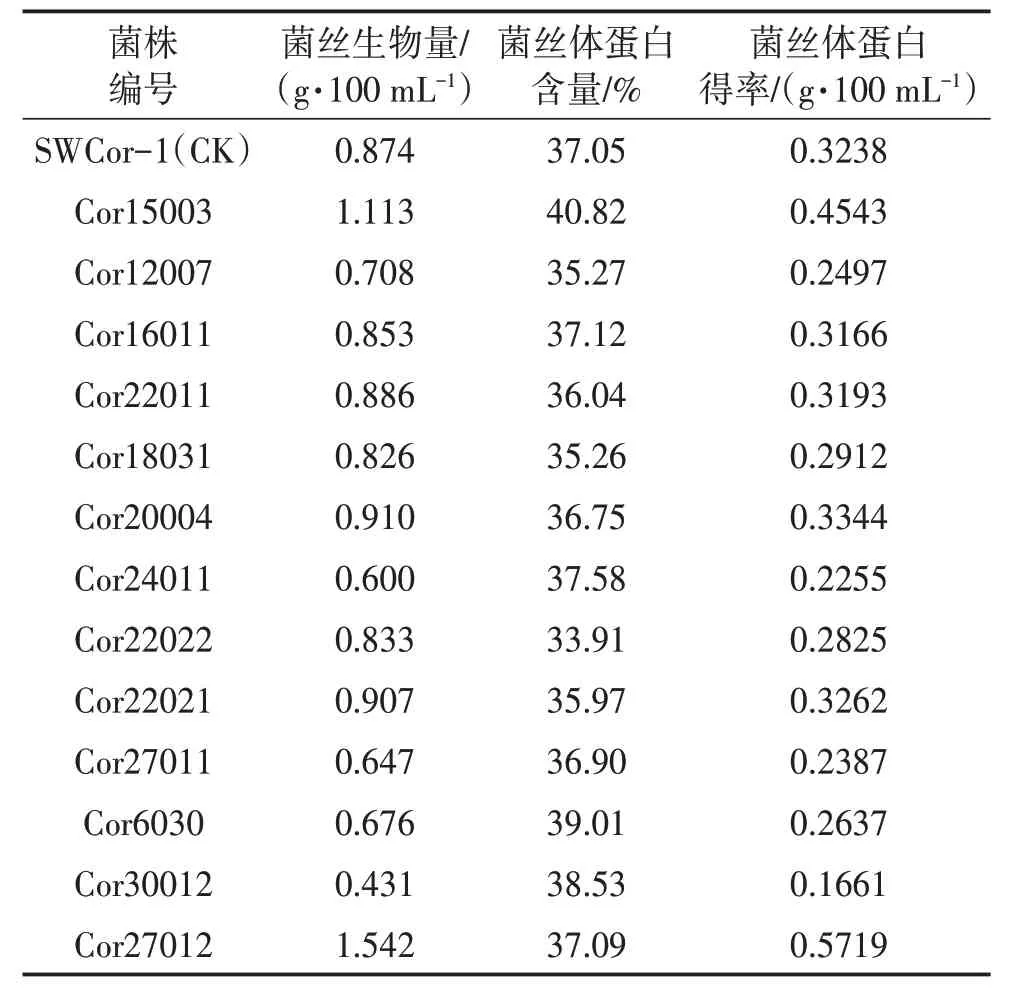
表1 13株诱变菌株与对照菌株液体发酵结果
由表1 可见,菌丝体蛋白含量高于对照有4 株,其中菌丝体蛋白含量最高的菌株为Cor15003,高于对照10.18%;液体发酵生物量高于对照菌株的有5株,其中Cor27012、Cor15003 分别较对照提高了76.4%、27.35%;菌丝体蛋白得率高于对照的有4株,其中Cor27012、Cor15003 分别较对照提高了76.62%、40.30%。
2.2.2.3 液体发酵罐工业化发酵生产验证试验
发酵罐(通气加搅拌)容积200 L,装液量120 L,搅拌转速150 r/min,通气量1∶0.5~1,压差法接种,接种量为8%,25~26 ℃培养。添加0.1%豆油作为消泡剂,发酵72 h,结果见表2。
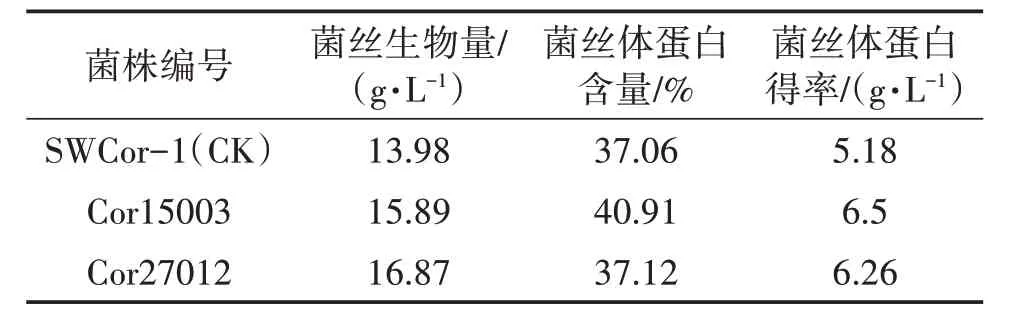
表2 200 L罐液体发酵结果
从表2可以看出,Cor15003、Cor27012比对照液体发酵菌丝生物量分别提高13.66%、20.67%,蛋白得率分别提高25.48%、20.85%。
2.3 遗传稳定性试验
为了分析诱变菌株的遗传稳定性,对两株优势菌株进行遗传稳定性试验。两株菌株在固体培养基上进行了6代传代培养后,进行液体发酵试验,结果见表3。由表3 可知,传代后菌株的菌丝体生物量、蛋白含量、蛋白得率与传代前几乎一致,Cor15003号菌株表现最优。
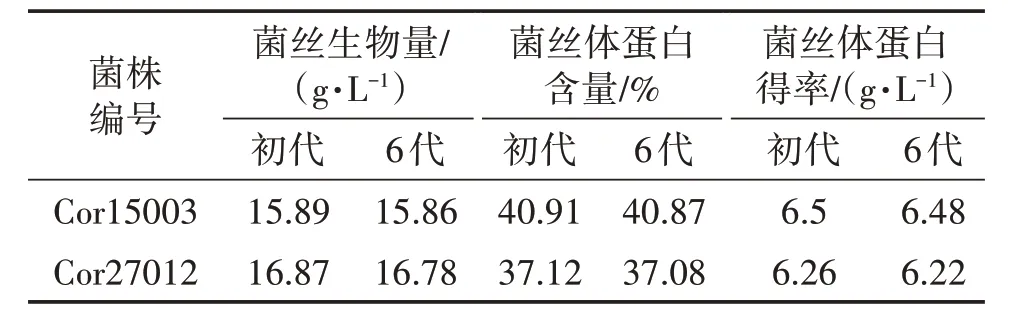
表3 传代菌株发酵试验结果
3 小结与讨论
食药用菌突变菌株的筛选是一个很繁杂的工程,目前尚未找到一些简便的方法,比如营养缺陷型的筛选,主要通过菌株之间的拮抗,菌落形态及生长势进行初筛,感官意识比较强。因此试验设计时就要求较高致死率(90%),这样平板菌落数就比较少,便于初筛。试验获得了一组最佳诱变参数:以0.6 mol/LNaCl 为渗透压稳定剂,处理功率120 W,处理距离2 mm,气流量10SLM,处理时间为240 s,致死率93%。成功筛选到两株高蛋白突变菌株:Cor27012、Cor15003。试验结果说明最佳致死率,提高了菌株的诱变率、降低了筛选的难度,但由于对特定菌株的筛选有很大的随机性,所以最佳致死率不一定能筛选到理想菌株。
三种稳渗剂中,0.6 mol/L 的甘露醇、0.6 mol/L 的蔗糖致死率较低,0.6 mol/L NaCl 为渗透压稳定剂,进行ARTP 诱变,高能He 离子的穿透力比较强,致死率比较高。
目前,常压室温等离子体作为一种新的诱变源,因其独特的诱变机理和生物效应在微生物育种中得到迅速推广。ARTP 对生物的遗传物质损伤效果明显、损伤机制丰富,尤其是对于染色体等真核生物的遗传物质均有很强的损伤效果;因而ARTP较其他诱变方法显示出更高效的突变性能、更广谱的适用范围。试验对应用ARTP 技术选育食用菌新菌株具有指导作用。
