Werner综合征一例及其精准诊断
2020-10-24霞尔巴提哈布烈提王蓉蓉马东来张学
霞尔巴提·哈布烈提 王蓉蓉 马东来 张学
1中国医学科学院基础医学研究所北京协和医学院基础学院麦库西克-张孝骞协和遗传医学中心医学分子生物学国家重点实验室,北京100005;2中国医学科学院北京协和医学院北京协和医院皮肤科100730
Werner 综合征(WS)为白内障-硬皮病-早老综合征,是由WRN 基因突变引起的常染色体隐性遗传疾病。临床表现涉及多系统改变,过早衰老为其特征性表现。WS患者临床表现多样,异质性较强,误诊率较高。我们报道1例以双足第1 跖趾关节疼痛伴四肢皮肤变硬为主要表现的WS 患者及其WRN基因突变情况。
一、病历资料
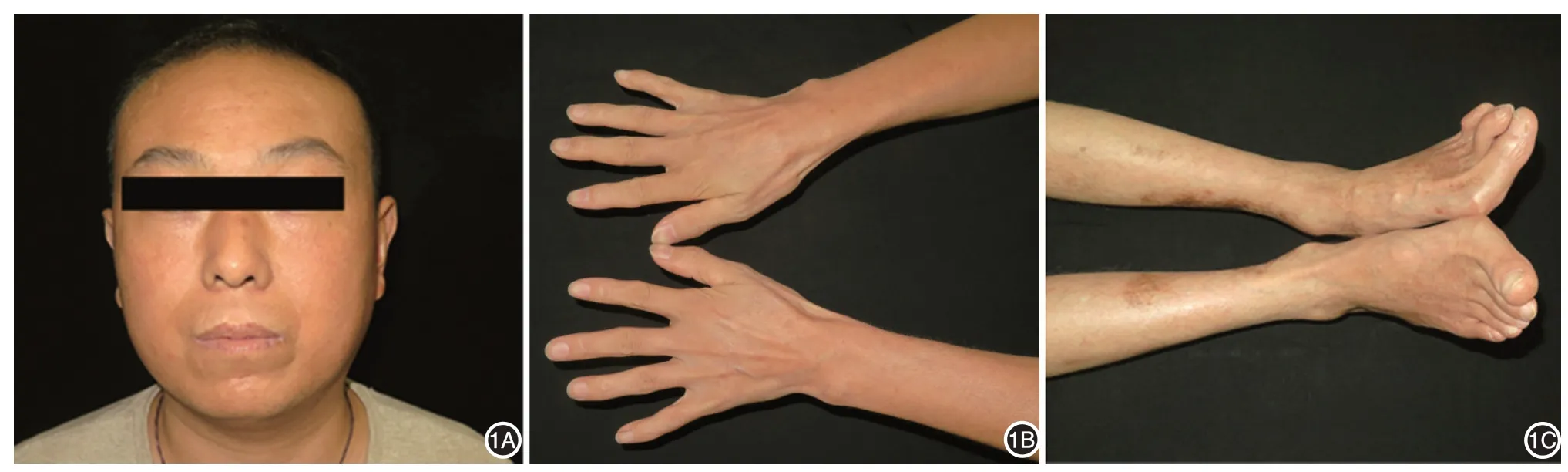
患者男,31岁,未婚。2018年8月来北京协和医院皮肤科就诊。患者自幼体格瘦小,2003年起声音音调变细而高伴嘶哑,并逐渐加重,于郑州大学第一附属医院行纤维(电子)鼻咽喉镜检查,显示双侧声带黏膜光滑、萎缩,活动可,闭合不严。2016年体检时诊断为“白内障”,并接受白内障摘除术,否认视物模糊史。2018 年初双足第1 跖趾关节疼痛僵硬,伴双足活动受限,于河南中医药大学第一附属医院行骨密度检查,示双手足骨质疏松改变,跟腱处有钙质沉积。心脏彩超提示二、三尖瓣及主动脉瓣少量反流,左室舒张功能降低,心律失常(室性早搏),无自觉症状。饮食、二便正常。否认家族中其他成员有类似疾病,否认父母为近亲结婚,1 姐和1兄均健康。患者父母已去世,否认生前存在与其相同的临床表现。体检:一般情况可,发育欠佳,身高163 cm,体重52.5 kg,声音嘶哑,全身皮肤光滑、发亮。皮下脂肪萎缩,以四肢为重。面部皮下脂肪萎缩,“小鸟样”面容不明显,四肢皮肤变硬,双侧第1跖趾关节外翻。见图1。拟诊:硬皮病;硬皮病相关综合征。
二、基因检测
1.基因组DNA提取:本研究经北京协和医院伦理委员会审核批准(015⁃2015),所有受试者均签署知情同意书。抽取患者及其哥哥和姐姐外周血各6 ml于乙二胺四乙酸抗凝管中。各取200 μl 外周血,采用QIAGEN 外周血DNA 提取试剂盒(德国QIAGEN公司)提取外周血基因组DNA。同时提取来自北京协和医院体检中心的200 例健康对照DNA。
2.外周血RNA 的提取与反转录:取新鲜血250 μl 加入750 μl Trizol试剂,-80 ℃冰箱保存。采用Trizol法提取外周血总RNA,用TaKaRa PrimeScriptTMRT reagent Kit 反转录试剂盒(日本Takara 公司)进行逆转录,转录后的cDNA 置于-20 ℃冰箱保存备用。
3. 基因测序:取患者外周血基因组DNA 1 μg 送明码(上海)生物科技有限公司进行WES 检测,采用Agilent SureSelect All Human Exome library 系统捕获目的片段并扩增,通过Illumina Hiseq X测序,并进行数据分析和可疑致病位点筛选。针对WES 筛选出来的变异位点设计引物,从USCS 基因数据库(http://genome.ucsc.edu)获取基因序列信息,利用Prime3 Input(version 0.4.0,http://bioinfo.ut.ee/primer3⁃0.4.0/)在线设计引物,引物序列见表1(WRN⁃24),对患者及其家人和200例健康对照进行Sanger测序验证。
4.实时荧光定量PCR 检测突变外显子拷贝数:利用实时荧光定量PCR 检测患者及其哥哥、姐姐和2 例健康对照外周血基因组DNA中突变所在的外显子拷贝数,并对患者姐姐、患者及健康对照外周血RNA 逆转录后的cDNA 进行定量分析,引物序列见表1。使用Rotor⁃Gene 6000荧光定量PCR 系统(德国QIAGEN 公司)进行实时荧光定量PCR,反应条件:95°预变性30 s;95° 5 s、60° 10 s、72° 20 s,40 个循环,并以2-△△Ct表示WRN基因mRNA的相对表达量。
三、结果
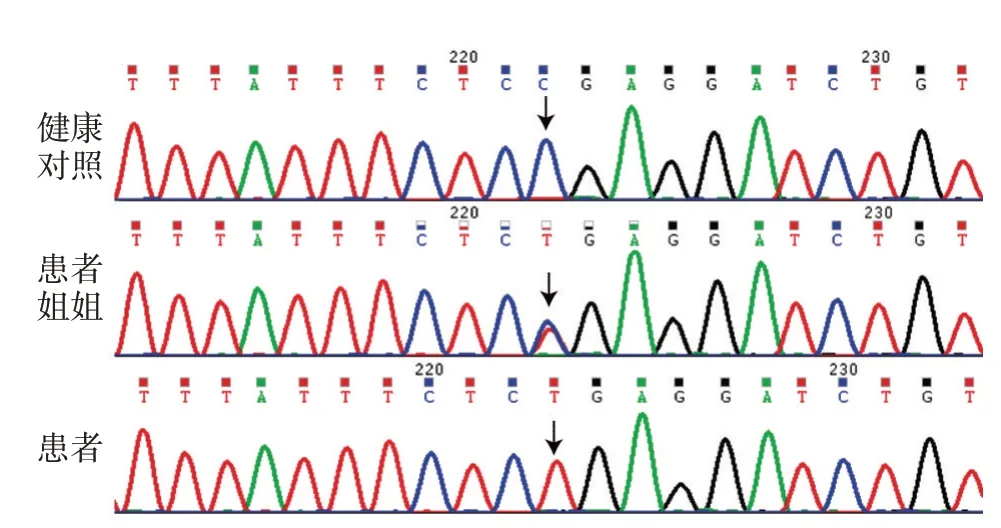
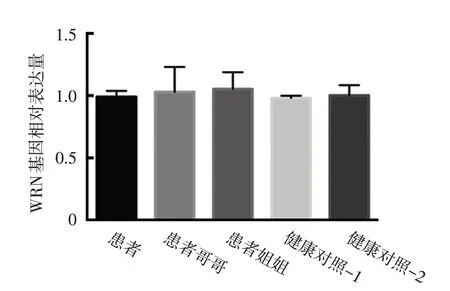
WES 及Sanger 测序显示,该患者存在1 处纯合突变,WRN 基因在第24 号外显子2 959 位发生c.2959C>T 突变,造成所编码的WRN 蛋白在第987 位氨基酸处提前出现终止密码子。患者的哥哥和姐姐均为此突变的杂合携带者,见图2。在人群基因组突变频率数据库ExAC(http://exac.broadinstitute.org) 及 gnomAD (http://gnomad ⁃ old.broadinstitute.org)中该突变的发生频率分别为0.000 024 76和0.000 025 27,且为HGMD 数据库中收录的导致WS 的致病突变之一。200 例健康对照未发现相同突变。根据ACMG 遗传变异分类标准分析,该突变位点致病性(http://wintervar.wglab.org),显示该变异满足1 个非常强(PVS1)和1个中等(PM2)、1个支持(PP3)证据,可认为该变异为致病变异。实时定量PCR 表明,患者突变所在外显子处基因序列拷贝数与健康对照一致(图3),排除基因组在此区域内存在重复或缺失。
针对患者WRN基因mRNA的实时定量PCR显示,患者的WRN 基因表达量明显降低,以健康对照基因表达量1.00±0.07 为参照,患者的WRN 基因相对表达量为0.27±0.04;患者姐姐为WRN c.2959C>T(p.R987*)突变杂合携带者,WRN 基因相对表达量为0.62±0.03,表明此突变将导致WRN基因mRNA部分降解。
四、讨论
本文患者以双足第1跖趾关节疼痛伴四肢皮肤变硬为主诉,逐渐出现身体多系统病变。根据WS国际注册网站提供的诊断标准[1],本例患者临床表现上包括前3 项主征(白内障、典型皮肤病变及身材矮小),外加骨质疏松和声音改变2项次征,满足临床拟诊WS要求,为了明确患者诊断,采用WES测序法对患者基因组DNA进行突变筛查,并鉴定出患者在WRN基因上存在一处纯合无义突变,且为文献报道的导致WS 的致病突变之一[2]。结合本例临床与基因检测结果,确诊为WS。
WRN 基因是WS 唯一已知致病基因,仅以常染色体隐性遗传方式遗传[3]。WRN基因编码的WRN蛋白属于RecQ型解旋酶家族,包含5个功能结构域[4⁃9]。曾报道的WRN基因突变类型主要有移码突变、剪接位点突变、错义突变以及提前终止密码突变(premature termination codon,PTC),PTC突变占WRN 所有突变的10%以上[9],可导致蛋白质翻译终止甚至降解,使其不能在细胞核中发挥功能[10]。

引物名称WRN⁃24 WRN⁃q⁃24 WRN⁃q正向引物(5′→3′)GAAGCAGTTGGCACATTTGA CGCCTAAGATGTCCACAGCAG ATGGCCAAAATGAGACCAACT反向引物(5′→3′)TGAGCTGCAGAGCTGAACAT GCCTTTGCTAAGCTTTCTTCA GCTACCAGACTCGTCTTCTGT退火温度(℃)59.9 61.0 60.0产物长度(bp)493 140 185
本文WRN c.2959C>T(p.R987*)突变为罕见变异,是已报道的WRN 基因致病突变之一[2],也属于PTC 突变,位于WRN基因第24号外显子。患者否认其父母近亲婚配,且均已去世,其姐姐与哥哥均为此突变的杂合携带者,该突变位点所在区域的基因组DNA 定量分析结果排除了患者在此处存在外显子杂合性缺失的可能,根据ACMG 遗传变异分类联合标准规则,该变异为“致病”突变。该PTC 突变造成WRN 蛋白C端NLS区域缺失,而迄今鉴定出的大部分突变都是因为形成缺乏NLS 区域的截短蛋白而致病,且通常在WS 患者来源的细胞系中检测不到这些截短的WRN 蛋白,这也表明截短的蛋白质在细胞质中不稳定并快速降解[11]。而针对WRN 基因mRNA 进行的实时荧光定量PCR 显示患者WRN基因表达水平较健康对照明显降低,表明此突变通过无义介导的mRNA 部分降解(nonsense mediated mRNA decay)而致病。由于无法获得患者父母外周血样本,我们只能根据实验结果做出以下3 种推测:①患者父母均为此突变的携带者,虽3代以内非近亲,但有可能为同一祖先来源;②父母仅一方为此突变的携带者,患者属于单亲源二体(uniparental diosmy),两条8号染色体在突变所在的部分区域都来自携带者一方;③父母仅一方为此突变携带者,而患者在遗传了带有突变的一条等位基因的基础上,在另一条等位基因同一处自发产生了相同的突变,这种情况极为罕见。
综上,我们通过WES 检测到本文患者WRN 基因存在c.2959C>T(p.R987*)突变,实现了疾病的精准诊断。确诊后应建议患者定期检查,防治可能发生的并发症,如糖尿病、早发动脉硬化以及恶性肿瘤等。
利益冲突所有作者均声明不存在利益冲突
