响应面法优化珍珠龙胆石斑鱼肉肽的酶法制备工艺及酶解产物的抗氧化活性
2020-10-23林泽安李子青江彩珍范秀萍苏伟明
徐 杰,林泽安,李子青,江彩珍,范秀萍,2,*,苏伟明
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,水产品深加工广东普通高等学校重点实验室,广东湛江 524088;2.南方海洋科学与工程广东省实验室,广东湛江 524088)
珍珠龙胆石斑鱼(♀Epinephelusfuscoguttatus×♂Epinephleuslanceolatus),俗称龙虎斑,是目前中国南方地区海水养殖的主要经济鱼类[1]。其具有生长快、环境耐受性强、病害少、鱼皮胶原蛋白含量高、肉质纤维细腻等优势,目前以活体销售为主要的消费模式,价格较高[1-4]。由于受到鲜活水产品保活流通方式与技术的限制,在运输与销售过程中的死亡个体很多,死亡个体通常以冰鲜的方式进行销售,但价格便宜。
珍珠龙胆石斑鱼肉是一种高蛋白、低脂肪的优质蛋白质原料,其背部肌肉的蛋白质(干基)含量甚至达到85.19%,可以作为各类蛋白与多肽类产品的原材料[5-6]。国内外关于鱼肉肽的提取制备及其活性研究主要有罗非鱼[7-8]、鳕鱼[9-10]、鲐鲅鱼[11-13]及一些淡水鱼[14-16]等,且以酶法制备为主,该法具有条件温和、效率高等优势;同时也有采用发酵法制备抗氧化肽的。但对石斑鱼精深加工的相关研究报道还相对较少,因此,对珍珠龙胆石斑鱼肉的开发利用是目前研究的重要方向[2,17]。
本实验以珍珠龙胆石斑鱼肉为原材料,采用生物酶解法制备石斑鱼肉肽,以水解度和1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率为指标,利用单因素实验及响应面优化的方法探究最佳酶解条件,并采用DPPH自由基清除率、羟基自由基(·OH)清除率和总还原力为抗氧化指标来评价其酶解产物及超滤分离组分的抗氧化活性,以期为珍珠龙胆石斑鱼的精深加工提供新的方法与理论依据。
1 材料与方法
1.1 材料与仪器
鲜活珍珠龙胆石斑鱼 购于霞山水产品批发市场;风味蛋白酶(3×104U/g)、碱性蛋白酶(15×104U/g)、木瓜蛋白酶(21×104U/g)、中性蛋白酶(20×104U/g)、动物蛋白酶(23×104U/g) 购自广西南宁东恒华道生物科技有限责任公司;甲醛、氢氧化钠、无水乙醇、盐酸、硼酸、三氯乙酸、硫酸、邻二氮菲、H2O2、铁氰化钾、三氯化铁、硫酸亚铁 购自广州市金华大化学试剂有限公司,均为分析纯;1,1-二苯基-2-苦基肼(1,1-dipHenyl-2-picrylhydrazyl,DPPH) 购自上海源叶生物科技有限公司;其他试剂 均为国产分析纯。
HHS型电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;BSA224S-CW型万分之一电子天平 赛多利斯科学仪器(北京)有限公司;JY12002型电子天平 上海良平仪器仪表有限公司;5810R台式高速大容量冷冻离心机 艾本德中国有限公司;Sorvall LYNX 6000高速落地离心机 美国赛默飞世尔科技公司;Varioskan Flash酶标仪 美国赛默飞世尔科技公司;高速组织捣碎机 上海标本模型厂;pHS-3C型雷磁pH计 上海仪电科学仪器股份有限公司;T18高速分散机ULTRA-TURRAX 德国IKA公司;Mini pellicon型超滤装置 默克密理博实验室设备(上海)有限公司;FD-551型冷冻干燥机 上海爱朗仪器有限公司;Vapodest凯氏定氮仪 德国格哈特分析仪器有限公司;N-1100V-WB型旋转蒸发仪 上海爱朗仪器有限公司。
1.2 实验方法
1.2.1 原料预处理 鲜活石斑鱼,取其背部及腹部肌肉(注意不要割破血管),用生理盐水清洗后拭干,于高速组织捣碎机中捣碎,分装,置于-20 ℃冰箱冷冻保存备用。
1.2.2 酶法制备工艺 实验时取出冰冻的珍珠龙胆石斑鱼肉糜于室温解冻,之后称取一定量解冻后的石斑鱼肉糜于烧杯中按料水比加入蒸馏水,再依此调节pH、温度,按酶添加量加入酶剂在水浴锅中酶解,酶解到特定时间后迅速取出烧杯,在沸水浴中灭酶10 min,再等冷却至室温后,分装于离心管中,在4000 r/min的条件下离心10 min,取其上清液,再依此进行超滤分级、旋转蒸发浓缩、真空冷冻干燥,最终得到干燥粉末产品。
1.2.3 酶的选择 取鱼肉20 g,分别加入400 U/g的风味蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶、动物蛋白酶,pH为7.0(碱性蛋白酶为pH8.0)及温度为50 ℃,料水比1∶5(鱼肉与水质量体积比,g/mL)酶解4 h,测得水解度(DH)及DPPH自由基清除率,选取最佳作用酶。
1.2.4 单因素实验
1.2.4.1 料水比对水解度和DPPH自由基清除率的影响 选取风味蛋白酶,酶添加量400 U/g,在pH7.0、50 ℃条件下酶解4 h,设置不同料水比(1∶1、1∶2、1∶3、1∶4、1∶6、1∶8),分别测得水解度及DPPH自由基清除率,考察料水比对水解度和DPPH自由基清除率的影响。
1.2.4.2 pH对水解度和DPPH自由基清除率的影响 选取风味蛋白酶,酶添加量400 U/g,在50 ℃、料水比1∶4条件下酶解4 h,设置不同pH(5.5、6.0、6.5、7.0、7.5),分别测得水解度及DPPH自由基清除率,考察pH对水解度和DPPH自由基清除率的影响。
1.2.4.3 酶解时间对水解度和DPPH自由基清除率的影响 选取风味蛋白酶,酶添加量400 U/g,在pH7.0、50 ℃、料水比1∶4条件下酶解,设置不同时间(2、3、4、5、6、7 h),分别测得水解度及DPPH自由基清除率,考察酶解时间对水解度和DPPH自由基清除率的影响。
1.2.4.4 酶解温度对水解度和DPPH自由基清除率的影响 选取风味蛋白酶,酶添加量400 U/g,在pH7.0、料水比1∶4条件下酶解5 h,设置不同温度(40、45、50、55、60 ℃),分别测得水解度及DPPH自由基清除率,考察酶解温度对水解度和DPPH自由基清除率的影响。
1.2.4.5 酶添加量对水解度和DPPH自由基清除率的影响 选取风味蛋白酶,在pH7.0、55 ℃、料水比1∶4条件下酶解5 h,设置不同酶添加量(150、300、600、900、1200 U/g),分别测得水解度及DPPH自由基清除率,考察酶添加量对水解度和DPPH自由基清除率的影响。
1.2.5 酶解工艺优化 根据Box-Benhnken中心组合实验设计原理[18],运用 Design-Expert V8.0.6.1软件,基于单因素实验结果,采用4因素3水平的响应面分析法,固定酶解pH7.0,以料水比(A)、酶解时间(B)、酶解温度(C)、酶添加量(D)为自变量,酶解液水解度(DH,Y)为响应值,各因素三个水平采用-1、0、1进行编码,因素水平和编码见表1。
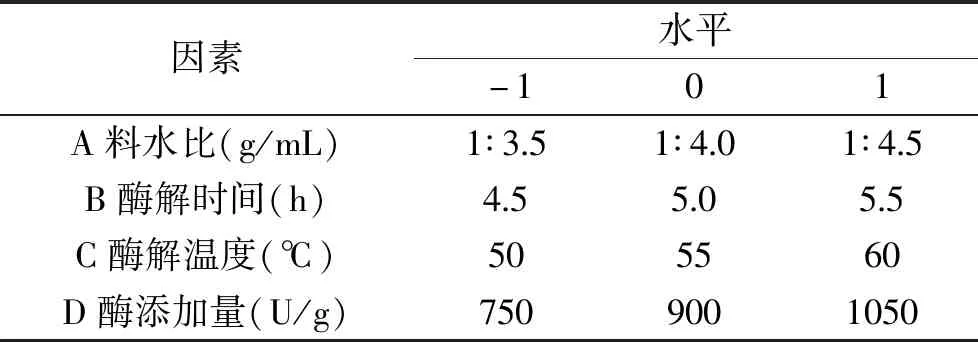
表1 Box-Benhnken试验因素水平设计
1.2.6 水解度测定 原料总氮含量用凯氏定氮法(GB 5009.5-2016)测定;氨基酸态氮用酸度计法(GB 5009.235-2016)测定。水解度(DH)的计算公式为:
DH(%)=(水解液中氨基态氮-原料中游离氨基态氮)/(原料中总氮含量-原料中非蛋白氮)×100
1.2.7 珍珠龙胆石斑鱼肉酶法制备上清液及超滤分离 根据Box-Behnken实验优化确定的酶法制备的最佳工艺参数,制备珍珠龙胆石斑鱼肉粗酶解产物(EH)。选用截留不同分子量的超滤膜(8、5、3 kDa)对酶解上清液进行分离纯化后冷冻干燥,分别得到不同的超滤组分:EH-1(>8 kDa)、EH-2(5~8 kDa)、EH-3(3~5 kDa)和EH-4(<3 kDa)。
1.2.8 酶解上清液及超滤组分的抗氧化活性测定
1.2.8.1 DPPH自由基清除率的测定 参照Nurdiani等[19]的方法并略有修改,取0.4 mL不同质量浓度的样品溶液,加入0.4 mL新配制DPPH溶液(1×10-4mol/L),摇匀、室温下避光放置30 min,于517 nm波长处测定吸光度(A1);以等量无水乙醇代替DPPH溶液重复上述步骤,测定吸光度(A2);以等量无水乙醇代替样品溶液重复上述步骤,测定吸光度(A3)。清除率(Q)按下列公式计算:
1.2.8.2 羟基自由基(·OH)清除率的测定 参照Wang[20]的方法并略有修改,取0.3 mL邻二氮菲乙醇溶液(5 mmol/L),加入0.2 mL的磷酸盐缓冲液(0.15 mol/L,pH7.40)和0.3 mL的FeSO4溶液(0.75 mmol/L),加入待测不同质量浓度的样品溶液1 mL混匀后,加入0.2 mL的H2O2(0.1%)摇匀,37 ℃条件下水浴60 min,于536 nm波长处测定吸光度(A1);以等量磷酸盐缓冲液(0.15 mol/L,pH7.40)代替邻二氮菲乙醇溶液、FeSO4溶液和H2O2溶液重复上述步骤,测定吸光度(A2);以等量超纯水代替样品溶液和H2O2溶液重复上述步骤,测定吸光度(A3);以等量超纯水代替样品溶液重复上述步骤,测定吸光度(A4)。清除率(Q)按下列公式计算:
1.2.8.3 总还原力的测定 参照袁燕[21]的方法并略有修改,取1 mL的磷酸盐缓冲液(0.2 mol/L,pH6.6),加入0.1 mL待测不同质量浓度的样品溶液和1 mL的铁氰化钾溶液(1%),50 ℃条件下水浴反应20 min后迅速冷却,加入1 mL的三氯乙酸溶液(10%),3000 r/min离心20 min,取上清液1 mL,加入1 mL超纯水和0.2 mL的FeCl3溶液(0.1%),混匀后室温放置10 min,测定700 nm的吸光值。
1.3 数据处理
采用MS Excel 2010软件作图;采用Design-Expert V8.0.6.1软件进行响应面优化分析;采用IC50计算软件计算IC50值,实验结果均以(X±SD)表示。
2 结果与分析
2.1 酶的选择
如图1所示,在相同酶活力添加量的情况下,五种蛋白酶的水解效果如下:水解度:风味蛋白酶>中性蛋白酶>木瓜蛋白酶>动物蛋白酶>碱性蛋白酶;DPPH自由基清除率:风味蛋白酶>碱性蛋白酶>动物蛋白酶>中性蛋白酶>木瓜蛋白酶。由于酶具有专一性的特点,其与底物反应有一定特异性,在不同蛋白酶的酶解下,鱼肉水解所得的短肽有一定差异,从而影响水解度和DPPH自由基清除率。所以综合水解度及DPPH自由基清除率两组实验数据,选取风味蛋白酶来进行单因素实验及响应面优化,以确定该酶对于珍珠龙胆石斑鱼肉的最佳酶解条件。陈周[22]、田裕心[23]等均表明用风味蛋白酶对水产品进行酶解,其酶解效果及风味均有较好改善。
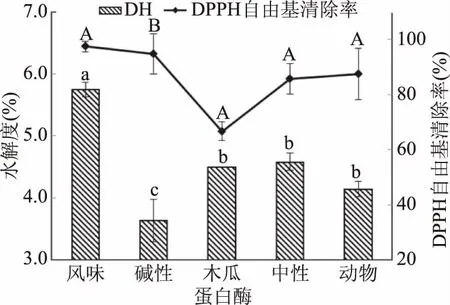
图1 不同蛋白酶对石斑鱼肉酶解DH和DPPH自由基清除率的影响
2.2 单因素实验
2.2.1 不同料水比对水解度和DPPH自由基清除率的影响 如图2所示,随着水添加量的上升,水解度先上升后下降,DPPH自由基清除率在1∶2的料水比时出现最低值;在料水比为1∶1时,DPPH自由基清除率高达96.86%,可能是由大分子的蛋白复合物也具有自由基清除作用。料水比小于1∶4时,酶与鱼肉的结合较为紧密,呈现饱和,所以水解度达到最大值6.20%,抗氧化短肽含量也在增加;当料水比大于1∶4时,匀浆液中酶与鱼肉蛋白结合较松散,造成水解度在后期呈现下降趋势;并且使得鱼肉中抗氧化肽的析出变缓,所以其DPPH自由基清除率趋于平缓。因此,酶解料水比应选择1∶4为佳。
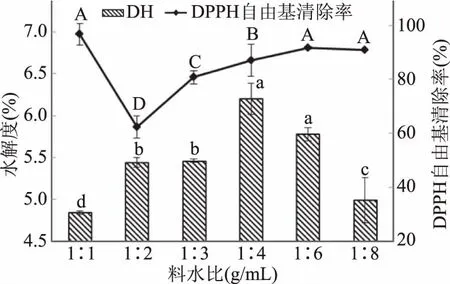
图2 不同料水比对石斑鱼肉酶解DH和DPPH自由基清除率的影响
2.2.2 不同pH对水解度和DPPH自由基清除率的影响 如图3所示,当pH<7时,水解度先迅速上升后变为平缓,DPPH自由基清除率均处于较低水平,当pH7时,水解度及DPPH自由基清除率达到最高,而后呈下降趋势。这是由于酶的活性受pH影响较大,pH越低或越高,对酶活力的影响都很大,从而影响酶的催化效果,风味蛋白酶是一种中性蛋白酶,在pH7.0时有水解度最高且DPPH自由基清除率达到99.19%。从图3可知,当pH5.5时与pH7.0时的DPPH自由基清除率均达到90%以上,按照趋势pH5.5时DPPH自由基清除率应该最低,推测是由于pH较低时水解度较低,离心之后上清液依旧含有固体悬浮物,对DPPH自由基清除率的测定造成了一定影响。因此,酶解pH应选择7.0为佳。
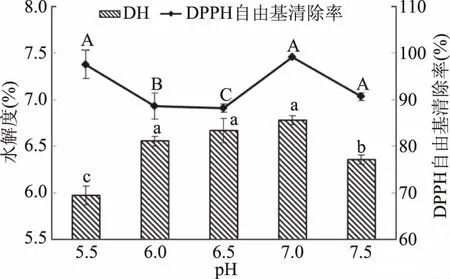
图3 不同pH对石斑鱼肉酶解DH和DPPH自由基清除率的影响
2.2.3 不同酶解时间对水解度和DPPH自由基清除率的影响 如图4所示,当酶解时间小于5 h时,水解度及DPPH自由基清除率均随时间的延长而上升;当时间到达5 h时,达到最高,随后趋于平缓。当在加酶量与料水比一定时,酶与鱼肉作用的程度有限,延长时间可以使其充分反应,游离氨基酸及抗氧化肽析出上升,水解度及清除率增加;但当达到体系限度时趋于平缓,游离氨基酸及抗氧化肽析出饱和,水解度及清除率液趋于平缓。因此,酶解时间应选择5 h为佳。
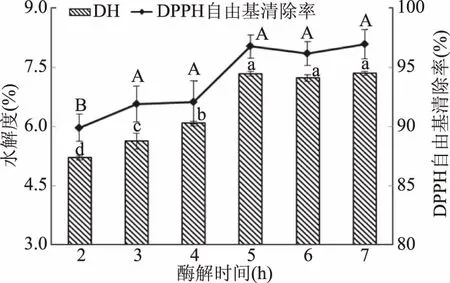
图4 不同酶解时间对石斑鱼肉酶解DH和DPPH自由基清除率的影响
2.2.4 不同酶解温度对水解度和DPPH自由基清除率的影响 如图5所示,当温度低于55 ℃时,水解度随温度的升高明显增加,DPPH自由基清除率无显著变化;当温度高于55 ℃时,水解度及DPPH自由基清除率均呈下降趋势。这是由于温度时影响酶活力的主要因素之一,当温度低于55 ℃时,随着温度的上升,酶解速度加快,水解速度增大;当温度高于55 ℃时,酶失活严重,酶解速度降低,抗氧化肽析出减少,所以水解度及DPPH自由基清除率均下降。因此,酶解温度应选择55 ℃为佳。
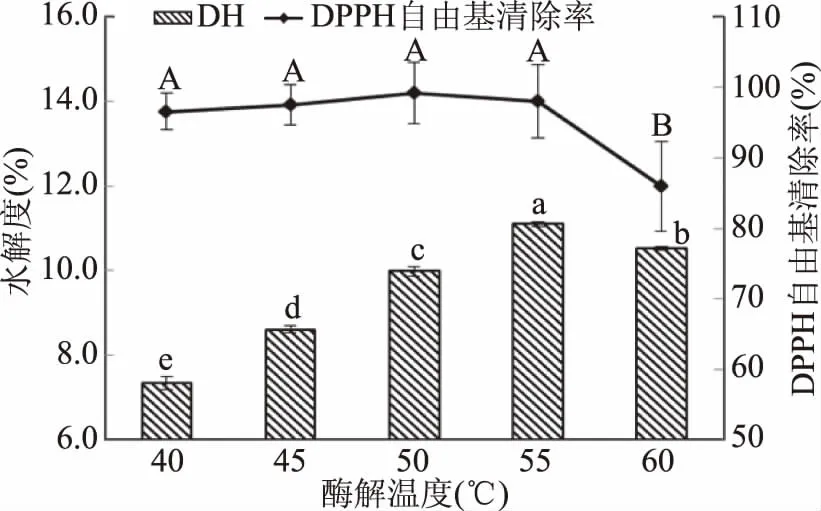
图5 不同酶解温度对石斑鱼肉酶解DH和DPPH自由基清除率的影响
2.2.5 酶添加量对水解度和DPPH自由基清除率的影响 如图6所示,当酶添加量低于900 U/g时,水解度和DPPH自由基清除率均随酶添加量的增加而上升;当酶添加量大于900 U/g时,水解度基本趋于平缓,DPPH自由基清除率有所下降。当酶添加量增加的时候,底物总量不变,体系在其他因素满足的条件下,酶解液中的游离氨基态氮含量会饱和,所以水解度后期趋于平缓;当酶添加量增加的时候,酶解上清液的颜色加深,且腥味更重,可能会影响酶解产物中抗氧化肽的活性,造成DPPH自由基清除能力下降。因此,酶添加量应选择900 U/g为佳。
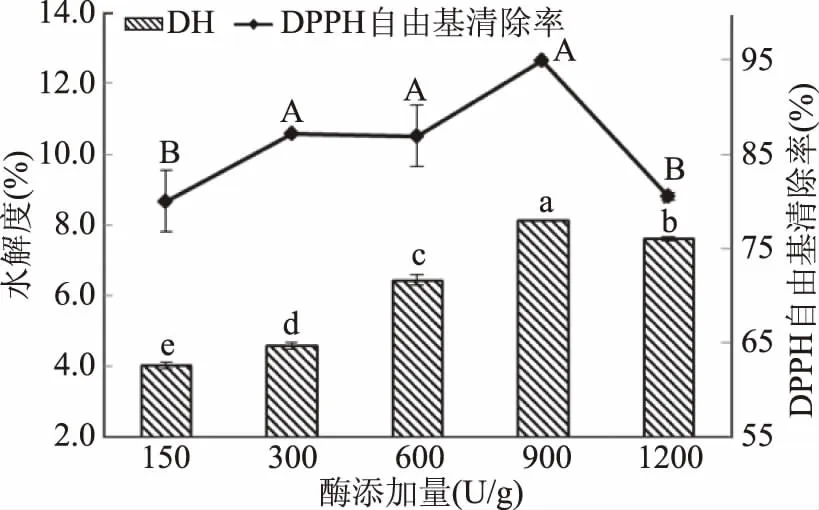
图6 不同酶添加量对石斑鱼肉酶解DH和DPPH自由基清除率的影响
2.3 Box-Benhnken试验结果
2.3.1 Box-Benhnken试验设计及结果 根据单因素实验的结果,利用Design-Expert V8.0.6.1软件设计与分析,设计试验方案及结果如表2所示,以水解度(DH)为响应值,共设计29组试验方案,包含24组析因试验组及5个中心试验组。同时也检测了每组的DPPH自由基清除率。但以DPPH自由基清除率为响应值进行分析时,模型整体不显著,因此文中仅以水解度作为响应值进行分析。
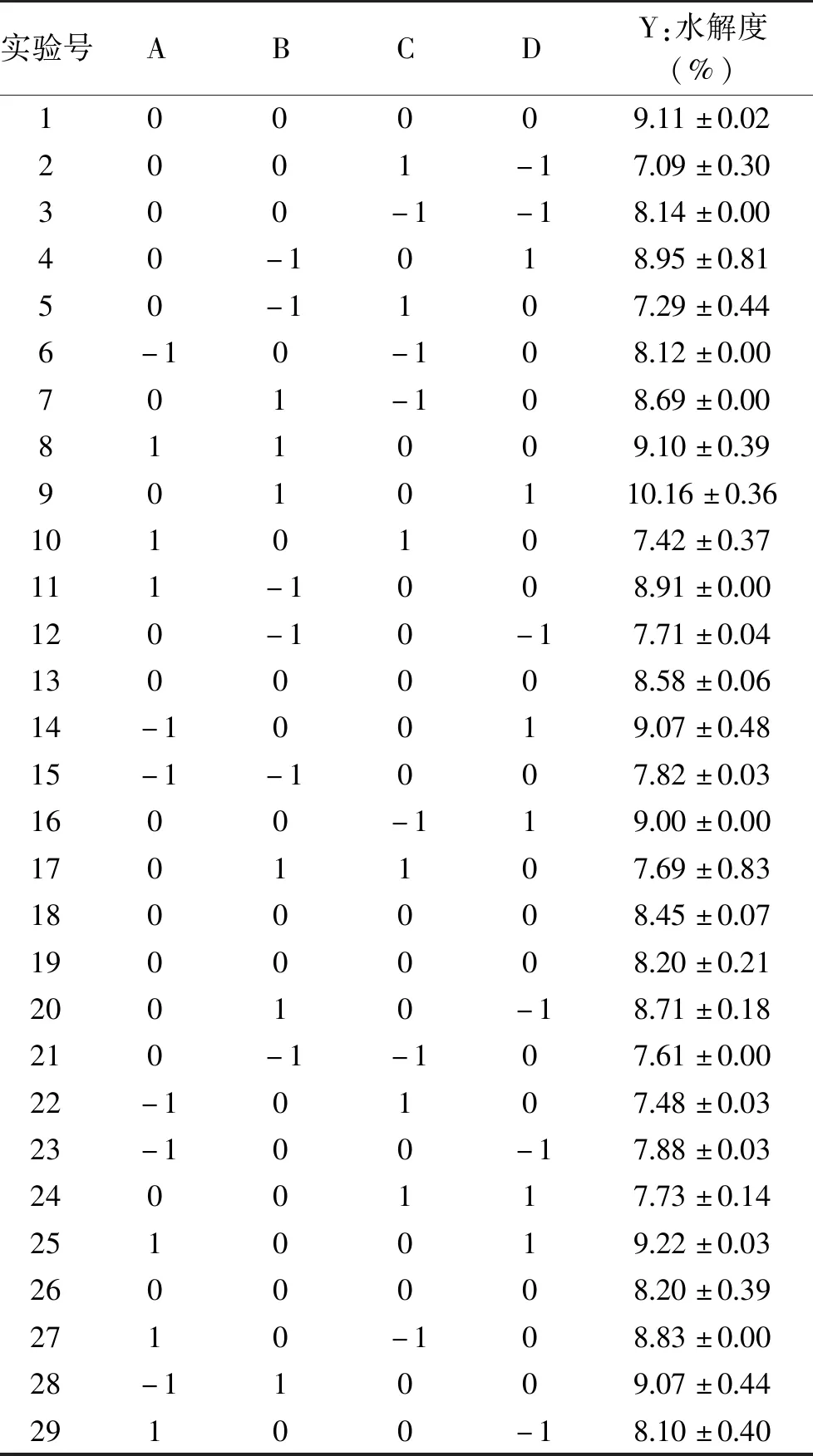
表2 Box-Behnken试验设计与结果
利用Design-Expert V8.0.6.1软件对响应值与各因素编码值进行回归拟合后,得到回归方程[24]:
Y=8.51+0.18A+0.43B-0.47C+0.54D-0.26AB-0.19AC-0.017AD-0.17BC+0.052BD-0.055CD+0.049A2+0.14B2-0.69C2+0.14D2
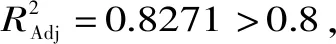
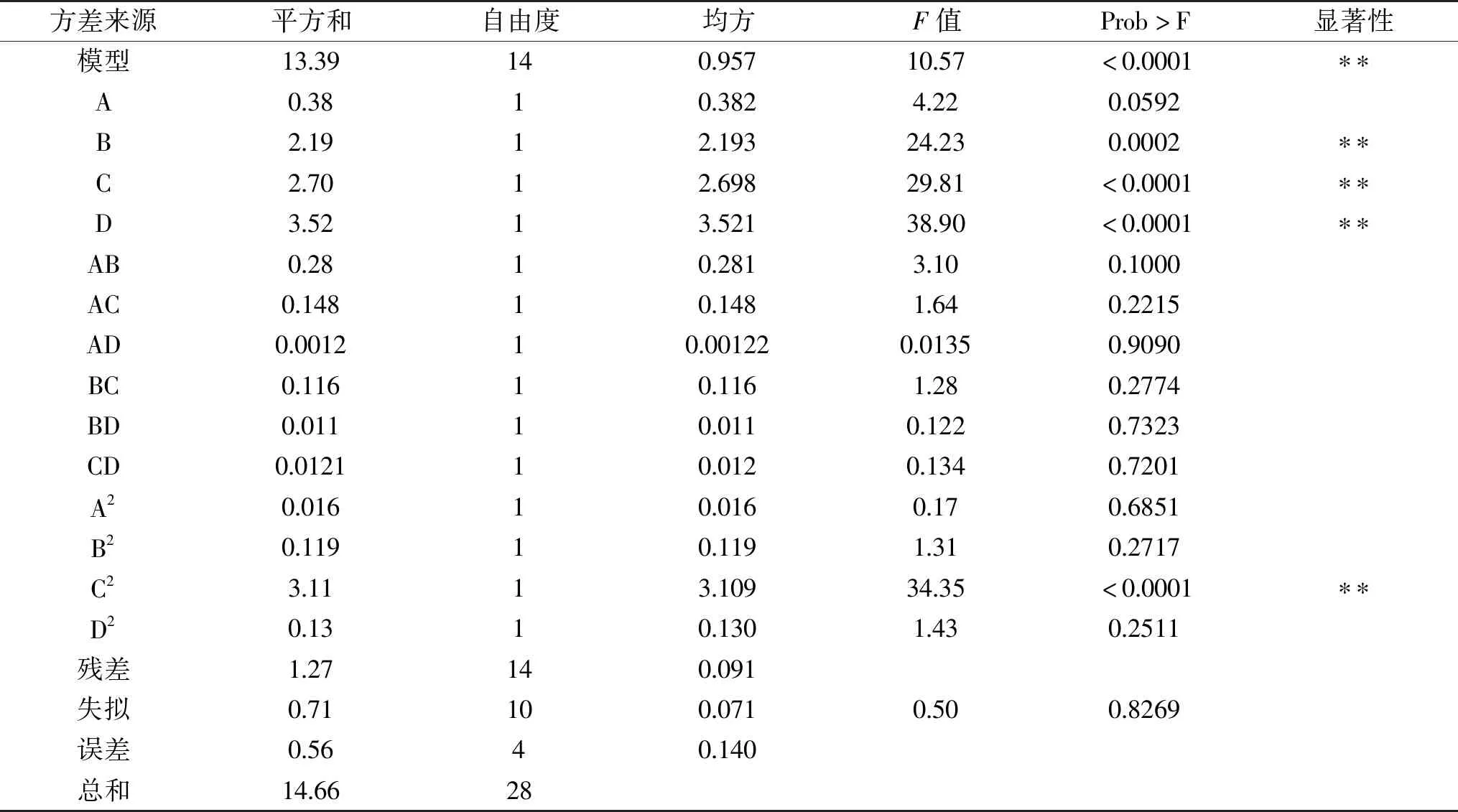
表3 回归模型方差分析
2.3.2 响应面的交互作用分析 根据Design-Expert V8.0.6.1软件,获得响应值的3D曲面图,分析各因素对水解度的影响及各因素间的交互作用,响应面图等高线的形状反应交互作用的强弱,圆形表示两因素交互作用不明显,而椭圆则表示交互作用明显[25-26]。图7(a)(b)(c)所示,酶解温度和料水比、酶解温度和酶解时间、酶添加量和酶解温度均存在不显著的交互作用,与方差分析结果相符。当固定料水比、酶解时间、酶添加量三个因素在零水平时,酶解温度对水解度的影响均先呈现快速上升趋势,温度达到某一定值后缓慢下降。
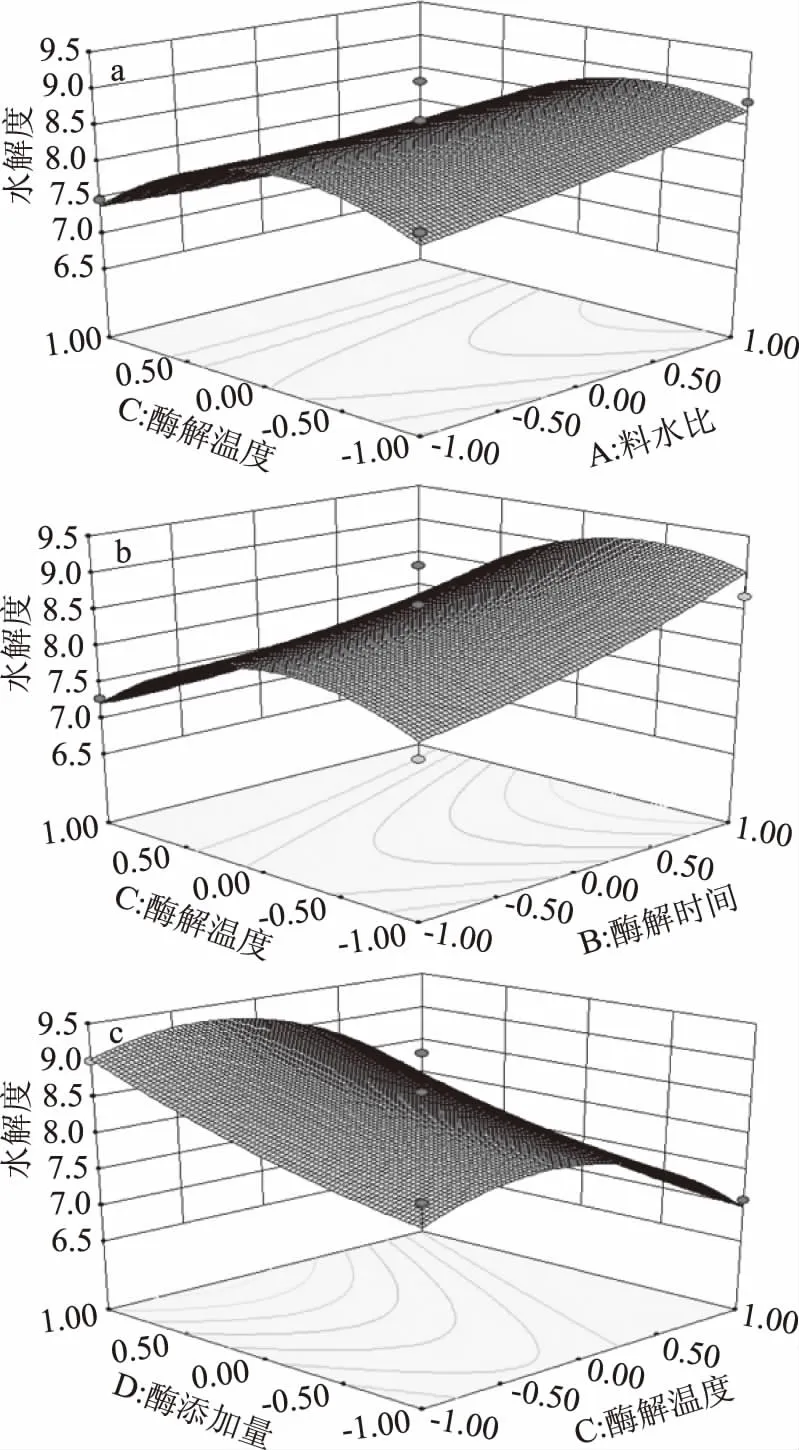
图7 两因素的交互作用的响应面图
2.3.3 最佳酶解工艺参数的确定 根据Box-Benhnken实验结果与回归分析,可得到珍珠龙胆石斑鱼肉酶解的最佳工艺参数为:酶解pH7.0、料水比1∶3.50、酶解时间5.50 h、酶解温度53.24 ℃、酶添加量1049.96 U/g,在此条件预测的水解度为10.05%。为方便实验操作将实验条件定为酶解pH7.0、料水比1∶3.5、酶解时间5.5 h、酶解温度53 ℃、酶添加量1050 U/g。为验证响应面的可行性,用此最佳工艺参数进行验证性实验,设置三组平行实验,实验所得到的水解度为9.99%±0.39%,与理论值误差在±1%以内,说明采用响应面优化得到的酶法制备的最佳工艺参数准确可靠。
2.4 石斑鱼肉酶解产物的抗氧化活性
2.4.1 对DPPH自由基清除率的影响 DPPH自由基是很稳定的以氮为中心的自由基,常用于体外清除自由基活性评价[27]。如表4所示,珍珠龙胆石斑鱼酶解产物及超滤组分对DPPH自由基有一定的清除能力,EH、EH-1、EH-2、EH-3和EH-4对DPPH自由基清除率的IC50值均低于抗坏血酸的清除能力(VC的IC50值为(3.02±0.35) μg/mL)。但一般认为某种物质DPPH自由基清除率的IC50值<10 mg/mL时,即可认为有较好的抗氧化性[28]。所以本实验所得珍珠龙胆石斑鱼酶解产物是一种DPPH自由基清除能力较高的产品,且优于段宙位等[6]制备的石斑鱼酶解产物,其DPPH自由基清除率的IC50值为1.18 mg/mL。
2.4.2 对羟基自由基(·OH)清除率的影响 羟基自由基(·OH)是一种氧化能力很强的活性氧自由基,对身体有很大的损伤性[29]。根据邻二氮菲比色法,可以测得其清除能力的强弱。如表4所示,石斑鱼酶解产物对羟基自由基(·OH)有一定的清除能力,EH-2和EH-3的羟基自由基(·OH)清除能力较强。但低于抗坏血酸的清除能力(VC的IC50值为(0.24±0.02) μg/mL)。

表4 VC和石斑鱼肉酶解产物的DPPH、羟基自由基清除作用的IC50
2.4.3 对总还原力的影响 物质的自身的抗氧化能力与还原性质有关,通过测定总还原力来表示抗氧化能力的强弱,还原力越强,抗氧化能力越强[30]。如图8所示,石斑鱼酶解产物随质量浓度的上升而还原能力增强,其粗酶解产物的还原力明显高于超滤组分,可能是由于超滤分离将某些还原性物质拆分,造成超滤分离产品的还原力下降。抗坏血酸的还原能力明显比石斑鱼酶解产物强,但酶解产物仍具有一定还原能力,这与DPPH自由基清除能力及羟基自由基(·OH)清除能力表现的抗氧化能力相似。
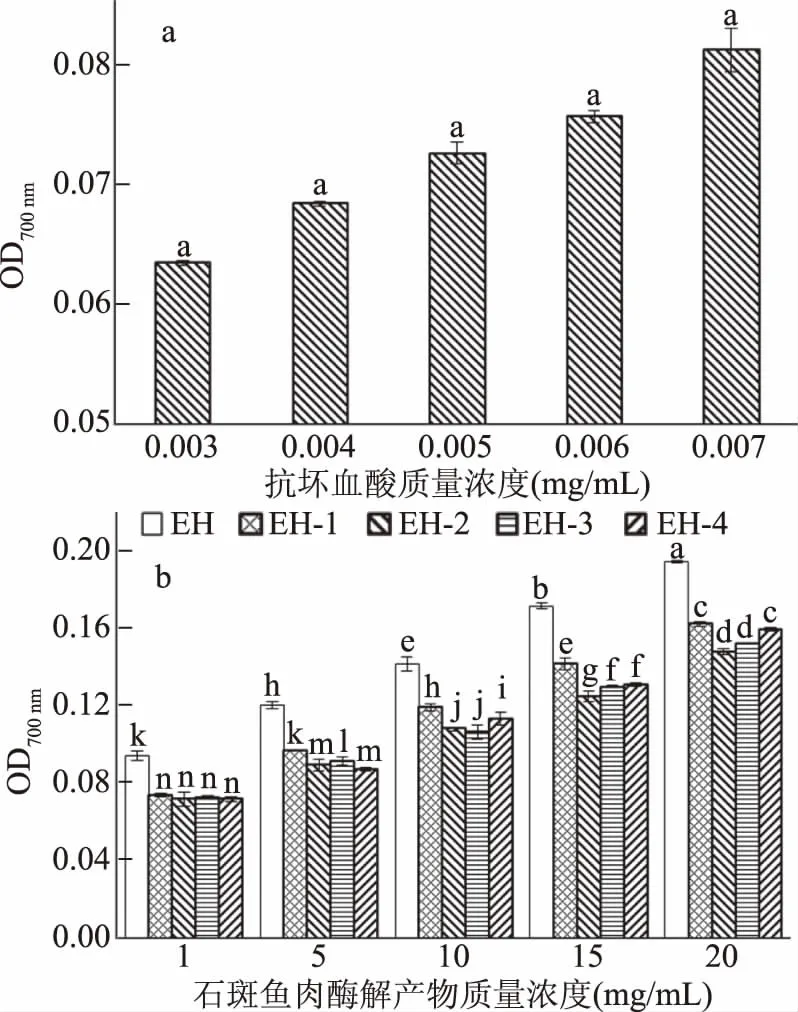
图8 VC(a)和石斑鱼肉酶解产物(b)的总还原力
3 结论
珍珠龙胆石斑鱼肉是一种优质的蛋白源,经风味蛋白酶在pH7.0、料水比1∶3.5、酶解时间5.5 h、酶解温度53 ℃、酶添加量1050 U/g条件下,得到具有抗氧化活性的酶解产物,其水解度为9.99%±0.39%。酶解产物及超滤组分的DPPH自由基清除能力IC50值在0.63~0.88 mg/mL之间;超滤组分EH-2(5~8 kDa)和EH-3(3~5 kDa)羟基自由基清除能力IC50值分别为16.94和16.38 mg/mL;酶解产物及超滤组分均具有较明显的还原能力。本研究通过响应面法优化珍珠龙胆石斑鱼肉制备蛋白肽工艺,所得的制备条件有效可行;且酶解产物及超滤组分均具有良好的抗氧化活性,可用于食品、药品与化妆品等领域。
