蒲公英黄酮的提取工艺优化及主要成分浅析
2020-10-23徐树来任红波栾雪艳陈井权
徐树来,王 丽,任红波,栾雪艳,陈井权
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076;2.黑龙江省普通高校食品科学与工程重点实验室,黑龙江哈尔滨 150076;3.哈尔滨商业大学后勤总公司,黑龙江哈尔滨 150076;4.黑龙江省农业科学院农产品质量安全研究所,黑龙江哈尔滨 150086;5.海伦野泰食品加工有限公司,黑龙江绥化 152000)
蒲公英(TaraxacummongolicumHand Mazz)是一种药食同源草本植物,富含多种功能性成分,具有较高的食用及药用价值[1]。蒲公英对多种细菌、真菌、病原体等致病微生物具有抑制作用[2-3]、具有抗螨虫等有益的生物活性功能[4]。其中黄酮类化合物是其最具代表性的活性物质,具有抑制多种细菌、真菌、病原体等致病微生物[5],具有扩张血管、降糖降脂等作用[6],还具有抗癌活性等多种生物活性[7],有较高的实用开发价值[8]。资料表明:蒲公英在我国分布广,花期长[9],资源丰富且廉价易得,是良好的黄酮提取原料。因此,研究蒲公英黄酮的提取具有一定的现实意义。
尽管国内外学者对黄酮提取的研究报道较多,Sed对红千层中黄酮的提取进行了研究[10],李玲娜研究了超声波复合酶法提取蒲公英根总黄酮工艺[4]。但对蒲公英黄酮提取方面的研究相对较少,而有限的研究也多为复合提取方法,具有工艺复杂、成本高,不适合工业化生产等不足。故有必要对其进行更加深入的研究及优化。
本文对超声波及微波辅助法提取蒲公英黄酮工艺进行了研究,利用单因素实验及正交试验优化提取条件,并通过试验结果对比分析及黄酮粗提物主要成分的HPLC初步测定,确定并验证了蒲公英黄酮的最佳提取工艺,以期为蒲公英的深加工及综合利用提供有益支撑。
1 材料与方法
1.1 材料与仪器
蒲公英(药用级) 宝丰医药通达店;芦丁标准品(纯度98%) 合肥博美生物科技有限责任公司;无水乙醇(分析纯) 天津市富宇精细化工有限公司;亚硝酸钠、硝酸铝、氢氧化钠(均为分析纯) 天津市天力化学试剂有限公司;无水甲醇(色谱纯) 美国Fisher公司;磷酸(色谱纯) 天津市科密欧化学试剂有限公司;乙腈(色谱纯) 国药集团化学试剂沈阳有限公司。
FW177型中草药粉碎机 天津市泰斯特仪器有限公司;电子天平 上海舜宇平衡学仪器有限公司;FA2004A分析天平 上海精天电子仪器有限公司;SP-722E型可见光分光光度计 上海光谱仪器有限公司;KQ-500DE型数控超声波清洗机 昆山市超声仪器有限公司;SHB--Ⅲ循环式多用真空泵 郑州长城科工贸有限公司;布氏漏斗、500 mL抽滤瓶 蜀牛玻璃仪器有限公司;XH-MC-1实验室微波合成仪 北京祥鹄科技发展有限公司;DHG-9123A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;LC-20A高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 黄酮提取工艺及得率测定 精确称取过60目筛的蒲公英干粉1.000 g,在一定浓度的乙醇溶液、料液比、提取时间和提取温度的条件下进行超声处理或者微波处理,抽滤,得提取液。取5 mL提取液至25 mL比色管中,分别加入5%亚硝酸钠溶液1.0 mL,摇匀,放置6 min后,再分别加入10%硝酸铝溶液1.0 mL,摇匀,放置6 min后,再分别加入4%氢氧化钠溶液10.0 mL,再用浓度为60%的乙醇溶液定容至25 mL刻度线,摇匀,放置20 min后,在510 nm的波长处测定吸光度,计算出黄酮得率。
蒲公英黄酮得率计算方法为[11]:
式中:X:黄酮得率(%);C:黄酮提取液浓度(μg·mL-1);V:提取液体积(m)L;N:提取液稀释倍数;M:称取蒲公英干粉的质量(g)。
1.2.2 芦丁标准曲线的绘制 采用文献方法[12],通过标准曲线得到方程:A=0.0092C+0.0035,R2=0.9994,据此计算蒲公英黄酮的得率。
1.2.3 超声波辅助提取法
1.2.3.1 单因素实验设计 按照1.2.1的试验步骤,根据预试验,设定各单因素固定水平分别为:乙醇浓度60%;料液比1∶20 g/mL;超声时间30 min;超声温度50 ℃;超声功率300 W。分别考察各单因素不同水平对蒲公英黄酮得率的影响。各因素水平分别设置为:乙醇浓度(40%、50%、60%、70%、80%);料液比(1∶20、1∶40、1∶60、1∶80、1∶100 g/mL);超声时间(10、20、30、40、50 min);超声温度(40、50、60、70、80 ℃)。
1.2.3.2 正交试验设计优化超声辅助提取条件 根据单因素实验所得最优的工艺提取条件范围,选择乙醇浓度、料液比、超声时间和超声温度为因素,进行L9(34)正交试验,因素与水平编码如表1所示:
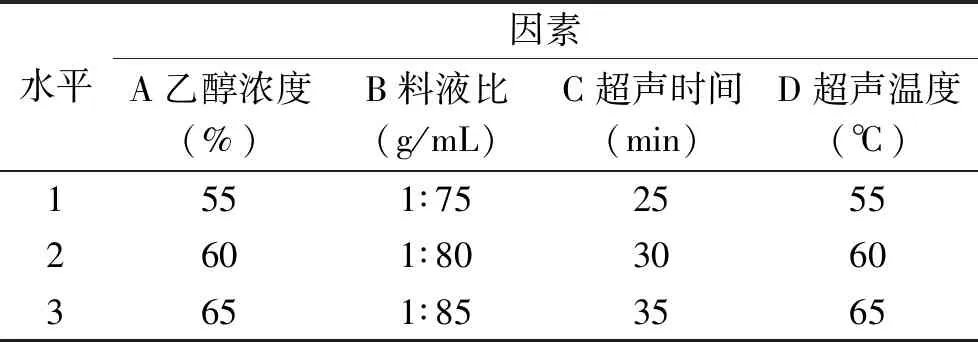
表1 正交试验因素与水平编码表
按照正交试验所得的最优方案做验证性试验,平行三次,取平均值,得出最优工艺条件下超声提取的蒲公英黄酮得率。
1.2.4 微波辅助提取法
1.2.4.1 单因素实验设计 按照1.2.1的试验步骤,根据预试验结果,设定各单因素固定水平分别为:乙醇浓度60%;料液比1∶30 g/mL;微波时间10 min;微波温度50 ℃;微波功率800 W。分别考察各单因素不同水平对蒲公英黄酮得率的影响。各因素水平分别设置为:乙醇浓度(40%、50%、60%、70%、80%);料液比(1∶20、1∶40、1∶60、1∶80、1∶100 g/mL);微波温度(40、50、60、70、80 ℃);微波时间(3、5、10、15、20 min);微波功率(500、600、700、800、900 W)。
1.2.4.2 正交试验设计优化微波辅助提取条件 根据单因素实验所得最优的工艺提取条件,选择乙醇浓度、料液比、微波时间、微波温度及微波功率为因素,进行 L16(45)正交试验,因素与水平编码如表2所示:
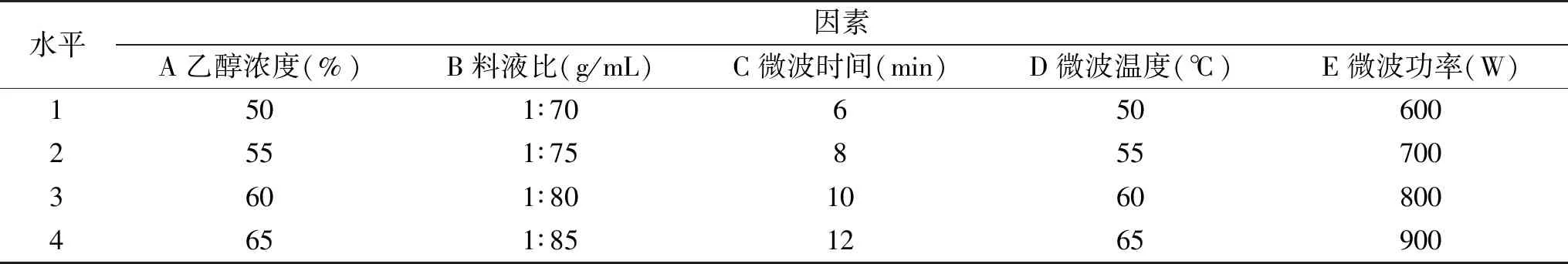
表2 正交试验因素与水平编码
按照正交试验所得的最优方案做验证性试验,平行三次,取平均值,得出最优工艺条件下微波提取的蒲公英黄酮得率。
1.2.5 蒲公英黄酮的HPLC分析 准确称取芦丁0.01 g,用甲醇分别定容于10 mL容量瓶中,0.45 μm滤膜过滤备用,配制不同浓度梯度甲醇稀释溶液及混合溶液,放入高效液相色谱仪中,得出图谱[13]。以物质的质量浓度为横坐标,峰面积为纵坐标,分别绘制标准曲线,得到线性回归方程。用最优试验参数组合制备的蒲公英黄酮提取液,蒸发后干燥至恒重得到粗提物,精密称取0.05 g,甲醇溶解后定容10 mL,0.45 μm滤膜过滤备用。
上述备用液均在以下高效液相色谱条件下测定:色谱柱:依利特Sinachrom ODS BP(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸(3∶7);流速:1.0 mL/min;运行时间:25 min;柱温:30 ℃;检测波长:368 nm;进样量:10 μL。
测定3次重复完成后,分析样品色谱图,并结合线性回归方程,计算粗提物中芦丁质量分数。
1.3 数据处理
每个试验重复3次,采用SPSS 17.0软件对试验数据进行统计学分析。
2 结果与分析
2.1 超声波辅助提取工艺优化
2.1.1 单因素实验
2.1.1.1 乙醇浓度对蒲公英黄酮得率的影响 由图1a可知,乙醇浓度由40%增加至60%时,黄酮得率不断增加,当乙醇浓度达到60%左右时,黄酮类化合物的得率基本达到最高;之后随着乙醇浓度的增加,其得率缓慢下降。不同乙醇浓度下,蒲公英提取液中黄酮类化合物的得率有明显差异,乙醇浓度超过70%后,提取液的颜色呈现绿色。原因可能是乙醇浓度小时,蒲公英黄酮不能完全溶解到溶液中,所以黄酮得率较低;而乙醇浓度增高,使一些醇溶性杂质、色素等其他成分溶出量增加,这些成分与黄酮类化合物竞争与乙醇分子结合,从而导致黄酮类化合物的得率下降[14]。由单因素方差分析可知,该因素对黄酮提取得率影响显著(P<0.05),综合分析,适宜的乙醇浓度范围为55%~65%。
2.1.1.2 料液比对蒲公英黄酮得率的影响 由图1b 可知,随料液比的增加,黄酮得率增加,但溶剂用量达到一定程度时,黄酮接近全部溶出,再增加溶剂用量,黄酮的得率下降。当料液比为1∶80 g/mL左右时,黄酮得率基本达到最大值。原因可能是当料液比太小时,蒲公英黄酮与乙醇的接触面小,蒲公英黄酮不能完全溶解到溶液中,所以得率较低;随着料液比增大,黄酮与溶剂的接触面积增大,溶解度增加,得率增加[15]。但当料液比过高时,基本达到饱和状态,不利于得率提高,而且,料液比过高,增加了分离纯化时间及成本。由单因素方差分析可知,该因素对黄酮提取得率影响极显著(P<0.01)。综合分析,选取适宜的料液比范围为1∶75~1∶85 g/mL。
2.1.1.3 超声时间对蒲公英黄酮得率的影响 由图1c可知,随着超声时间的延长,黄酮得率逐渐增加,30 min左右达到最高;30 min后,黄酮得率逐渐减少。其原因可能是,超声时间短,黄酮不能完全溶解出来,所以得率较低,随着超声时间的增加,超声波作用增强,促进了对细胞的破坏作用,黄酮全部溶解出来,得率增加。而超声时间过长,可能破坏了蒲公英黄酮的结构而使其分解,最后得率降低[16]。由单因素方差分析可知,该因素对黄酮提取得率影响极显著(P<0.01)。综合分析,适宜的提取时间范围为25~35 min。
2.1.1.4 超声温度对蒲公英黄酮得率的影响 由图1d可知,随着超声温度的升高,黄酮得率先增后减,60 ℃达最大值;此后,黄酮的得率下降,特别是温度达到80 ℃时,下降幅度较大。原因可能是,温度过高时,造成部分黄酮类化合物的结构被破坏,所以黄酮得率降低[17-18]。而且乙醇的沸点约为78.3 ℃,当超声温度达到80 ℃时,高于乙醇的沸点,乙醇会大量挥发,提高了回流收集成本。由单因素方差分析可知,该因素对黄酮提取得率影响显著(P<0.05)。综合考虑成本及能耗,选取适宜的提取温度范围为55~65 ℃。
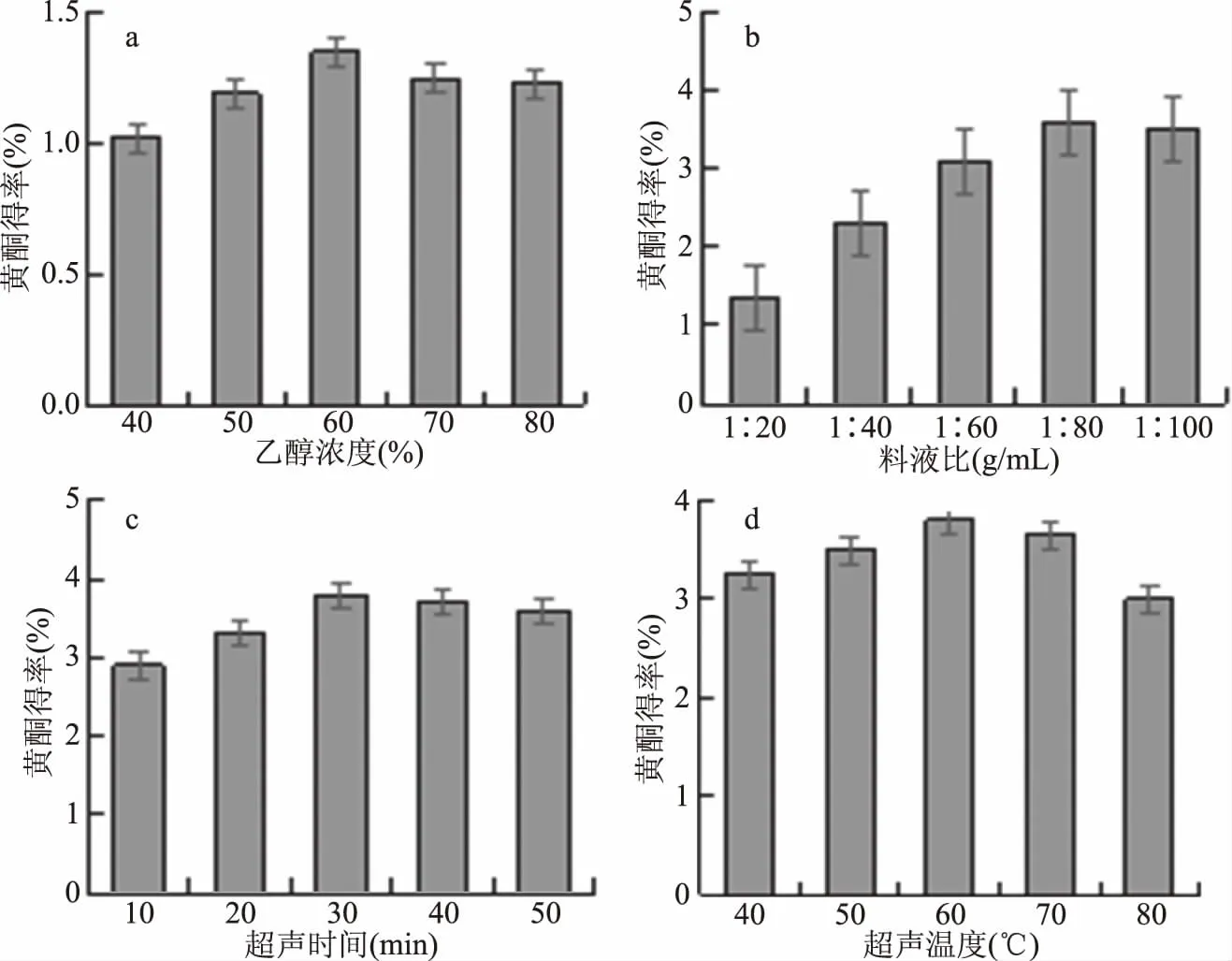
图1 各因素对蒲公英黄酮得率的影响
2.1.2 正交试验结果分析 由表3可知,超声波辅助提取法中,对黄酮得率的影响因素的主次顺序是A>B>D>C,即乙醇浓度>料液比>超声温度>超声时间,最优方案是A2B2C3D2,即乙醇浓度60%、料液比1∶80 g/mL、超声时间35 min、超声温度60 ℃。
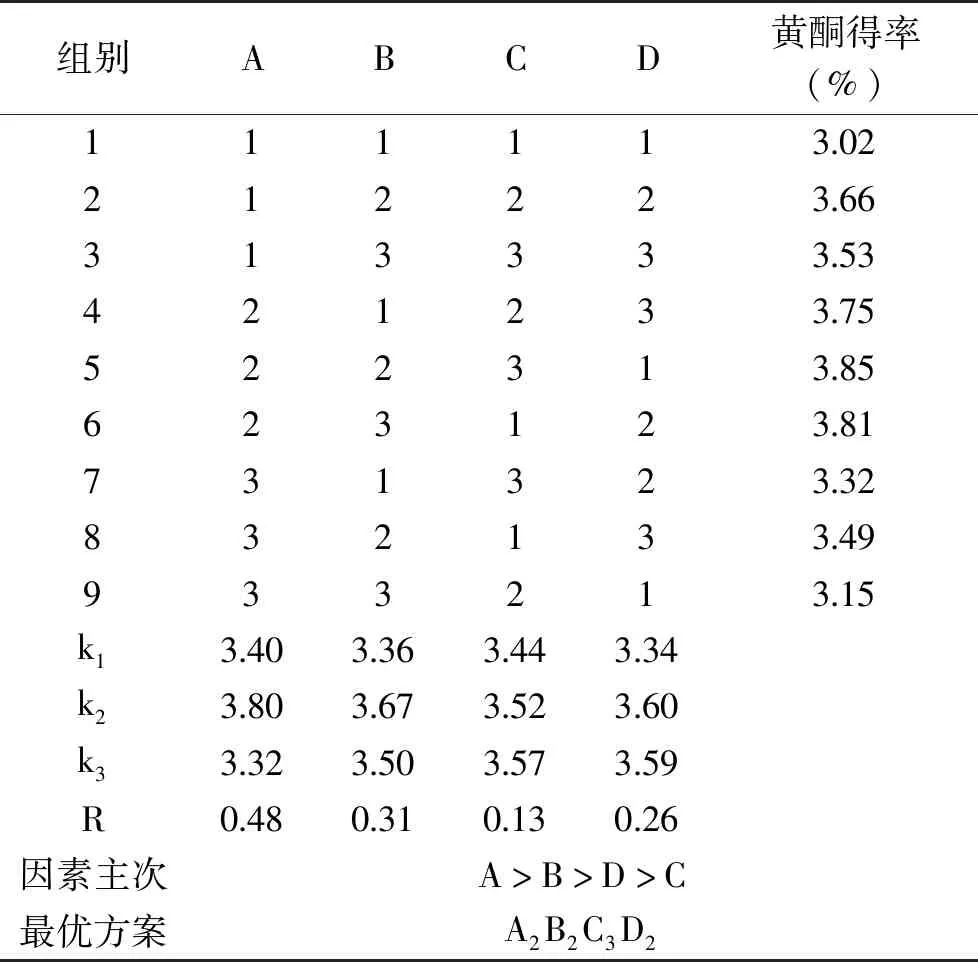
表3 正交试验结果及分析
按照正交试验所得的最优方案A2B2C3D2,即乙醇浓度60%、料液比1∶80 g/mL、超声时间35 min、超声温度60 ℃的提取条件下,做验证性试验,平行三次,取平均值。获得最优工艺条件下提取的蒲公英黄酮得率为3.97%。
2.2 微波辅助提取工艺优化
2.2.1 单因素实验
2.2.1.1 乙醇浓度对蒲公英黄酮得率的影响 由图2a可知,黄酮得率随着乙醇浓度的提高先增加后减小,当乙醇浓度为60%时,黄酮得率最大,之后随着乙醇浓度的增加,黄酮得率缓慢下降。不同乙醇浓度下,蒲公英提取液中黄酮类化合物的得率有明显差异,乙醇浓度超过70%后,提取液的颜色呈现绿色。原因可能是乙醇浓度增高后,使一些醇溶性杂质和色素亲脂性等成分溶出量增加[19],这些成分与黄酮类化合物竞争同乙醇水分子结合,从而导致黄酮类化合物的得率下降。由单因素方差分析可知,该因素对黄酮提取得率影响显著(P<0.05)。综合分析,选取较优的乙醇浓度范围为50%~70%。
2.2.1.2 料液比对蒲公英黄酮得率的影响 由图2b可知,随溶剂用量的增加,黄酮得率增加,当料液比达到1∶80 g/mL时,黄酮得率最高,黄酮接近全部溶出,再增加溶剂用量,黄酮的得率下降。原因可能是当料液比太小时,蒲公英黄酮与乙醇的接触面小,蒲公英黄酮不能完全溶解到溶液中,所以得率较低,随着料液比增大,黄酮与溶剂的接触面积增大,溶解度增加,得率增加;但是料液比过大时,溶解到溶液中的黄酮浓度被稀释,得率反而降低[20],而且,料液比过高,增加了分离纯化成本。由单因素方差分析可知,该因素对黄酮提取得率影响极显著(P<0.01)。综合成本及提取效果,选取较优的提取料液比范围为1∶70~1∶90 g/mL。
2.2.1.3 微波温度对蒲公英黄酮得率的影响 由图2c可知,蒲公英黄酮得率随着微波温度的升高先增加后降低,当微波提取温度为60 ℃时,黄酮得率达到最大值,温度继续上升时,黄酮得率反而下降。原因可能是,微波温度升高,造成部分黄酮类化合物的结构被破坏,所以黄酮得率降低[21]。由单因素方差分析可知,该因素对黄酮提取得率影响极显著(P<0.01)。综合分析,选取较优的微波提取温度范围为50~70 ℃。
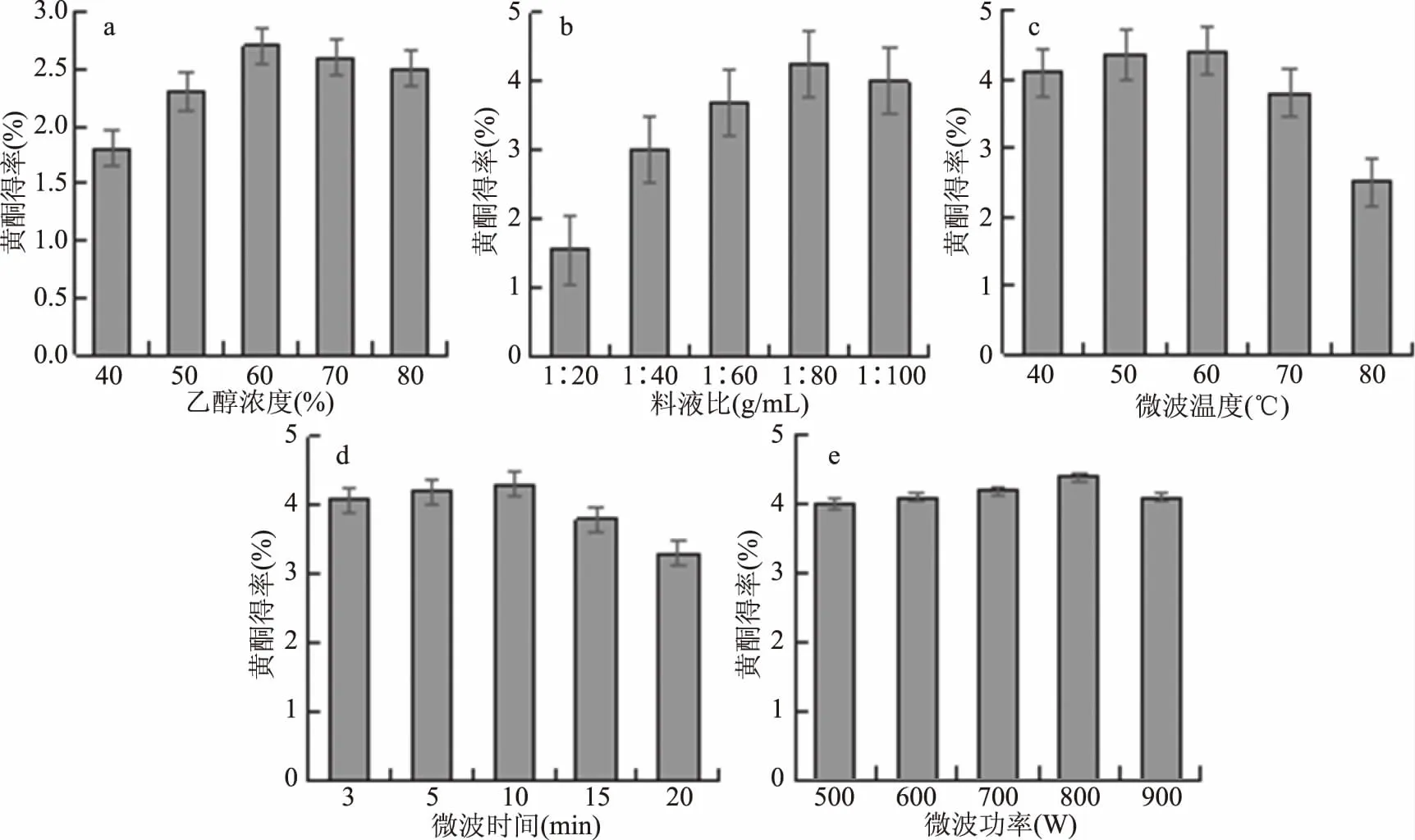
图2 各因素对蒲公英黄酮得率的影响
2.2.1.4 微波时间对蒲公英黄酮得率的影响 由图2d可知,黄酮得率随微波时间的增加而逐渐增加,当微波时间为10 min 时,黄酮得率达到最大值,此后随着微波时间的增加而降低。微波时间过长会使温度过高,反而会破坏蒲公英中黄酮组分导致得率降低,且影响提取效率;而微波时间过短则无法使蒲公英中的黄酮充分溶出,造成提取不完全[22]。由单因素方差分析可知,该因素对黄酮提取得率影响极显著(P<0.01),综合提取效果及效率,选取较优的黄酮微波时间范围为5~15 min。
2.2.1.5 微波功率对蒲公英黄酮得率的影响 由图2e可知,随着微波功率的增加,黄酮的得率也逐渐增加,当微波功率增加到800 W时,黄酮的得率达到最大值,此后随着微波功率的增加,黄酮的得率逐渐降低。在一定的微波作用时间内,微波功率越大,物质吸收的能量越多,温度升高加快,分子运动速度加快,物质的渗透、扩散和溶解速度加快,促进黄酮类物质向溶剂迁移,黄酮得率明显提高。但是,当微波功率过高时,黄酮得率反而随着微波功率的增大而逐渐降低。原因可能是,功率过大,溶剂升温太快,温度过高,溶剂的挥发性加快,从而造成溶剂损失,而且黄酮类活性成分也易被破坏[23],而得率降低。由单因素方差分析可知,该因素对黄酮提取得率影响极显著(P<0.01),综合考虑能耗及提取效果,选取较优的微波功率范围为700~900 W。
2.2.2 正交试验结果分析 按照正交试验所得的最优方案A3B3C3D2E3,即乙醇浓度60%、料液比1∶80 g/mL、微波时间10 min、微波温度55 ℃、微波功率800 W。在最优提取条件下,做验证性试验,平行三次,取平均值,得到最优提取工艺条件下的蒲公英黄酮得率为4.57%。
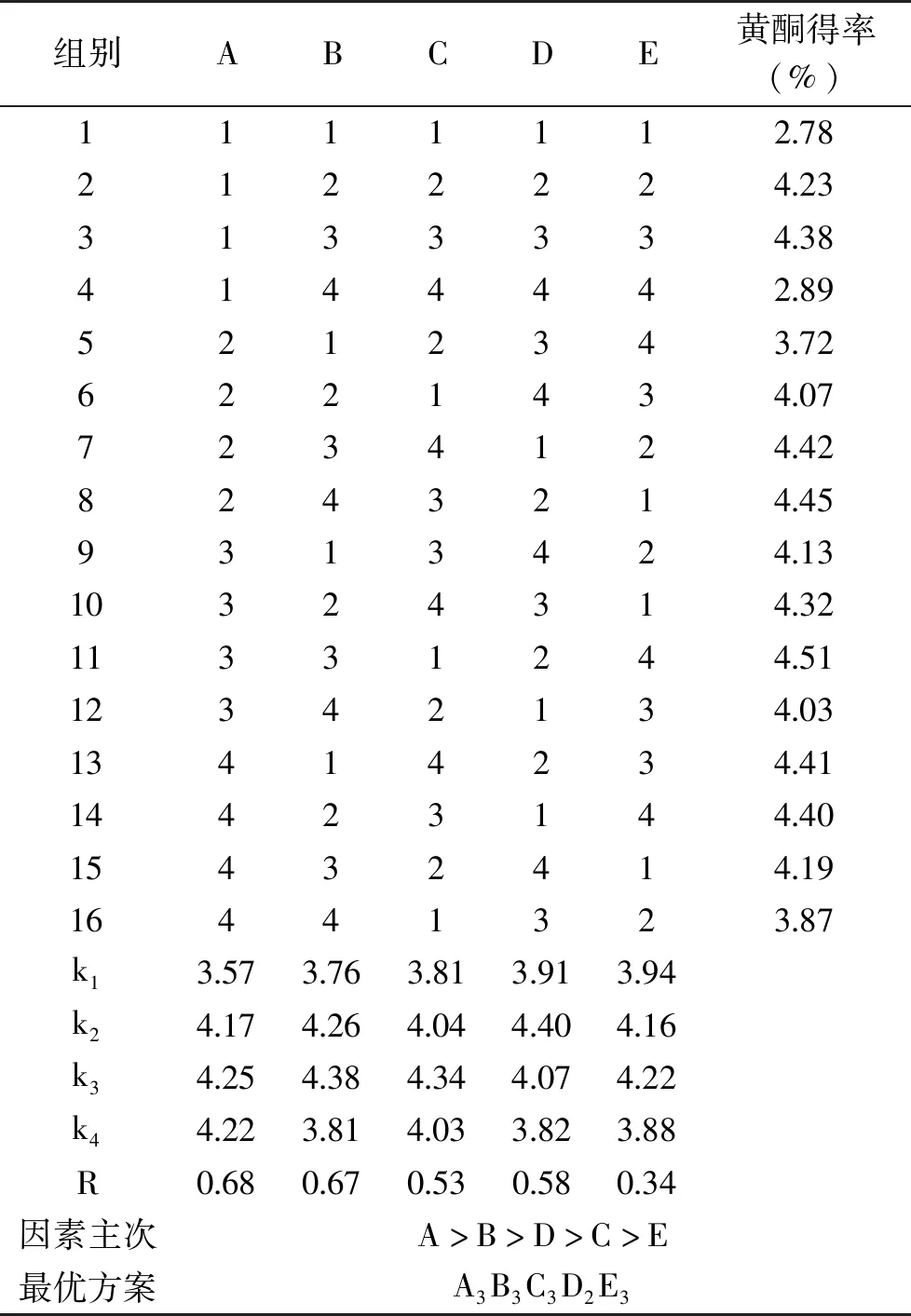
表4 正交试验结果及分析
2.3 两种提取方法的对比分析
由上述2.2和2.3的试验结果的对比分析可以看出,微波辅助法提取蒲公英黄酮优于超声波辅助提取方法。原因是两种提取方法的原理不同:超声波辅助提取法是运用超声波产生高速、强烈的空化效应和搅拌作用,振动产生强大的能量,导致植物细胞壁被破坏,加速有效成分的迅速释放、溶解,从而达到高效提取的效果[24-25]。而微波辅助提取法是利用不同结构物质对波长吸收的差异,使得不同物质被选择性加热,而达到从系统中分离出来的效果。微波提取主要是利用其热效应[26]。上述原理分析表明:超声波辅助提取是外部振动产生能量,利用的是机械能破坏植物细胞壁,是由内及外的机械作用过程;而微波辅助提取是内部不同物质对波长的吸收,被选择性加热,利用的是热效应,从而达到破坏植物细胞壁,是内部及外部同时进行的偶极子热运动过程[27]。鉴于上述两种方法作用原理的不同,微波辅助提取的效果比超声波辅助提取的效果更好,得率更高。
此外,与超声波辅助提取法相比,微波辅助提取法具有操作时间短、效率高、溶剂消耗量少、不产生噪音、适于热不稳定物质等优点[27],且通过本试验验证具有较高的蒲公英黄酮得率。表明微波辅助提取蒲公英黄酮是一种快速、有效、得率较高的方法,且便于实现工业化生产,对实际生产具有一定的指导意义。
2.4 蒲公英黄酮的HPLC结果分析
根据芦丁标准溶液HPLC图谱(如图3所示)可知,芦丁出峰时间约为1.9 min。根据不同质量浓度的HPLC图谱及定量结果,以样品的质量浓度为横坐标,以对应的峰面积为纵坐标,绘制出芦丁的质量浓度与峰面积的标准曲线,如图4所示。
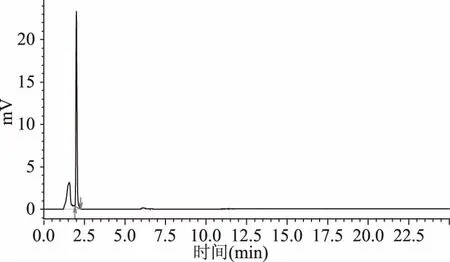
图3 芦丁标准溶液HPLC图谱
由图4芦丁HPLC标准曲线,经过回归处理,得回归方程为:Y=10709X+3.2397,R2=0.9988。
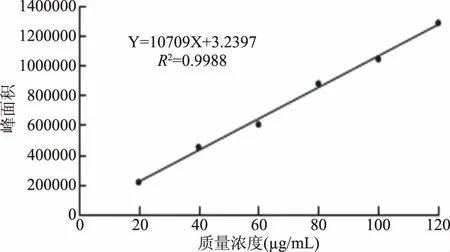
图4 芦丁标准溶液HPLC图谱分析标准曲线
由图5黄酮粗提物样品的HPLC图谱及定量结果可知:样品中含有芦丁,峰面积为:683271,浓度为:63.803 μg/mL,质量分数为:12.76%。
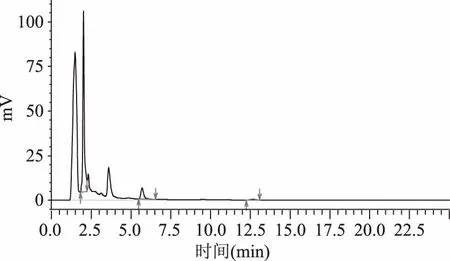
图5 黄酮粗提物样品HPLC图谱及定量结果
由图5黄酮样品的HPLC图谱观察可知,蒲公英黄酮粗提物中,含有较多的芦丁。而在芦丁的色谱峰出现之前,在时间约为1.2~1.9 min处,出现了一个仅次于芦丁的色谱峰,这有可能是一种含量仅次于芦丁的黄酮单体,需进一步研究确定。
3 结论
本试验对超声波辅助提取和微波辅助提取的工艺进行了优化试验研究,通过单因素实验和正交试验,确定了蒲公英黄酮的最优提取工艺条件为:超声波辅助提取:乙醇浓度60%,料液比1∶80 g/mL,提取时间35 min,提取温度60 ℃,在此条件下,蒲公英黄酮的得率为3.97%;微波辅助提取:乙醇浓度60%,料液比1∶80 g/mL,提取时间10 min,提取温度55 ℃,微波功率800 W,在此条件下,蒲公英黄酮得率为4.57%。通过试验结果对比分析,并结合两种方法提取机理分析,最终确定微波辅助法提取蒲公英黄酮为较优的提取方法。高效液相色谱(HPLC)法测定结果表明,蒲公英黄酮粗提物中含有芦丁,质量分数为:12.76%。而蒲公英黄酮中还有一种未知的黄酮类化合物,含量仅次于芦丁,此种黄酮单体有待进一步研究确定。本研究为蒲公英的深加工及综合利用提供了有益的探究及参考。
