基于非水溶性膳食纤维介质的双歧杆菌生物膜动态培养及其抗逆性研究
2020-10-23陈翠翠李元昆赵建新陆文伟
陈翠翠,杭 锋,张 灏,,李元昆,赵建新,陈 卫,陆文伟,,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;2.江南大学食品学院,江苏无锡 214122;3.江南大学(扬州)食品生物技术研究所,江苏扬州 225004;4.新加坡国立大学杨璐龄医学院微生物学系,肯特区 119077)
双歧杆菌最早是由法国学者Tissier从母乳喂养婴儿的粪便中分离出来的一种厌氧的革兰氏阳性杆菌。大量研究报道双歧杆菌具有抗肠道致病菌、调节肠道菌群平衡、抗癌、免疫调节等益生作用[1-2],被广泛应用于医疗、食品、保健等领域。然而双歧杆菌由于特殊的生理特性,极易在开发益生菌制剂和储藏过程中死亡,且经人体胃肠道内胃酸胆盐的胁迫下,活菌数会骤然下降,限制了其对人体发挥有益的作用。真空冷冻干燥技术是制备高活性菌粉的最有效的一种干燥技术,但冻干过程中仍会使菌体受到多种有害作用力,如冻结应力、低温应力以及干燥应力等,导致菌体活性下降[3-4];喷雾干燥技术可用于大规模的生产菌粉,但喷干过程中的高温(100~200 ℃)和干燥脱水,会严重损伤细胞。目前大量研究主要集中在如何添加保护剂、优化干燥工艺等方式来提高益生菌的抗逆性[5],对如何提高益生菌自身抗逆性却报道甚少。
生物膜是由附着在生物或非生物表面的细菌及其自身分泌的细胞外聚合物基质(extracellular polymeric substances,EPS)所形成的具有三维网状结构的细菌群落[6-7]。研究发现超过99.9%的细菌都附着在不同材料表面的生物膜中生长[8]。生物膜的形成阻止了细菌与有害物质的直接接触,提高细菌对抗菌药物的耐药性[9],据推测,这可能是由于细胞外聚合物基质的保护作用和生物膜细胞特有的群体感应所致[10]。关于生物膜,近年来研究主要集中在如何去除病原菌的生物膜[11],对于如何利用生物膜增强益生菌的抗逆性的研究报道却很少。张国丽等研究发现植物乳杆菌生物膜形成后对温度、酸碱、盐度耐受性均有不同程度的提高[12]。蒲明珠验证基于椰果表面形成的乳酸菌生物膜相比于游离菌株,在人工胃肠道、高胆盐环境下的存活率也显著提高[13],Cheow等验证形成生物膜后的鼠李糖乳杆菌微胶囊,抗冷冻干燥能力提高了将近40倍[14]。众多研究表明,利用益生菌生物膜提高其存储稳定性和抗逆性将在未来的工业化应用上具有广阔的前景。
生物膜的产生离不开成膜基质,目前报道研究人员常用微孔板作为成膜载体[15],无法实现工业化应用。成膜基质的选择必须遵循不溶于水,且符合食品添加标准的要求。非水溶性膳食纤维作为一种益生元,表面粗糙,成膜的比表面积大,并且可以大规模地发酵制备,是一种理想的成膜基质。本实验研究了双歧杆菌在不同非水溶性膳食纤维上形成生物膜的能力,探究了双歧杆菌最佳成膜时间,比较了生物膜成膜菌株和浮游菌株冻干存活率和对模拟胃肠液的耐受性,以期为益生菌生物膜在未来食品工业领域得到广泛应用提供一定的参考。
1 材料和方法
1.1 材料与仪器
双歧杆菌FJSWX25M1 江南大学食品生物技术中心菌种保藏库;牛肉膏、胰蛋白胨、葡萄糖、酵母粉、磷酸氢二钾、无水乙酸钠、七水硫酸镁、一水硫酸锰、柠檬酸氢二铵、吐温-80、半胱氨酸盐酸盐、磷酸二氢钾 分析纯,国药集团化学试剂有限公司;胃蛋白酶(1∶10000)、胰蛋白酶(1∶250) Singma公司;胆盐LP0055 Oxoid公司;黄豆粉、小麦纤维、笋干粉、玉米粉、葡萄籽粉、苹果纤维 兴化市润宇食品有限公司。
EL3002型电子天平、FE20型pH计 梅特勒-托利多仪器(上海)有限公司;LAB DANCER漩涡振荡器 德国IKA公司;MLS-3750型高温高压灭菌锅 日本SANYO公司;厌氧工作站 Whitley 公司;ZHJH-C1115B型超净工作台 上海智诚分析仪器制造有限公司;LYOBETA-5PS冻干机 西班牙Telstar公司;biotech-3000 5 L×3平行发酵罐 上海保兴生物设备工程有限公司。
1.2 实验方法
1.2.1 菌株的活化和动态生物膜培养 取活化三代后的双歧杆菌以2%的接菌量接种到装有50 mL mMRS液体培养基(添加0.5 g/L半胱氨酸盐酸盐的MRS肉汤培养基)的锥形瓶中,分别添加和不添加非水溶性膳食纤维(黄豆粉、小麦纤维、笋干粉、玉米粉、葡萄籽粉、苹果纤维),培养游离菌株和生物膜菌株,载体基质添加量为20 g/L,固定培养基于摇床内,于37 ℃培养48 h,转速为100 r/min,使载体基质悬浮在培养基中而不沉降,让菌体充分黏附于基质上形成生物膜。
1.2.2 双歧杆菌生物膜的发酵罐生产 取活化三代后的双歧杆菌以5%的接菌量接种到3 L的发酵罐,分别添加和不添加非水溶性膳食纤维(葡萄籽粉和小麦纤维),培养游离菌株和生物膜菌株,载体基质添加量为20 g/L,培养温度37 ℃,调整发酵罐转速为100 r/min,刚好使非水溶性膳食纤维颗粒不会沉降下去,充入氮气使罐内气压达到0.1 MPa,分别厌氧培养12、24、36、48 h后取样计算成膜活菌数和总活菌数。
1.2.3 平板计数法测定成膜活菌数 成膜活菌数计数方法参考Ushakova等试验方法[16-17],吸取含有载体的发酵培养液1 mL于2 mL EP管中,同一实验组分成两份,一份于离心机中以100 r/min的转速低速离心2 min,倒掉上清液,对麦麸上的活菌数进行平板菌落计数,根据麦麸所占体积计算,结果为成膜活菌数(CFU/mL,湿重);另一份培养液直接在旋涡振荡器最大转速搅拌10 min,进行活菌计数,计数结果为总活菌数(CFU/mL)。

1.2.4 双歧杆菌生物膜的扫描电镜微观观察 取发酵培养液100 r/min低速离心2 min,倒掉上清液,取生物膜载体颗粒,同时以空白载体作为对照,用含 2%(w/v)戊二醛溶液固定,取出样品后用磷酸缓冲液漂洗2次,依次用50%、70%、90%、100%乙醇溶液逐级梯度脱水,每次脱水时间为15 min。脱水完成后,自然风干30 min,取适量样品用导电粘胶粘贴在样品台,喷镀金粉,放入扫描电子显微镜中观察[18]。
1.2.5 双歧杆菌的冻干 冻干前样品制备:发酵培养同1.2.2实验方法,培养36 h后提取发酵液,其中未添加载体的发酵液加入同等质量灭菌后的载体,保持发酵液载体量一致,减小保护剂与菌泥比差异。发酵液于离心机8000×g,4 ℃,离心20 min,弃上清,收集菌泥,以1∶2 (w/v)的比例加入灭菌后质量分数为10%脱脂乳保护剂,混匀进行真空冷冻干燥。
冻干工艺为:预冻:预先将层板温度在1 h内降至-50 ℃,放入样品,保持4 h;一次干燥阶段:抽真空至最低真空度,设定 60 min 升高层板温度至-30 ℃,保持此温度恒定30 h;二次干燥阶段:快速升温至 20 ℃,并保持此温度恒定 20 h[19]。
1.2.6 冻干存活率的测定 冻干前活菌数的测定:在冻干前留样用于测定冻干前的活菌数。
冻干后活菌数的测定:添加PBS缓冲液还原到冻干前体积,混匀后平板菌落计数[20]。
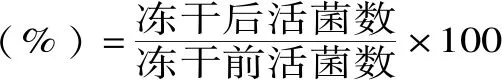
1.2.7 冻干菌粉模拟胃肠液耐受能力的测定 模拟胃液:将胃蛋白酶溶于灭菌的0.85%(W/V)的生理盐水中,用1 mol/L浓盐酸调节pH至3.0,使其浓度达到3 g/L,使用0.22 μm无菌滤膜过滤后使用,现配现用。
模拟肠液:将胰蛋白酶、胆盐溶于灭菌的0.85%(W/V)的生理盐水中,使其终浓度分别达到1 g/L和0.3%,用0.1 mol/L的NaOH调节pH至8.0。使用0.22 μm无菌滤膜过滤后使用,现配现用。
取0.1 g菌粉溶于配制好的0.5%生理盐水平板菌落计数,作为胁迫处理前活菌数;溶于配制好的模拟胃液培养2 h、模拟肠液培养4 h后进行菌落平板计数,作为胁迫处理后活菌数[21-23]。
存活率(%)=胁迫处理前活菌数/胁迫处理后活菌数×100
1.3 数据处理
实验数据为重复三次所得,以平均值±标准误差(mean±SD)表示。采用Microsoft Excel 2016和Graphpad Prism 7.0进行数据处理,运用ANOVA进行统计学分析,两组数据的差异分析采用T检验进行判断,差异显著表示P<0.05。
2 结果和分析
2.1 双歧杆菌在不同非水溶性膳食纤维成膜情况的比较
为了探究双歧杆菌在不同基质上(黄豆粉、小麦纤维、笋干粉、玉米粉、葡萄籽粉、苹果纤维)形成生物膜的能力,通过计算生物膜活菌数和成膜率表征双歧杆菌在不同非水溶性膳食纤维基质上的成膜情况(图1),并做了相应的扫描电镜图(图2)。结果发现,如图1所示,在葡萄籽粉上成膜活菌数、成膜率最高,分别为(1.98±0.13)×108CFU/mL和40.56%±2.64%。其次是小麦纤维成膜活菌数为(1.38±0.19)×108CFU/mL,成膜率为36%±3.55%。在玉米粉、笋干粉、黄豆粉表面,生物膜形成能力较差一些,在笋干粉表面,生物膜成膜活菌数最低,成膜能力最差。从图2电镜图更加直观得看到,在小麦纤维和葡萄籽粉上粘附的生物膜菌株最多,粘附能力最强,而在其他几种基质表面上并不能很好的成膜,可以得出双歧杆菌在不同基质上形成生物膜能力并不一致。生物膜的形成需附着在生物或非生物材料表面[24],Grossova等[9]选择不同的载体如马铃薯纤维,海藻酸钠,燕麦纤维等固相基质发酵益生菌,发现在不同基质上形成生物膜能力并不一致,本实验结果与其基本一致。图3为小麦纤维和葡萄籽粉空白载体的电镜图,可以看到葡萄籽粉具有多孔状结构,Kathryn等[25]报道指出,表面粗糙的材料更易于生物膜的粘附。因此得出葡萄籽粉是双歧杆菌FJSWX25M1最适宜成膜的载体。

图2 双歧杆菌在不同非水溶性膳食纤维基质上成膜的扫描电镜图片

图3 葡萄籽粉(A)和小麦纤维(B)的扫描电镜图片
2.2 发酵时间对双歧杆菌成膜情况的影响
为了探讨双歧杆菌FJSWX25M1最佳成膜时间,选择葡萄籽粉和小麦纤维基质作为粘附载体,使用发酵罐发酵培养生物膜,分别在12、24、36、48 h计算双歧杆菌成膜活菌数以及成膜率。结果发现,菌株在36 h时基于葡萄籽粉基质的成膜率最高为36.68%±2.75%,成膜活菌数为(1.78±0.18)×108CFU/mL;而以小麦纤维为基质形成生物膜时,在24 h成膜率最高为33.39%±0.87%,此时成膜活菌数达到(1.42±0.13)×108CFU/mL。双歧杆菌因粘附材料的不同,生物膜最佳成膜时间也并不相同。生物膜的形成由于受到微生物和粘附基质的物理化学相互作用以及附着材料的表面性质的影响[26],致使菌株在不同载体最佳成膜时间并不一致。
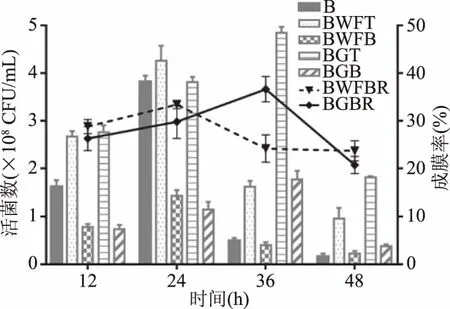
图4 不同发酵时间对双歧杆菌成膜的影响
2.3 生物膜形成对双歧杆菌冻干存活率的影响
生物膜细菌在不利环境条件下,会通过自身分泌的EPS聚合在固体表面,阻止了细菌与有害物质的直接接触,提高对恶劣环境的耐受性[9]。为了探究生物膜菌株和浮游菌株冻干耐受性的差异,通过不同发酵时间形成的生物膜菌株跟浮游菌株冻干存活率的比较(如表1),发现以小麦纤维和葡萄籽粉为载体形成的生物膜菌株冻干后的存活率明显高于浮游菌株,以葡萄籽粉为载体形成的双歧杆菌生物膜发酵培养36 h后的冻干存活率最高,可达到35.65%±2.26%,浮游菌株冻干存活率仅为5.51%±0.71%,提高了6.5倍(P<0.01)。而以小麦纤维为载体形成的双歧杆菌生物膜发酵培养24 h后的冻干存活率最高,为29.89%±5.12%,较浮游菌株冻干存活率7.43%±0.73%提高了4倍(P<0.01)。
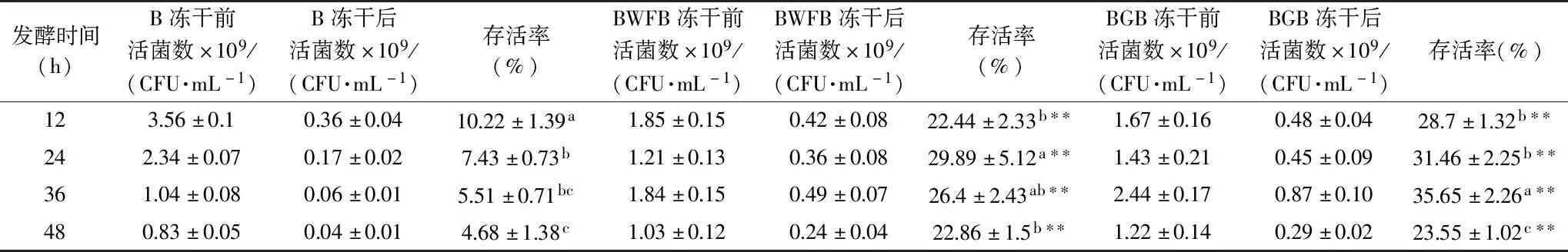
表1 生物膜菌株和游离菌株冻干存活率的变化
2.4 生物膜形成对双歧杆菌模拟胃肠液耐受性的影响
比较游离菌株和生物膜菌株对模拟胃肠液耐受性,结果如表2所示,游离菌株的模拟胃液和肠液存活率分别为10.1%±1.48%和1.07%±0.22%,而以葡萄籽粉和小麦纤维为载体形成的生物膜菌粉,其模拟胃液存活率分别提高了5.9倍和5.1倍(P<0.01),存活率达到59.82%±2.32%和51.98%±2.73%,模拟肠液提高了12.6倍和10倍,存活率达到13.53%±1.5%和10.75%±3.29%,由此可见,生物膜状态下的双歧杆菌对模拟胃肠液的耐受性显著增加,Grossova等[9]研究结果表明,形成生物膜后的乳杆菌比游离菌株的耐酸耐胆盐能力显著增强,本实验得出结论与其基本一致。
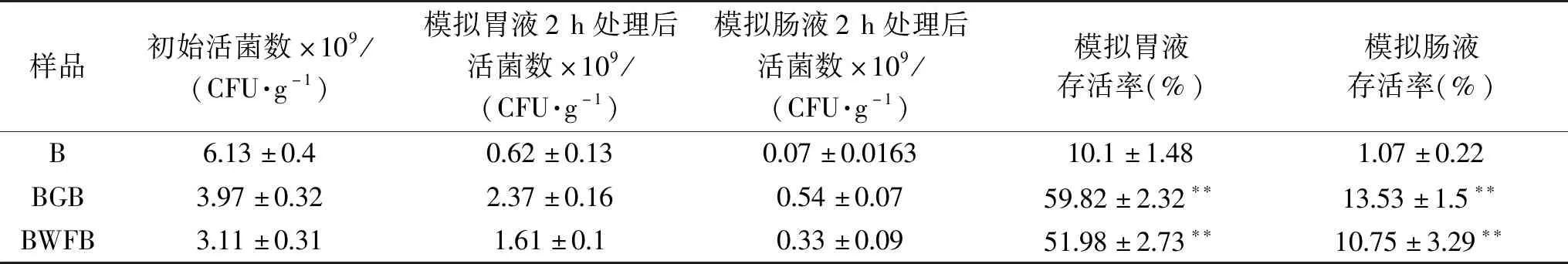
表2 生物膜菌株和游离菌株模拟胃肠液存活率的变化
3 结论
本实验通过比较双歧杆菌在6种非水溶性膳食纤维的成膜情况,得出双歧杆菌在葡萄籽粉上的成膜能力最强,其次是在小麦纤维上。另外发现基于不同载体的最佳成膜时间并不一致,基于葡萄籽粉最佳成膜时间为36 h,基于小麦纤维最佳成膜时间为24 h。进一步发现,双歧杆菌形成生物膜后其耐受性显著提高,冻干存活率提高4~6.5倍(P<0.01),模拟胃液耐受性提高5.1~5.9倍(P<0.01),模拟肠液存活率提高10~12.6倍(P<0.01)。研究结果表明虽然双歧杆菌在不同非水溶性膳食纤维上形成生物膜能力和成膜时间不同,形成生物膜后其抗逆性均显著提高,这一研究结果将为开发抗逆性益生菌制剂提供理论基础。
